كيف يقوم مصنع البروتين بدمج جزيئات الأحماض الأمينية وتكوين البروتينات منها

يعرف كل معلم في رياض الأطفال كيفية تعليم أطفال رياض الأطفال كيفية ربط الخرز على خيط وصنع خيط. ولكن بهذه الطريقة يتم إنشاء سلسلة عشوائية، أو حسب تفضيلات قافية السلسلة. ومن ناحية أخرى، يتم إنشاء جزيء البروتين، المبني على شكل نوع من سلسلة "الخرزات" وهي جزيئات من الأحماض الأمينية، في الريبوسوم، مصنع البروتين في الخلية، وفقا لخطة منظمة تمليها الشفرة الوراثية. ولكن كيف بالضبط يربط الريبوسوم الأحماض الأمينية ببعضها البعض ويخلق "سلسلة" البروتين؟ كيف يخلق الرابطة الببتيدية بينهما؟ هذا السؤال ظل مطروحا منذ سنوات طويلة، ولا يزال غير واضح تماما، ولكن في الآونة الأخيرة تم اتخاذ بعض الخطوات المهمة نحو حل اللغز. البروفيسور عادا يونات وأعضاء مجموعتها البحثية من قسم البيولوجيا البنيوية في معهد وايزمان للعلوم، الذين عملوا بالتعاون مع البروفيسور لويس ماسا من جامعة ولاية نيويورك، وجيروم كارلا، الحائز على جائزة نوبل عام 1985 جائزة الفيزياء من معاهد البحوث البحرية الأمريكية، هي المسؤولة عن هذا الإنجاز.
وفي دراسات سابقة، تمكن البروفيسور يونات من فك البنية المكانية ثلاثية الأبعاد للريبوسوم، وهو هيكل يحتوي على عدة بروتينات، وتوضيح مبادئ عمله.
كما شارك في هذا العمل علماء من معهد ماكس بلانك في ألمانيا، والذي تم تنفيذه في الماضي واستمر لأكثر من 20 عاما. ومن أجل فك بنية الريبوسوم، استخدم العلماء تقنية تسمى علم البلورات بالأشعة السينية. في الخطوة الأولى من هذه الطريقة، يجب إنشاء بلورات من البروتين، أو من الجسيم المدروس. ويتم تشعيع هذه البلورات بالأشعة السينية، ومن ثم يتم قياس الإشعاع المنبعث من البلورة، ومعالجة البيانات، ورسم خريطة توزيع كثافة المادة المقاسة في الفضاء. تعلم هذه المعلومات العلماء عن البنية المكانية للجزيئات التي تشكل البلورة.
هكذا تمكنت البروفيسورة يونات وأعضاء مجموعة البحث التي ترأسها من فك رموز بنية الريبوسوم، ومن ثم "تصوير" وحدته الفرعية، المسماة S30 وS50، في تكويناتها النشطة. هكذا تمكن أعضاء فريق بحث البروفيسور يونات من "رؤية" الوحدة الفرعية الصغيرة، في المرحلة التي تم فيها الاتصال الأول بين جزيء الحمض النووي الريبي المرسال والريبوسوم. يشير هذا الاتصال إلى إمكانية بدء عملية إنتاج البروتين وفقًا للمعلومات الجينية المحمولة في جزيء الحمض النووي الريبي المرسال. وهكذا، في الواقع، يقرأ الريبوسوم السلسلة الجزيئية للحمض النووي الريبوزي الرسول، وبناء على المعلومات الواردة فيه، يقوم بإنشاء سلسلة جزيئية بروتينية، مبنية من الأحماض الأمينية في عملية كيميائية تتم في الوحدة الفرعية الكبيرة للريبوسوم.
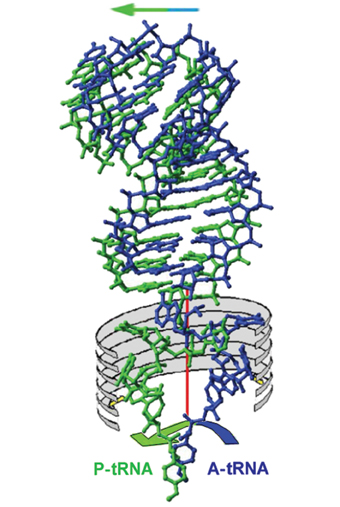
في عملية تكوين البروتين في الريبوسوم، تشارك "شاحنات" جزيئية تسمى tRNA، والتي تنقل جزيئات الأحماض الأمينية إلى الريبوسوم. في الواقع، كل حمض أميني لديه "شاحنة" فريدة خاصة به، والتي تعرف كيفية قراءة ترميزه فقط، ولا تحمله إلا. على الرغم من هذا التفرد الوظيفي، فقد اتضح أن جميع "الشاحنات" لها هيكل مماثل. اكتشف العالمان آرون كيلوج، الحائز على جائزة نوبل في الكيمياء عام 1982، وألكسندر ريتش (كلاهما عضوان في مجلس إدارة معهد وايزمان للعلوم)، اللذين ركزا على البنية المكانية ثلاثية الأبعاد للحمض الريبي النووي النقال، بنية الحمض النووي الريبوزي الناقل. "الشاحنات" كما تظهر عندما لا تكون مرتبطة بالريبوسوم: فهي تتكون في الغالب من شريط مزدوج من الحمض النووي الريبوزي (RNA)، لكن الطرفين بخصائص فريدة ووظيفة كيميائية وبيولوجية مصنوعة من سلسلة مفردة مرنة للغاية. .
إن "الشاحنة" المختارة وفقا للتشفير الموجود في الشفرة الوراثية ترتبط من ناحية بجزيء الحمض النووي الريبي المرسال، وبما أنها تحمل الحمض الأميني المناسب، فإنها في الواقع تقود جزيء الحمض الأميني إلى سلسلة البروتين الناشئة. عندما تقوم إحدى هذه "الشاحنة" بدورها، فإنها تفسح المجال لـ "شاحنة" أخرى تحمل حمضًا أمينيًا آخر، وهكذا تتكرر العملية حتى اكتمال سلسلة البروتين.
كما اكتشف كيلوج وريتش، تتكون "الشاحنة" (TRNA) من جزأين، جزء واحد يمكن أن يتغير هيكله بسهولة نسبية، في حين أن الجزء الآخر له هيكل أكثر ديمومة. يتضمن الجزء الدائم نوعًا من "الصيد" الذي يحمل جزيء الحمض الأميني. أظهرت البروفيسور يونات وأعضاء مجموعتها البحثية أنه أثناء عملية تكوين الرابطة الببتيدية، يتحرك جزء واحد من الحمض الريبي النووي النقال للأمام مع جزيء الحمض النووي الريبي المرسال (لتعزيز الشفرة الوراثية)، بينما الجزء الآخر (أي ، الـ RNA المفرد) يدور، حيث تعمل نقطة الاتصال بين الجزء الثابت وشريط RNA المفرد كمحور. وهكذا، عند كل منعطف، يقوم الجزء الدوار من "الشاحنة" بإحضار حمض أميني آخر إلى البروتين الناتج. الحركة الدورانية ممكنة لأن الموقعين على الريبوسوم الذي ترتبط بهما الوحدة المتحركة للـ tRNA متماثلان، وبهذه الطريقة يتم تحديد اتجاه الحركة الدورانية ودعمها بالإطار الذي يعد حجر الزاوية في بنية الريبوسوم.
إن البنية المكانية ثلاثية الأبعاد لوحدة TRNA المجانية معروفة منذ عقدين من الزمن. ومع ذلك، فإن التغييرات التي تحدث عند الارتباط بالريبوسوم لا تزال قيد الدراسة. تنبع صعوبة فك اللغز من حقيقة أنه فور ارتباطه بالحمض النووي الريبي المرسال (من ناحية) وبالحمض الأميني (من ناحية أخرى) يبدأ في التحرك والتصرف بسرعة كبيرة. هذه السرعة تجعل من الصعب على العلماء الذين يحاولون "تجميد" الوحدة في مواقف معينة وفك رموز بنيتها. واستخدم أعضاء فريق البروفيسور يونات البحثي جزيئات تحاكيها، وتمكنوا بهذه الطريقة من فك بنية وحدة TRNA التي تحمل الحمض الأميني عندما يرتبط بنصف الموقع النشط لـ "الشاحنة". وبعد اكتشاف التناظر الذي يسبب الحركة الدورانية، تمكن العلماء من حساب موضع وحدة TRNA الثانية. أدى هذا الاكتشاف إلى تقدم كبير في رحلة البحث لكشف أسرار الرابطة الببتيدية، لكن لم يكن من الواضح متى وأين يتم بناء سلسلة البروتين. أي ما إذا كانت الأحماض الأمينية مرتبطة بسلسلة البروتين الناشئة قبل أو بعد أو أثناء الدوران.
للإجابة على هذا السؤال، تعاون البروفيسور يونات مع العالمين لويس ماسا من جامعة ولاية نيويورك، وجيروم كارلا، الحائز على جائزة نوبل في الفيزياء عام 1985 من معاهد البحوث البحرية الأمريكية. واستخدموا معًا طريقة تسمى "علم البلورات الكمومية"، تعتمد على حساب العلاقة الكمية بين الذرات التي تشكل الوحدة المدروسة. ومن الناحية العملية، ركزوا على الذرات الخمسين الموجودة حول المنطقة في وحدة tRNA التي تصنع الرابطة الببتيدية، وحسبوا كيف سترتب هذه الذرات نفسها في الفضاء إذا مُنحت الحرية الكاملة. في مثل هذه الظروف، فإن البنية التي "تفضلها" الذرات هي البنية التي تتطلب صيانتها إنفاق أقل قدر من الطاقة. هذه هي الطريقة التي تمكنوا بها من "التقاط" TRNA في حالة متوسطة أثناء الدوران. وأظهرت عملية حسابية أخرى أن الطاقة اللازمة للعملية يتم إنتاجها، بالإضافة إلى الطاقة "المخصصة" لدفع حركة الشفرة الوراثية ككل، وأيضا من تكوين وتكسير الروابط الكيميائية بين المنطقة الدوارة وإطار الجسم. الريبوسوم أثناء عملية الدوران. وقد نشرت نتائج هذه الدراسة مؤخرا في المجلة العلمية "سجلات أكاديمية العلوم في الولايات المتحدة" PNAS.
 البروفيسور يونات: "بعض أدوية المضادات الحيوية تضر البكتيريا عندما تلتصق بموقع الارتباط لوحدة tRNA في الريبوسومات الخاصة بها، مما يؤدي إلى شلها، وبالتالي منع تكوين بروتينات جديدة ضرورية للبكتيريا. إن الفهم الذي توصلنا إليه فيما يتعلق بالطريقة التي يتم بها بناء البروتين في الريبوسوم سيسمح بتطوير أدوية المضادات الحيوية الأكثر فعالية، والتي يمكن أن تضر أيضًا البكتيريا التي طورت بالفعل مقاومة ضد أدوية المضادات الحيوية الموجودة.
البروفيسور يونات: "بعض أدوية المضادات الحيوية تضر البكتيريا عندما تلتصق بموقع الارتباط لوحدة tRNA في الريبوسومات الخاصة بها، مما يؤدي إلى شلها، وبالتالي منع تكوين بروتينات جديدة ضرورية للبكتيريا. إن الفهم الذي توصلنا إليه فيما يتعلق بالطريقة التي يتم بها بناء البروتين في الريبوسوم سيسمح بتطوير أدوية المضادات الحيوية الأكثر فعالية، والتي يمكن أن تضر أيضًا البكتيريا التي طورت بالفعل مقاومة ضد أدوية المضادات الحيوية الموجودة.
في عملية التدوير. وقد نشرت نتائج هذه الدراسة مؤخرا في المجلة العلمية "سجلات أكاديمية العلوم في الولايات المتحدة" PNAS.

تعليقات 6
لن أتعلق به ولكن الآن سوف أتعلق به أكثر من ذلك بكثير.
شكرا جزيلا لك
أنت على حق بنسبة 100%، وأنا أيضًا في روضة الأطفال وأعتقد ذلك.