تبحث دراسة جديدة في كيفية تسبب الخلايا الالتهابية في حدوث عمليات سرطانية في الخلايا المجاورة لها. تطبيقه قد يساعد في منع الأورام
ميريت سلين
الرابط المباشر لهذه الصفحة: https://www.hayadan.org.il/memet270804.html
يعود الباحثون في مجال السرطان إلى نظرية ظلت مهملة لسنوات طويلة. منذ حوالي 150 عامًا، ادعى عالم الأمراض رودولف ويركوف، الذي اعتمد على النتائج المرضية التي قام بتشخيصها، أن الالتهاب المزمن يسبب السرطان. اليوم، يعتقد معظم الباحثين العاملين في هذا المجال أن مثل هذا الارتباط موجود بالفعل. على سبيل المثال، تتطور معظم حالات سرطان الكبد نتيجة التهاب مزمن في الكبد، ناجم عن الإصابة بفيروس التهاب الكبد (يرقان الكبد المعدي). كما تؤدي الالتهابات المزمنة في المعدة والقولون في بعض الأحيان إلى تطور الأورام الخبيثة. تشير التقديرات إلى أن حوالي 20% من جميع حالات السرطان تتطور نتيجة الالتهاب المزمن.
لقد حاول الباحثون فهم كيف تسبب العمليات الالتهابية السرطان. واكتشف فريق من الباحثين من الجامعة العبرية ومركز هداسا عين كارم الطبي العامل المسؤول عن هذا الارتباط. ونشرت نتائج أبحاثهم أمس في النسخة الإلكترونية لمجلة "الطبيعة" الأسبوعية، تمهيداً لنشرها مستقبلاً في الطبعة العادية.
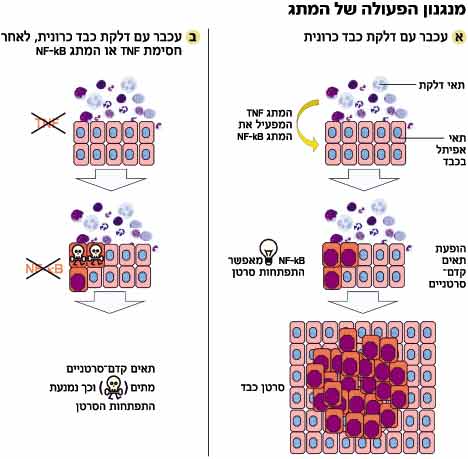
الالتهاب هو استجابة الجسم الطبيعية للمواقف الخطرة - غزو عامل أجنبي، والتلوث بالمواد الكيميائية، والتعرض للسموم، وأكثر من ذلك. في كل هذه الحالات، يتم تعبئة الخلايا الالتهابية للقضاء على العامل المسبب. في معظم الحالات تكون العملية الالتهابية محدودة وتنتهي بالشفاء، لكنها في بعض الأحيان تخرج عن نطاق السيطرة وتصبح مزمنة. وفي هذه الحالات يكون خطر تطور الأورام السرطانية كبيرا.
في المناطق المتضررة من الالتهاب المزمن، تكون الخلايا الالتهابية على مقربة من الخلايا الظهارية (الخلايا المغطاة). يؤدي هذا القرب إلى تكوين عمليات في الخلايا الظهارية لا تحدث في الحالة الطبيعية. في الحالة الطبيعية، تمر الخلايا الظهارية (مثل معظم خلايا الجسم) بدورات حياة من الانقسام والتكاثر من جهة والموت من جهة أخرى، وبالتالي تحافظ على عددها الثابت في الجسم.
لكن في الخلايا المجاورة للخلايا الالتهابية، ينزعج التوازن - عدد الخلايا المنقسمة يتجاوز عدد الخلايا الميتة. وتستمر الخلايا الزائدة في التراكم، وهي حالة تعرف باسم "الخلايا السابقة للسرطان". وتترافق هذه العملية مع حدوث طفرات، مما يؤدي إلى إتلاف آليات التحكم الطبيعية الموجودة في كل خلية، والتي يتمثل دورها في الحماية من تكوين الأورام الخبيثة. ظهور المزيد والمزيد من الطفرات يخلق سرطانًا متطورًا.
ونظرًا للقرب والاتصال بين الخلايا الالتهابية والخلايا الظهارية، افترض أعضاء الفريق أن الخلايا الالتهابية تنقل إشارة خاصة إلى الخلايا الظهارية - مما يسبب تغيرات بداخلها ويجعلها عرضة للإصابة بالسرطان. "من أجل تحديد التغيير، بحثنا عن مرشح مناسب"، يقول البروفيسور يانون بن ناريا من مركز لوتنبرغ في كلية الطب في الجامعة العبرية، الذي أجرى الدراسة مع الدكتور إيلي بيكارسكي من قسم علم الأمراض. في مركز هداسا عين كارم الطبي وفريق من الباحثين.
وقع الاختيار على البروتين NF-kB (kappa NF-B)، الذي اكتشفه ديفيد بالتيمور الحائز على جائزة نوبل منذ حوالي 20 عامًا، وتبين أنه عامل تحكم مركزي في الخلية الحية. البروتين هو في الواقع مفتاح في الخلية. يتحول إلى حالة نشطة (تشغيل) في نواة الخلية، عندما يتلقى إشارات من الخلية. عندما تهاجم بكتيريا عنيفة الخلية، يتم على الفور تنشيط سلسلة إشارة تنقل المعلومات حول الهجوم إلى نواة الخلية، حيث يتم إعطاء أمر لتنشيط الجينات التي تنتج البروتينات التي تحارب البكتيريا - على سبيل المثال، الأجسام المضادة. تم العثور على NF-kB في النواة عند تقاطع مركزي، والذي ينقل العديد من الإشارات الواردة إلى الخلية وخارجها.
"نحن نعلم أن NF-kB هو العامل الرئيسي الذي ينشط تفاعلات الجهاز المناعي، ويتم تنشيطه أحيانًا، لسبب غير معروف، في أنواع معينة من السرطان. ومع ذلك، لم يكن من الواضح ما إذا كان تنشيطه هو سبب عملية السرطان أم نتيجة لها"، كما يقول بيكارسكي. "أدت المعرفة التي جمعناها إلى افتراض أنه مع وجود احتمالية عالية نسبيًا، قد يكون NF-kB هو المرشح الذي يتحول إلى حالة التشغيل في الخلايا الظهارية، بعد الاتصال بالخلايا الالتهابية، وقد يكون مسؤولاً عن الآلية التي يغير التوازن بين انتشار وموت الخلايا الظهارية."
ولاختبار فرضيتهم، أنشأ الباحثون سلالة من الفئران المعدلة وراثيا، حيث تم إيقاف تشغيل مفتاح NF-kB. ويوضح بيكارسكي أنه في هذه الحالة، يستمر الالتهاب، ويكون الاحتكاك بين الخلايا ثابتًا، لكن التبديل لا ينشط الجينات. "أظهرت النتائج أننا تمكنا من التوصل إلى توازن متجدد بين تكاثر الخلايا الظهارية وموتها. وفي الفئران التي أطفأوا فيها المفتاح، زاد موت الخلايا الظهارية ولم يصاب معظمهم بالأورام".
والسؤال التالي الذي واجهه الباحثون هو من قام بتشغيل المفتاح. "لقد قادتنا البيانات إلى بروتين TNF ألفا، الذي يتم إطلاقه بعد الالتهاب وينقل الرسائل بين الخلايا. يقول بن ناريا: "إن المادة معروفة والأجسام المضادة التي تحيدها تستخدم في العلاج المستمر لمختلف الأمراض الالتهابية". "للتحقق مما إذا كان ينشط بالفعل NF-kB، قمنا بحقن الفئران التي تعاني من التهاب الكبد المزمن بجسم مضاد يحيد TNF alpha. وبهذه الطريقة، خلقنا وضعًا يظل فيه الإشعال سليمًا، وكل ما يتبقى هو التحقق مما إذا كان المفتاح قيد التشغيل أم لا." وتبين أن المفتاح لم يتم تشغيله، ونتيجة لذلك ماتت الخلايا السرطانية التي بدأت في التشكل واحدة تلو الأخرى. يقول بن ناريا: "لقد كانت ضربة قوية، والآن نعرف من المسؤول عن تطور السرطان في التهاب الكبد ومن ينشطه".
قد يكون لهذا الاكتشاف آثار طبية تطبيقية. يقول بيكارسكي: "اليوم، لدى العديد من المرضى، لا توجد طريقة لمنع الالتهاب المزمن ولا توجد طريقة معروفة لمنع العملية السرطانية". "بعد النتائج التي توصلنا إليها، نعتقد أنه من الممكن عكس العملية في مرحلة مبكرة عندما تكون الخلايا الظهارية لا تزال في حالة ما قبل السرطان. في هذه المرحلة، من الممكن التدخل باستخدام الأدوية المعتمدة على الأجسام المضادة ضد بروتين TNF ألفا، والتي ستمنع نشاطه وبالتالي تعيد -kB NF إلى حالة التوقف. إن العلاج بمواد تحجب عامل TNF ألفا يعني أنه في كل مرة ترفع فيها الخلية السرطانية رأسها، فإننا نقطعها ونخلق حالة حيث يبقى الورم في حالته الأولية، وهو غير ضار".
ويؤكد الباحثون أن النتائج التي تم الحصول عليها على الفئران هي بالفعل مشجعة، ولكن يجب إجراء تجارب إضافية على الفئران من أجل تأكيدها. ولتنفيذ العلاج على البشر، ستكون هناك حاجة لتجارب سريرية خاضعة للرقابة. البحث، الذي استمر أربع سنوات وتكلف 400 ألف دولار، تم دعمه من قبل مؤسسة العلوم الوطنية ومؤسسة خاصة تهدف إلى تعزيز الأبحاث في علاج سرطان البروستاتا.
https://www.hayadan.org.il/BuildaGate4/general2/data_card.php?Cat=~~~935021620~~~178&SiteName=hayadan
