كيف يمكن كبح نشاط إنزيم 3-GSK الذي يؤدي فرط نشاطه إلى ظهور أمراض مثل السكري والزهايمر؟ وباستخدام نماذج حاسوبية أنتجها علماء من معهد وايزمان، نجحت مجموعة بحثية في جامعة تل أبيب في تطوير بروتين قصير ("الببتيد") يتنافس مع الركيزة التي يرتبط بها الإنزيم، وبالتالي يثبط نشاط الإنزيم. وعندما تم إعطاء الببتيد لفئران تعاني من مرض مشابه لمرض الزهايمر، أصبح من الواضح أن أعراضها تحسنت بعد استخدامه.
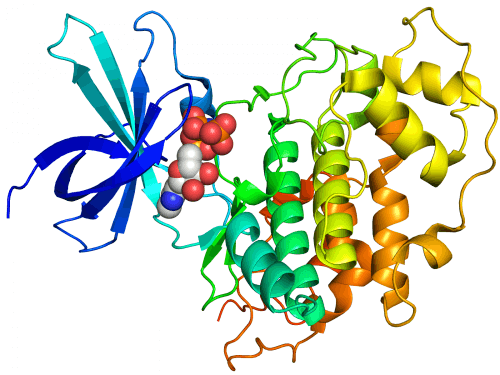
تقول الدكتورة ميريام آيزنشتاين، رئيسة وحدة بناء النماذج الجزيئية الكبيرة في قسم البنية التحتية للبحوث الكيميائية في معهد وايزمان للعلوم: "إن إنشاء نماذج جزيئية محوسبة هو في بعض الأحيان الطريقة الوحيدة لفهم كيفية عمل الجزيئات المعقدة مثل البروتينات معًا". . منذ حوالي عقدين من الزمن، وكجزء من بحث مشترك أجرته مع البروفيسور الراحل إفرايم كاتسير، كانت الدكتورة آيزنشتاين من بين الأوائل في العالم الذين طوروا طرقًا محوسبة للتنبؤ بكيفية ارتباط الجزيئات البيولوجية ببعضها البعض (طرق الالتحام الجزيئي) ). ومنذ ذلك الحين، تعاونت مع مجموعة واسعة من المجموعات البحثية، داخل المعهد وخارجه.
على الرغم من خبرتها الواسعة في هذا المجال، تشهد الدكتورة آيزنشتاين أن سلوك البروتينات ينجح في بعض الأحيان في مفاجأتها. حدث هذا، على سبيل المثال، في دراسة أجرتها مؤخرًا بالاشتراك مع مجموعة بحث البروفيسور حاجيت ألدر فينكلمان من جامعة تل أبيب. الدراسة تم النشر مؤخرا في العلوم Signalingg. وتقول: "إن نتائج هذه الدراسة، التي ظهر منها اتجاه جديد وواعد لعلاج مرض الزهايمر، كانت مفاجئة بالتأكيد".
وتناولت الدراسة إنزيما يسمى 3-GSK، والذي يؤثر على عمل البروتينات الأخرى في الجسم، وبالتالي فهو ضروري للغاية. "يضيف 3-GSK علامة كيميائية (مجموعة فوسفات) إلى البروتينات والركائز الأخرى، وبالتالي يحدد مصيرها - فهو يحدد ما إذا كانت ستكون نشطة، أو غير نشطة، أو متجهة للتدمير"، يوضح الدكتور آيزنشتاين. "مصدر الفوسفات موجود في جزيء صغير في الخلية يسمى ATP. يرتبط هذا الجزيء، مع الركيزة، بالإنزيم، ويقوم الإنزيم بنقل مجموعة الفوسفات من ATP إلى الركيزة." المشكلة هي أنه في حالة النشاط الزائد، يساهم GSK-3 في ظهور أمراض مختلفة، بما في ذلك مرض السكري ومرض الزهايمر. ولهذا السبب، كان مختبر البروفيسور ألدر فينكلمان يبحث عن طريقة يمكنها الحد من نشاطه.
"حتى الآن، ركزت جهود العلماء للحد من نشاط GSK-3 على منع ارتباط الإنزيم بـ ATP. لكن الوقاية من هذا الارتباط ليست انتقائية، يؤكد الدكتور آيزنشتاين، "مما يعني أنه يؤدي إلى حجب إنزيمات أخرى مماثلة، ونتيجة لذلك، قد تظهر آثار جانبية غير مرغوب فيها".

في ضوء ذلك، قررت البروفيسور ألدر-فينكلمان ومجموعتها اتباع اتجاه مختلف في أبحاثهم. لقد سعوا إلى تثبيط نشاط الإنزيم ليس عن طريق ATP، ولكن عن طريق تلك المنطقة في الإنزيم التي ترتبط بها الركيزة. "كانت الفكرة هي محاولة تطوير بروتين بديل للركيزة في المختبر، والذي يمكن أن يتنافس معه على الارتباط بالإنزيم، وبالتالي التدخل في نشاط الإنزيم"، يوضح الدكتور آيزنشتاين. وأجرت المجموعة البحثية في جامعة تل أبيب سلسلة من التجارب في المختبر، وتمكنت من تحديد الببتيد (تسلسل قصير من الأحماض الأمينية، اللبنات الأساسية للبروتينات) المناسب لهذا الغرض. في هذه المرحلة، توجه البروفيسور ألدر-فينكلمان إلى الدكتورة آيزنشتاين طالبًا مساعدتها في تحسين الببتيد، وتصميم ببتيدات إضافية من شأنها أن تتنافس مع الركيزة بشكل أكثر فعالية. يقول الدكتور أيزنشتاين: "لقد شاركت في البحث، وفي الخطوة الأولى قمت بإنشاء نماذج حاسوبية لارتباط الإنزيم مع الركيزة، وارتباط الإنزيم مع الببتيد". "في ضوء ما أظهرته النماذج، اقترحت على مجموعة البروفيسور ألدر فينكلمان البحثية إجراء بعض التحسينات في بنية الببتيد، وفي التجارب المعملية التي أجراها أصبح من الواضح أن هذه التحسينات مفيدة بالفعل. ومن خلال قيامهم بذلك، فقد دعموا صحة النماذج الحاسوبية."
وفي وقت لاحق، قام علماء من جامعة تل أبيب بتصميم بعض الببتيدات الإضافية بشكل مشترك مع الدكتور آيزنشتاين، واختبروا قدرتها على الارتباط بالإنزيم. "بناءً على حساباتي، توقعت أن أحد تلك الببتيدات سيعمل كركيزة، وفي التجارب المعملية تبين أن هذا هو الحال. أي أنه في المختبر اتضح أن الببتيد يرتبط بالإنزيم ويتلقى علامة الفوسفات،" كما يقول الدكتور آيزنشتاين.
ولكن بعد ذلك أدرك العلماء أنه في نهاية عملية وضع العلامات، ظل الببتيد مرتبطًا بالإنزيم. يقول الدكتور أيزنشتاين: "كان هذا الارتباط أكثر متانة من ارتباط الببتيد الأصلي". "لقد كان هذا اكتشافًا مفاجئًا، لأنه بعد وضع العلامات، كان من المفترض أن يتم رفض الركيزة من موقع الارتباط الخاص بها بواسطة الإنزيم وفصلها عنه." الحسابات التي أجرتها أوضحت الصورة. "لقد اكتشفنا أن الببتيد الموسوم يغير شكله، ويرتبط بالإنزيم بطريقة مختلفة مقارنة بالارتباط الأولي كركيزة. والنتيجة هي ارتباط قوي بشكل خاص: هذه هي الطريقة التي يمنع بها الببتيد الموسوم الإنزيم من الارتباط ووضع علامات على ركائز أخرى."
قامت مجموعة البحث التابعة للبروفيسور ألدر-فينكلمان باختبار فعالية الببتيد في التجارب على الحيوانات. وقد أعطوا الببتيد لفئران تعاني من مرض مشابه لمرض الزهايمر، ووجدوا أن أعراض الفئران تحسنت بعد استخدامه. يقول الدكتور أيزنشتاين: "يوضح نجاح التجربة أن هناك قيمة كبيرة في التعاون بين علماء الأحياء والعلماء الذين يتعاملون مع النماذج الجزيئية المحوسبة". "يتفهم البروفيسور ألدر-فينكلمان بعمق نشاط GSK-3 والحاجة إلى التحكم في نشاطه، بينما أنا مهتم بالطريقة التي ترتبط بها البروتينات وتتفاعل، وتقدم رؤى هيكلية للبحث."
وفي الختام، تضيف: "إن بناء النماذج الجزيئية المحوسبة هو أداة علمية مفيدة للغاية، مما يمنحني الفرصة للتعاون مع مجموعات بحثية متنوعة والمشاركة في العديد من الدراسات المثيرة للاهتمام. على الرغم من أن أجهزة الكمبيوتر التي أعمل بها أصبحت على مر السنين أكثر قوة وتطورًا، إلا أن أساسيات الكيمياء تظل كما هي، وعملنا القائم على الجمع بين الاثنين أصبح أكثر أهمية من أي وقت مضى.
