يقدم باحثون من معهد وايزمان معلومات جديدة عن الاختلافات ثلاثية الأبعاد بين نوعي تجمعات بروتين p53: الفجوة بين تسلسلات الرابط تتسبب في دوران زوجين من بروتين p53 بالنسبة لبعضهما البعض
وسببه هو التحكم المباشر في التعبير الجيني: عندما تكون الخلية في حالة من الضيق الذي يتطلب استجابة، مثل التعرض للسموم أو الإشعاع، يتم تنشيط p53 ويرتبط بمواقع مستهدفة محددة على الحمض النووي - أي، إلى منطقة معينة من التسلسل الجيني. وبهذه الطريقة يمكنه التحكم في معدل تحول هذه الجينات إلى بروتينات نشطة، وفي الواقع يمكنه تحديد استجابة الخلية للطوارئ.
يقول البروفيسور: "أحد الألغاز العظيمة هو كيفية تمكن بروتينات مثل p53 من تحديد مواقعها المستهدفة - تسلسل قصير من القواعد - في جزيئات الحمض النووي التي يبلغ طولها ثلاثة مليارات قاعدة، والقيام بذلك بدقة وفي وقت قصير جدًا". تسيبي شاكيد، رئيس قسم البيولوجيا البنيوية في كلية الكيمياء في المعهد، والذي يستخدم الأساليب البلورية لفحص الهياكل ثلاثية الأبعاد التي أنشأها p53 عندما يرتبط بمواقعه المستهدفة على الحمض النووي.
وفي حالة p53، فالأمر لغز مزدوج، حيث أن هذا البروتين يعرف عددًا كبيرًا من المواقع المستهدفة، ولكل منها تسلسل DNA خاص، لأنه مطلوب لتنظيم نشاط العديد من الجينات. بالإضافة إلى ذلك، عندما تكون الخلية في محنة، تقف p53 عند مفترق طرق حيث يتعين عليها "الاختيار" بين اتجاهين رئيسيين للعمل: الاتجاه الأول، في حالة تلف الحمض النووي البسيط نسبيًا، هو إيقاف عمليات انقسام الخلايا وتفعيل الآليات المسؤولة عن إصلاح التلف. الاتجاه الثاني، في الحالات التي لا يمكن فيها إصلاح الضرر الجيني، هو تنشيط الجينات التي تنفذ برنامج الانتحار الخلوي (موت الخلايا المبرمج)، من أجل الحفاظ على سلامة الإنتاج بأكمله. في كل من الخيارين، يقوم p53 بتنشيط جينات مختلفة، عن طريق الارتباط بمواقع مستهدفة خاصة، كل منها يولد سلسلة من الأحداث التي تنشط البروتينات التي تتعامل مع الموقف بطرق مختلفة. فكيف يتم الاختيار بين الخيارين؟ يمكن العثور على دليل محتمل لحل هذا السؤال في الطريقة التي يرتبط بها p53 بالمواقع المستهدفة المختلفة. أظهرت العديد من الدراسات أن هذه المواقع تتكون من تسلسلين مرتبطين (يبلغ طول كل منهما 10 أزواج قاعدية)، وترتبط بهما أربع جزيئات p53. في عام 2006، نجح فريق بحث البروفيسور شاكيد لأول مرة في إنشاء بلورات من رباعيات p53 المرتبطة بتسلسلات مختلفة من الحمض النووي، وفك رموز بنيتها ثلاثية الأبعاد.
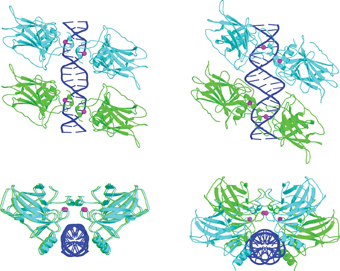
وأظهرت نتائج البحث، التي نشرت في مجلة Molecular Cell، أن زوجين من بروتينات p53 يرتبطان بتسلسلي الحمض النووي بجانب بعضهما البعض، مما يشكل مجمعًا رباعيًا. تم اكتشاف أيضًا أن المواقع المستهدفة من تسلسلات مختلفة لها أنماط مختلفة من التفاعلات مع p53: حيث تدور الأحماض الأمينية الموجودة في منطقة الارتباط للبروتين حول محورها وفقًا لتسلسل الحمض النووي الذي ترتبط به، حتى تلتصق به. أقوى طريقة. وفي دراسات لاحقة، في مجموعات بحثية إضافية، أصبح من الواضح أنه على الرغم من أن أربعة جزيئات بروتينية ترتبط في جميع الحالات بالحمض النووي، إلا أنه يمكن تقسيم المجاميع إلى نوعين رئيسيين، وفقًا للمواقع المستهدفة: في النوع الأول، يكون تسلسلا الارتباط هما مفصولة بسلسلة من أزواج القواعد ذات الطول غير المنتظم. وفي النوع الثاني لا يوجد انفصال، والتسلسلان متجاوران. كما وجد أن مواقع النوع الثاني، المرفقة، تقع قبل الجينات المرتبطة بإيقاف الانقسام، بينما مواقع النوع الأول المنفصلة، تقع قبل الجينات التي تقوم ببرنامج الاستموات.
في الهياكل البلورية التي درستها مجموعة البروفيسور شاكيد عام 2006، كانت المواقع المستهدفة من النوع المنفصل، لذلك تم طرح عدة أسئلة: هل هناك اختلافات في الترتيب المكاني لمجموعات p53 مع المواقع المستهدفة المختلفة؟ إذا كان الأمر كذلك، فماذا تعني هذه الاختلافات، وكيف تؤثر على التفاعل بين البروتينات والحمض النووي؟ وهل لها دور في تحديد المسار الذي يجب أن توجه إليه الخلية المتضررة؟ قامت البروفيسور شاكيد وأعضاء مجموعتها البحثية - باحثة ما بعد الدكتوراه د. مالكا كيتينر، وباحث مشارك د. حاييم روزنبرغ، وطالب البحث عوديد سعاد، والبروفيسور دوف رابينوفيتش - بدراسة نوع جديد من البلورات، حيث يرتبط p53 لاستهداف المواقع من النوع الضيق. توفر النتائج التي توصلوا إليها، والتي نُشرت مؤخرًا في مجلة Nature البيولوجيا البنيوية والجزيئية، معلومات جديدة حول الاختلافات ثلاثية الأبعاد بين نوعي الركام: المسافة بين تسلسلات الوصلات تتسبب في دوران الزوجين p53 بالنسبة لبعضهما البعض.

"يؤدي هذا التغيير البسيط على ما يبدو إلى تغيير كامل في بنية الركام، وفي تقارب البروتين مع الحمض النووي، وفي قدرة البروتينات الإضافية على الانضمام إلى البنية. في الواقع، إنه عالم من الاختلاف"، يقول البروفيسور شاكيد. بينما في الموقع المستهدف من النوع المجاور، يتم ترتيب رباعي البروتينات في زوجين متوازيين، في متوازي أضلاع مستو، في الموقع المستهدف من النوع غير المتجاور، يشكلون متوازي أضلاع ملتوي (انظر الشكل). في الشكل القريب، تكون التفاعلات بين البروتينات الأربعة أقوى بكثير، والبنية أكثر استقرارًا، والألفة للحمض النووي أقوى. عندما يكون الألفة أضعف، تكون هناك حاجة إلى بروتينات إضافية لتثبيت البنية. ومن الممكن أن تشارك مثل هذه البروتينات الإضافية في اتخاذ القرار بشأن محاولة إصلاح الضرر أو تدمير الخلية.
وعندما فحص العلماء الأزواج الأساسية واحدًا تلو الآخر، اكتشفوا اختلافًا آخر مثيرًا للاهتمام بين الموقعين المستهدفين. اتضح أنه في المواقع التي تفتقر إلى الربح، يتم تدوير قواعد الحمض النووي من نوع الأدينين بمقدار 180 درجة بالنسبة لشركائها من الشريط الموازي، قواعد الثيمين، مما يخلق بنية خاصة. أظهرت الحسابات التي أجراها علماء من جامعة كولومبيا في نيويورك أن الجذب الكهربائي القوي يساهم في زيادة استقرار الهياكل من هذا النوع. يقول البروفيسور شاكيد: "يوسع هذا الاكتشاف إمكانيات القراءة المعروفة لتسلسل الحمض النووي - ليس فقط فيما يتعلق بـ p53، ولكن أيضًا فيما يتعلق ببروتينات أخرى مماثلة". "اتضح أنه بالإضافة إلى المعلومات الموجودة في تسلسل القواعد، هناك أبجدية أخرى، تقع في الزاوية بين القواعد، مما يوسع من إمكانيات التعرف على الشفرة الوراثية."
تضم مجموعة البيولوجيا البنيوية لـ p53 أيضًا الدكتورة نعمة كيسلر، والدكتورة يائيل ديسكين بوزنر، وأمير ألدر، وأفيفا كابيتكوفسكي، وياكوف هالفون.

تعليقات 2
أولا وقبل كل شيء تم فحصه.
الشيء الثاني، بما أن البروتينات لها عمر محدود ويتم تشكيلها وإطلاقها باستمرار، فحتى لو تم تكوين بروتين غير طبيعي، فإن الضرر الذي يسببه يكون صغيرًا نسبيًا. ومن ناحية أخرى فإن الحمض النووي هو البرنامج وإذا تغير فإن الضرر يكون دائمًا.
نتحدث باستمرار عن تلف الحمض النووي بسبب السموم أو الإشعاع، مما يسبب طفرات وتلف في الحمض النووي يحتاج إلى إصلاح أو تدمير.
ولكن ماذا عن تلف البروتينات المساعدة مثل P53، حتى لو تم تكوينها بشكل طبيعي، فإن تلفها لاحقًا من الإشعاع أو السموم يسبب ضررًا كما لو أن الجين الذي خلقه قد تضرر ثم لا يقوم بوظيفته بشكل صحيح، في نظري في رأيي، يكفي أن يقوم بروتين واحد أو أكثر من البروتينات التي لا تؤدي وظيفتها بشكل صحيح، بتكوين خلايا خبيثة وليس نتيجة خلل في الجينات التي تصنعها.
صحيح أننا نتعامل هنا مع مدى توفر الضرر، وهي البروتينات التي تتغير بسرعة مقارنة بالحمض النووي الثابت، ولكن لا يزال يتعين التحقق من هذا الجانب أيضًا.