إن فهم آلية العمل قد يؤثر على علاجات السرطان وفرط التصبغ
الباحثون في التخنيون "اكتشفوا نشاط إنزيم التيروزيناز متلبسا على المستوى الجزيئي، باستخدام معدات متقدمة لعلم البلورات بالأشعة السينية. هذا ما ذكرته مجلة Nature Communications هذا الأسبوع.
تشارك في البحث كليتان تقنيتان: كلية التكنولوجيا الحيوية وهندسة الأغذية وكلية شوليش للكيمياء. في مختبر البروفيسور إيلات فيشمان، في كلية التكنولوجيا الحيوية وهندسة الأغذية، يتم التركيز على فهم العلاقة بين هياكل الإنزيمات ووظيفتها. أحد هذه الإنزيمات هو التيروزيناز، وهو شائع في جميع مستويات الحياة: في الكائنات الحية الدقيقة والنباتات والحيوانات. وهو المسؤول عن الخطوات الأولى في إنتاج صبغة الميلانين الداكنة. في جسم الإنسان، يوجد التيروزيناز في الخلايا الصباغية في البشرة، ولا يحدد الميلانين الناتج لون الجلد والشعر وشبكية العين فحسب، بل يلعب أيضًا دورًا مهمًا في الحماية من الأشعة فوق البنفسجية. وتعد الطفرة في هذا الإنزيم هي السبب الرئيسي للمهق (البياض)، مما يؤدي إلى اضطرابات بصرية وحساسية للإشعاع. في الفواكه والخضروات، يسبب نشاط التيروزيناز اللون البني، والنتيجة هي أضرار اقتصادية للمزارعين.
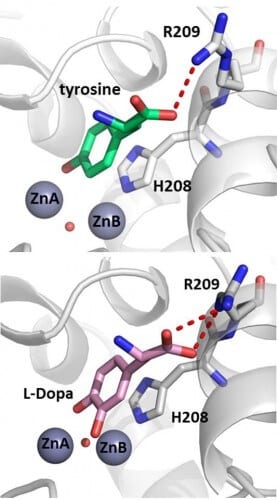
يقوم التيروزيناز بإجراء تفاعلي أكسدة متتاليين: تحويل الجزيئات العضوية الصغيرة (مثل الحمض الأميني تيروزين) إلى ثنائي الفينول، يليه تحويل ثنائي الفينول إلى كينون، مما يتيح تكوين الميلانين. يحتاج الإنزيم إلى أيوني نحاس، وكان الرأي السائد في المجتمع العلمي أن كل تفاعل من التفاعلين يحدث على أيون نحاس مختلف.
استخدم مور غولدفيدر، طالب الدكتوراه تحت إشراف مشترك مع البروفيسور نعوم أدير من كلية الكيمياء شوليش، وطالبة ما بعد الدكتوراه الدكتورة ريتا كانتيف، علم البلورات بالأشعة السينية لحل لأول مرة بنية التيروزيناز البكتيري في وجود الاثنين. الركائز: التيروزين أحادي الفينول، وثنائي الفينول دوبا (L-Dopa). بالإضافة إلى ذلك، تمكنوا من حل بنية تحتوي على ركيزة إضافية، حيث يمكن رؤية المنتج التحفيزي للإنزيم بوضوح أثناء تكوينه. وكان طالب الدكتوراه سيفان يساكر عوفادات، الذي يبحث في استخدامات الإنزيم في الغذاء، شريكًا في البحث. تثبت النتائج أن جميع الركائز مثبتة بنفس الطريقة تمامًا في الموقع النشط للإنزيم، وتواجه أيونًا واحدًا فقط من أيونات النحاس.
إن فهم آلية العمل وبنية التيروزيناز قد يساعد في علاج فرط التصبغ والبقع العمرية، وفي تحسين حساسية خلايا سرطان الجلد للعلاج الإشعاعي، وفي منع التحول إلى اللون البني في الفواكه والخضروات.
