اختارت مجلة SCIENCE، بالإضافة إلىاختراق السنة، عدد من الأحداث الجديرة بالذكر في عدة مجالات علمية. أحد هذه المجالات هو مجال علم الوراثة.

يرتبط التنوع الجيني بأكثر من 60,000 ألف مرض يصيب الإنسان، ما يقرب من 35,000 ألف منها ناجمة عن أخطاء صغيرة في الحمض النووي - تغيير في قاعدة واحدة عند نقطة معينة في الجينوم. هذا العام، أعلن الباحثون عن تحسن كبير في تقنية ناشئة، تسمى التحرير الأساسي، لتصحيح مثل هذه الطفرات النقطية، ليس فقط في الحمض النووي، ولكن أيضًا في الحمض النووي الريبي (RNA).
استخدم رائد هذا المجال، ديفيد ليو، الكيميائي في جامعة هارفارد، نظام تحرير القواعد كريسبر، والذي تم عرضه لأول مرة كأداة مختبرية قوية في عام 2012. وتتفوق تقنية كريسبر في قطع الحمض النووي في مواقع محددة، والكشف عن الأخطاء وإيقاف الجينات. ، ولكن حقق نجاحًا جزئيًا فقط في تصحيح الأخطاء الناجمة عن الطفرات النقطية، حيث تم استبدال إحدى قواعد الحمض النووي الأربعة (A وC وT وG) بأخرى. قامت مجموعة ليو بتعديل الخيارات الموجودة في كريسبر لإنشاء محرر القاعدة هذا الذي لا يقطع الحمض النووي في الموقع المستهدف، بل يستبدل قاعدة كيميائية بأخرى. في العام الماضي نجح الباحثون في استبدال C بـ T، وفي هذا العام استبدلوا G الخاطئ في الطفرة الأكثر شيوعًا. ومن الجدير بالذكر أن فريقًا منفصلًا، بقيادة تشانغ فانغ، من معهد برود القريب في كامبريدج، ماساتشوستس، قد أظهر تحريرًا أساسيًا، حيث استبدلوا G وA في الحمض النووي الريبوزي (RNA).
وفي هذا العام، أظهر الباحثون قوة القدرة على تعديل القواعد عن طريق تصحيح الطفرة المسببة للمرض في الأجنة البشرية. لم يعتزموا أبدًا تنمية الأجنة، ولم يكن الإصلاح ناجحًا دائمًا، لكن الإنجاز أثبت أن تحرير القاعدة ينطوي على إمكانات هائلة. ومن وجهة نظرهم، فإن كريسبر هدية لا تزال تحقق اختراقات.
علاج لمرض السرطان تتكيف معالحمض النووي السرطان وليس العضو الذي نشأ منه
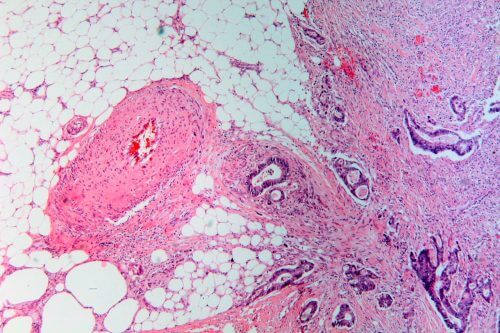
في شهر مايو/أيار، أعطت إدارة الغذاء والدواء الأمريكية (FDA) الضوء الأخضر لمنتج بيمبروليزوماب الذي تصنعه شركة ميرك، تحت الاسم التجاري كيترودا. الدواء، الذي تمت الموافقة عليه بالفعل لعلاج سرطان الجلد وحفنة من أنواع السرطان الأخرى، يُعطى الآن في أي حالة ورم صلب متقدم لدى الأطفال أو البالغين، بشرط واحد: أن تحمل الخلايا السرطانية خللًا. الاسم الغريب لنقص إصلاح عدم التطابق. إصلاح الحمض النووي اكتب MMR) وهذا يعني أنه إذا تم العثور على الخلايا السرطانية في البنكرياس أو القولون أو الغدة الدرقية أو أي من الأنسجة الأخرى، فيجب أن تحمل طفرة الحمض النووي التي يصححها الدواء.
إن موافقة إدارة الغذاء والدواء تنطوي على تغيير كبير في هذا المجال لأنها تظهر أن الأورام التي تنشأ من أعضاء مختلفة لديها الكثير من القواسم المشتركة. لكن تحويل هذه المعرفة إلى علاج لم يكن بالأمر السهل. حدث تقدم كبير في عام 2015، عندما قام الأطباء في جامعة جونز هوبكنز في بالتيمور بولاية ميريلاند، بقيادة لويس دياز من مركز ميموريال سلون كيترينج للسرطان في نيويورك، بدراسة البيمبروليزوماب على مرضى سرطان القولون. لقد لاحظوا شيئًا ملفتًا للنظر: في ثمانية من أصل 13 شخصًا يعانون من نقص إصلاح عدم التطابق، تقلصت الأورام، وفي أربعة آخرين احتفظوا بحجمهم لكنهم توقفوا عن النمو عندما تم إعطاء الدواء، شكل الدواء "حاجزًا مناعيًا مثبطًا" يسمح للخلايا بالنمو. جهاز المناعة لمحاربة السرطان. ولم يستجب 25 مريضًا آخر بسرطان القولون بدون الخلل للعلاج. ونظرية الأطباء هي أن الخلايا التي تحتوي على الحاجز تتراكم فيها مئات الطفرات، لكن الجهاز المناعي يتعرف على هذه الخلايا بسهولة على أنها غريبة ويقتلها.
وقد قامت دراسة نشرها دياز لي، من جامعة جونز هوبكنز، في يونيو/حزيران، ودراسات أخرى، بتوسيع نطاق التجربة لتشمل 86 مريضا يعانون من 12 نوعا مختلفا من السرطان، وجميعهم يعانون من نقص الإصلاح غير المتطابق. استجاب 53% للدواء. واستنادًا إلى هذه الدراسة، من بين أمور أخرى، وافقت إدارة الغذاء والدواء الأمريكية على دواء يأمل أطباء الأورام أن يكون الأول من بين العديد من الأدوية في الاستراتيجية الجديدة ضد السرطان.
انتصار للعلاج الجيني
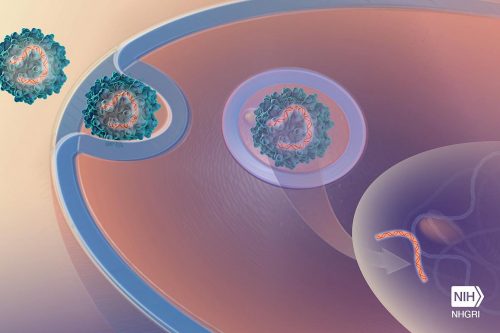
يلوح النجاح في تجربة سريرية صغيرة مثيرة بشكل كبير في مجال العلاج الجيني هذا العام. أفاد باحثون أنهم أنقذوا حياة أطفال ولدوا مصابين بضمور عضلي وراثي عن طريق إضافة جين لإضافة خلايا عصبية إلى العمود الفقري. إذا لم يتم علاج الأطفال، فقد يموتون عند عمر السنتين.
وتمثل التجربة أيضًا علامة فارقة أكثر أهمية، لأن الباحثين مرروا الجين الجديد عبر الغشاء الذي يحمي الدماغ والحبل الشوكي باستخدام مسببات الأمراض والسموم. يمكن لهذه التجربة أن تفتح الباب أمام العلاج الجيني لأمراض التنكس العصبي الأخرى.
وكان المفتاح هو فيروس غير ضار، يسمى AAV، يستخدم على نطاق واسع في العلاج الجيني في الفئران المختبرية. وفي عام 2009، اكتشفت مجموعات بحثية في فرنسا وفي مستشفى الأطفال في كولومبوس بولاية أوهايو أن سلالة من الفيروس تسمى AAV9 يتم حقنها عن طريق الوريد في الفئران حديثة الولادة يمكن أن تنتشر عبر الدماغ والحبل الشوكي.
الآن، أظهر الباحثون أن العلاج الجيني باستخدام AAV9 عن طريق الوريد يمكن أن يوقف ضمور العضلات الشوكي من النوع 1 (SMA1)، وهو السبب الجيني الأكثر شيوعًا للوفاة عند الرضع. عند الأطفال حديثي الولادة المصابين بـ SMA1، يكون البروتين اللازم لحركة الخلايا العصبية في العمود الفقري مفقودًا؛ وفي النهاية تضمر العضلات ولا يتمكن الأطفال حديثي الولادة من التنفس. وفي نوفمبر/تشرين الثاني، أفاد أعضاء المجموعة البحثية وشركة AveXis أن كل طفل من الأطفال الـ12 الذين تلقوا جرعة عالية من AAV9 يحملون جين البروتين المفقود، يمكنهم التحدث والأكل والجلوس بمفردهم، على الأقل لفترة قصيرة. حتى أن إحدى الفتيات تمكنت من المشي بسرعة وأصبحت فتاة نشيطة. وحقق الدواء الجديد نتائج مماثلة، لكن يجب حقنه في العمود الفقري كل بضعة أشهر.
يستخدم الباحثون الآن AAV9 الذي يحمل جينات أخرى لعلاج الأطفال الذين يعانون من اضطرابات دماغية وراثية حادة. وفي الماضي، كان على الباحثين حفر ثقوب في الجمجمة لتوصيل العلاج الجيني لهؤلاء الأطفال، وكان العلاج أيضًا غير فعال.
تم هذا العام إجراء علاجين للسرطان حيث تم تعديل الجهاز المناعي للمريض وراثيًا خارج جسده وتم زرعه مرة أخرى داخل جسمه. وتعتبر هذه العلاجات أولى العلاجات الجينية التي تصل إلى السوق الأمريكية. في 19 ديسمبر/كانون الأول، وافقت إدارة الغذاء والدواء (FDA) على أول علاج جيني لاضطراب وراثي نادر يسبب العمى.
ملخص عام 2017 على موقع المعرفة:

תגובה אחת
مقال واضح وجميل .