استخدم علماء معهد وايزمان للعلوم أساليب حسابية جديدة لتحديد جزيء ذو إمكانات طبية من شأنه أن يمنع الخلية من تلقي رسائل ضارة - دون تعطيل مرور الرسائل الحيوية
تتلقى خلايانا رسائل أكثر من الأجهزة المحمولة للمراهق العادي - وكما هو الحال مع المراهقين، سيكون من الأفضل تصفية بعض منها. استخدمت المجموعة البحثية للدكتور نير لندن من قسم الكيمياء العضوية في معهد وايزمان للعلوم، مع زملاء آخرين، أساليب حسابية جديدة لتحديد الجزيء الذي من شأنه أن يمنع الخلية من تلقي رسائل ضارة - دون تعطيل استقبال الرسائل. الرسائل الحيوية لوظيفتها. وقد نُشرت نتائج البحث مؤخراً في المجلة العلمية Cell – Chemical Biology.
عندما يتم استقبال الإشارة عبر السطح الخارجي للخلية ودخولها إلى الداخل، تنتقل المعلومات عبر بروتينات في أحد مسارات نقل الإشارة في الخلية حتى تصل إلى النواة. وفي معظم الحالات، تكون هذه رسائل تنظم وظائف الجسم المختلفة، لكن هذه الإشارات تلعب أيضًا دورًا في الأمراض - بدءًا من الالتهابات وأمراض المناعة الذاتية والتمثيل الغذائي وانتهاءً بعوامل النمو التي تتعطل في السرطان. المسار الذي درسه الدكتور لندن ومجموعته، والمعروف بالأحرف الأولى JNK، يتوسط، من بين أمور أخرى، الرسائل التي تسبب موت الخلايا بعد تراكم البلاك في الدماغ في مرض الزهايمر ويشارك أيضًا في العمليات الالتهابية الأخرى. تنقل جزيئات الإشارة في هذا المسار - البروتينات من مجموعة الكيناز - رسائلها من خلال "الفسفرة" (إضافة مجموعة مفسفرة) إلى البروتين التالي في السلسلة. قد تشتمل بداية المسار على عدة بروتينات كيناز، تسمى معًا MAP3K، لكن الرابط التالي يتكون من بروتينين فقط، MKK4 وMKK7، اللذان ينقلان الرسالة إلى الرابط الأخير في السلسلة، وهو بروتين JNK - وبعد ذلك المسار بأكمله. تم تسميته - وينقل الرسالة إلى بروتينات النسخ التي يتم "تشغيل" و"إيقاف" الجينات الموجودة في النواة.
يقول الدكتور لندن: "هذه هي الطريقة التي يتم بها بناء العديد من مسارات نقل الإشارة: الاختزال إلى اثنين من كيناز البروتين متبوعًا بعنق الزجاجة لبروتين واحد". "لقد استخدمنا هذه الميزة لتحديد النقطة الأكثر ملاءمة لتعطيل عملية نقل الإشارة إلى النواة. تتطلب بداية المسار، الذي يتكون من خمسة إلى عشرة بروتينات MAP3K، حجبها جميعًا. من ناحية أخرى، يلعب JNK الموجود في نهاية المسار أدوارًا في جميع خلايا الجسم، لذا فإن تعطيل عمله سيؤدي إلى آثار جانبية كبيرة. وبالتالي فإن بروتينات MKK هي "الحلقة الذهبية" في السلسلة. العلاج الدوائي الذي يركز على واحدة منها قد يقلل من تأثير الرسائل الضارة - دون عرقلة المسار تمامًا.
نظرًا لأن الجزيء يرتبط تساهميًا بالكيناز، فإنه يثبط البروتين طوال حياته. وهذا يعني أنه إذا أثبت الجزيء نفسه في التجارب السريرية، فمن الممكن إعطاؤه بجرعات صغيرة أو بشكل غير متكرر."
ركز الباحثون على أحد البروتينات - MKK7 - وهو كيناز يفتقر إلى مثبطات معروفة ولا توجد أبحاث كافية حوله، من بين أمور أخرى، لأنه حتى الآن لا توجد طريقة لفصل نشاطه عن نشاط شقيقه MKK4. ومن دواعي سرورهم أنهم اكتشفوا في MKK7 الحمض الأميني السيستين في وضع غير معهود. نظرًا لأن السيستين يمكن أن يشكل روابط كيميائية قوية وغير قابلة للعكس (من الناحية الكيميائية، الروابط التساهمية)، فإن الدواء الذي يرتبط بهذا الموقع المحدد يمكن أن يكون انتقائيًا للغاية، مما يعني أنه قد يسبب آثارًا جانبية قليلة جدًا.
في الماضي، طور الدكتور لندن طريقة حسابية لاكتشاف المركبات الكيميائية التي تمنع البروتينات تساهميًا. وتسمح له هذه الطريقة بمسح مكتبات ضخمة من الجزيئات من خلال المحاكاة الحاسوبية. يتطلب المعادل التجريبي لهذه الطريقة، المستندة إلى الميكنة الآلية ومكتبات المركبات الحقيقية في المختبر، وقتًا هائلاً وبنية تحتية وموارد هائلة، بينما يمكن على الكمبيوتر مسح مئات الآلاف من الجزيئات في المرة الواحدة. والأكثر من ذلك: هذه الطريقة تجعل من الممكن فحص ليس فقط الجزيئات الموجودة، ولكن أيضًا تلك التي لم تكن موجودة بعد.
تعاون الطالب الباحث أميت شراغا وأعضاء آخرون في مجموعة أبحاث الدكتور لندن في الدراسة مع مجموعة أبحاث الدكتور زيف شولمان من قسم علم المناعة؛ ومع الدكتور بروس ليبكر والدكتور تشاكراباني سوبرامانيام، العلماء الزائرين من معهد فايزر للبحث والتطوير في الولايات المتحدة، ومع زملائهم في مركز نانسي وستيفن جراند الوطني للطب الشخصي في حرم المعهد؛ مع البروفيسور تاكيوشي من جامعة أوساكا باليابان ومع الدكتور روبرت هودكينز من شركة "تيفا".
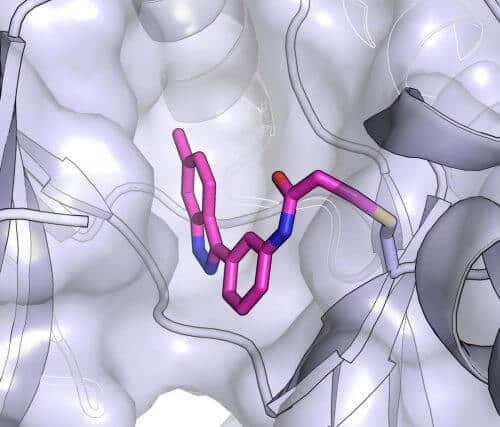
وبعد تحديد نحو عشر مواد واعدة من خلال المحاكاة الحاسوبية، تحول الباحثون إلى اختبارها في المختبر. وقد عملت ثلاثة منها بشكل جيد، ولكن واحدًا فقط ارتبط بالكيناز بكفاءة غير عادية. باستخدام البرنامج، أنشأ فريق البحث "نموذجًا ملزمًا" لفهم كيفية ارتباط المثبط بالبروتين بالضبط. وفقًا للنموذج، ابتكر العلماء أشكالًا مختلفة من المثبط للتحقق مما إذا كان من الممكن إضافته وتحسينه. وأخيرًا، وبالتعاون مع المختبر الياباني، أنشأ الباحثون بلورة من الجزيء مع الكيناز المستهدف - وهو نوع من الصور الفوتوغرافية للتفاعل، ولكن بدقة ذرية. ووجدوا أن موقع الربط الفعلي كان تمامًا كما تنبأ النموذج.
قد يكون للجزيء الذي حدده الدكتور لندن وأعضاء مجموعته تطبيقات طبية في منع الموت غير المرغوب فيه للخلايا في مرض الزهايمر، وفي تقليل الالتهاب في أمراض الأمعاء الالتهابية والسكري. "نظرًا لأن الجزيء يرتبط تساهميًا بالكيناز، فإنه يثبط البروتين طوال حياته. وهذا يعني أنه إذا أثبت الجزيء نفسه في التجارب السريرية - التي لا تزال بعيدة جدًا - فمن الممكن إعطاؤه بجرعات صغيرة أو بشكل غير متكرر". وتقدمت شركة "ياد"، الذراع التطبيقية للمعهد، بطلب براءة اختراع لهذا الجزيء.
