يعزز البحث الإسرائيلي الفرضية القائلة بأن سبب أمراض مثل الزهايمر والشلل الرعاش والسكري لدى البالغين ليس رواسب الأميلويد، بل هياكل بروتينية مستديرة تظهر قبل تكوين الرواسب
في الأمراض التي تظهر في سن الشيخوخة، مثل مرض الزهايمر، ومرض باركنسون، ومرض كروتزفيلد جاكوب، ومرض السكري لدى البالغين وأكثر من ذلك، تظهر الترسبات التي تبدو متطابقة تقريبًا تحت المجهر الإلكتروني. وفي عام 1901 اكتشف الطبيب الأمريكي يوجين أوبي هذه الترسبات في خلايا البنكرياس لدى مرضى السكري الذين توفوا، وفي عام 1906 اكتشفها الطبيب الألماني ألويس الزهايمر في دماغ مريض مسن يعاني من الخرف.
تم تسمية الرواسب بالأميلويدات لأنها كانت ملونة مثل النشا عند إضافة اليود إليها، وتتكون رواسب الأميلويد من البروتينات. تتكون البروتينات من سلاسل طويلة من الأحماض الأمينية، والتي يمكن طيها لتكوين عدد كبير جدًا من الهياكل ثلاثية الأبعاد. الافتراض المقبول هو أن اختلال البروتينات وارتباطها معًا لتكوين رواسب هو أساس أمراض الأميلويد، والتي لا علاقة لها بأي شيء آخر.
وبما أنه من المفترض أن الرواسب هي المسؤولة عن تطور الأمراض، فقد ركزت الأبحاث في هذا المجال على محاولة تفكيكها. ومع ذلك، فإن النتائج الميدانية لم تتطابق دائمًا مع النظرية. كانت هناك حالات وجدت فيها فحوصات ما بعد الوفاة كميات كبيرة من رواسب الأميلويد في أدمغة الأشخاص الذين لم يعانون من الأعراض السلوكية للأمراض.
ومن الأمثلة البارزة على ذلك الأخت مريم، الراهبة التي توفيت عن عمر يناهز 102 عامًا وتبرعت بجسدها للعلم. حتى يوم وفاتها، كانت الأخت ماري واضحة وحيوية، ولكن في فحص ما بعد الوفاة وجد أن دماغها كان مليئًا برواسب الأميلويد. أثارت هذه النتائج وغيرها الشكوك في أن الأضرار الناجمة عن الأمراض لا تنتج عن رواسب الأميلويد، بل عن مواد أخرى.
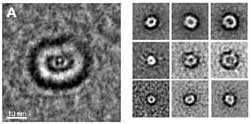
منذ حوالي عامين، افترض بيتر لانسبري من جامعة هارفارد أن أسباب أمراض الأميلويد هي هياكل بروتينية تظهر قبل تكوين الترسبات. حدد لانسبري هياكل دائرية تشبه الكعك، والتي ظهرت في المراحل الأولى من تكوين البروتينات المرتبطة بمرض الزهايمر ومرض باركنسون. أطلق على هذه الهياكل اسم "مسام الأميلويد".
قرر الدكتور إيهود غازيت من قسم البيولوجيا الجزيئية والتكنولوجيا الحيوية في جامعة تل أبيب التحقق مما إذا كانت "الكعك" التي حددها لانسبري تظهر أيضًا في أمراض الأميلويد الأخرى. ركز غازيت على مرض السكري لدى البالغين (مرض السكري من النوع 2)، وهو أحد أمراض الأميلويد الأكثر شيوعًا. أثناء المرض، يتوقف الجسم تدريجياً عن الاستجابة للأنسولين ويحتاج إلى كميات متزايدة منه، من أجل حقن السكر في الخلايا. وفي الوقت نفسه، يتم إفراز كميات كبيرة من بروتين الأميلين، مما يؤدي إلى تكوين رواسب الأميلويد التي تسبب تدمير البنكرياس.
يقول غازيت: "من المعروف أن أسماء الخلايا ناتجة عن ثقوب تتشكل في غشائها الخارجي". "لقد حاولنا أن نفهم أي من الهياكل المتكونة من بروتين الأميلين هي المسؤولة عن هذه الإصابة."
ولتحقيق هذه الغاية، استخدمت غازيت وطالب البحث يائير بورات طريقة طورها الدكتور راز يلينك والدكتورة صوفيا كولوشيفا من جامعة بن غوريون. قام الباحثون بتطوير غشاء خلية اصطناعي، يعمل بشكل مشابه للغشاء الطبيعي ويسمح بمراقبة ارتباط البروتينات به.
وضع غازيت وبورات محلولاً يحتوي على بروتين الأميلين البشري في ظل ظروف يشكل فيها البروتين هياكل الأميلويد. بعد ذلك، تم فصل جزأين عن المحلول: قطعة الكبد التي غرقت في أنبوب الاختبار، حيث تم العثور على رواسب الأميلويد؛ وقسم قابل للذوبان يحتوي على بروتينات الأميلين التي لم يكن لديها الوقت للتجمع معًا ومجموعات صغيرة من البروتينات التي لم تشكل رواسب بعد.
وفي الخطوة التالية، اختبر الباحثون قدرة الجزأين على الارتباط بغشاء الخلية. يقول غازيت: "اتضح لنا أن العمل الرئيسي للارتباط كان في القسم القابل للذوبان". "لقد اكتشفنا في هذا القسم عاملاً يدمر الغشاء ويختفي مع مرور الوقت. وهذا العامل النشط لم يتم العثور عليه في بداية التجربة، فهو يظهر بعد فترة ثم يختفي. ولذلك، كان من الواضح أن هذا عامل صغير تم بناؤه ثم تحلل، وليس البروتين نفسه".
وكانت الخطوة التالية هي تتبع الهياكل التي تتشكل في القسمين باستخدام المجهر الإلكتروني. يقول غازيت: "لقد رأينا أنه خلال ذروة الارتباط بالغشاء الاصطناعي، تظهر هياكل دائرية تشبه الدونات في القسم القابل للذوبان، والتي تشبه بشكل لافت للنظر تلك التي حددها بيتر لانسبري في مرض الزهايمر ومرض باركنسون". "علاوة على ذلك، كشف الفحص بالمجهر الإلكتروني أنه في حين أن الجزء الذي يحتوي على الهياكل الشبيهة بالدونات تسبب في انهيار كامل للبنية الغشائية، فإن رواسب الأميلويد لم تسبب أي ضرر لها. الاستنتاج الرئيسي من هذا هو أن العامل الضار الرئيسي ليس رواسب البروتين، ولكن الهياكل التي تتشكل قبله." ونشرت الدراسة في عدد سبتمبر من مجلة الكيمياء الحيوية".
ووفقا لجازيت، تؤكد النتائج على الحاجة إلى تحويل تركيز البحث من تفكيك الرواسب إلى منع تكوينها في المراحل المبكرة من مرض السكري، عندما تظهر الهياكل التي تشبه الدونات. حتى أنه أظهر في التجارب الأولية أن الجزيئات الحلقية الصغيرة تمنع العملية المؤدية إلى تكوين الراسب. تعزز هذه التجارب النهج الذي بموجبه تثبيط تكوين الهياكل الشبيهة بالدونت قد يمنع تطور مرض السكري.
