هل ستغير الخلايا الجذعية تعريف الإصابات "غير القابلة للشفاء" والأمراض "غير القابلة للشفاء"؟ * تحديث بشأن قرار المحكمة الأمريكية بإلغاء أمر أوباما الذي سمح بالتمويل العام لأبحاث الخلايا الجذعية الجنينية
تحديث بواسطة آفي بيليزوفسكي
تراجع في الموقف الأمريكي تجاه الخلايا الجذعية. ومما أثار استياء الرئيس أوباما أن أول ما فعله عندما تولى منصبه كان إلغاء الحظر الذي فرضه سلفه جورج بوش الابن على التمويل العام للأبحاث في مجال الخلايا الجذعية. حكم قاض اتحادي في واشنطن بأن التمويل الفيدرالي لأبحاث الخلايا الجذعية البشرية غير قانوني.
صدر حكم قاضي المقاطعة رويس لامبرت بناءً على طلب طبيبين مسيحيين يقومان بالبحث في الخلايا الجذعية البالغة، وطلبا من المحكمة أن تأمر الحكومة بحظر أبحاث الخلايا الجذعية الجنينية.
ووفقا للقاضي، في قرار مؤلف من 15 صفحة، فإن القانون الذي يسمح بالتمويل الحكومي لأبحاث الخلايا الجذعية يخالف قانون ديجلي-فيكر لأنه يتسبب في تدمير وتدمير الأجنة البشرية وبالتالي يسبب خطر الإصابة أو الوفاة أكبر من تلك التي تسببها تلك الأبحاث. يفرضها القانون بموجب القواعد المعمول بها فيه."
كتب القاضي لامبرت: "إذا أدت إحدى مراحل البحث إلى تدمير الجنين، فسيتم منع المشروع بأكمله من تلقي التمويل الفيدرالي وفقًا لقانون ديجلي فيكر".
"بما أن الأبحاث على الخلايا الجذعية الجنينية تتطلب فصل هذه الخلايا الجذعية، فإن الباحثين يضطرون إلى تدمير الجنين"، يكتب القاضي. "لذلك، خلصت المحكمة إلى أنه من خلال التمويل الفيدرالي لأبحاث الخلايا الجذعية الجنينية، حدث انتهاك لقانون ديجلي-فيكر."
وأعلنت وزارة العدل الأمريكية أنها ستستأنف الحكم.
أجرت مجلة Bio Inform مؤخرًا مراجعة لمجال الخلايا الجذعية. منذ حوالي أسبوعين أحضرنا أول مقال في سلسلة "الخلايا ذات الإمكانات". وهذا هو المقال الثاني: "الخلايا الجذعية في خدمة الطب"
بواسطة: جودي وأرييه ميلاميد كاتز
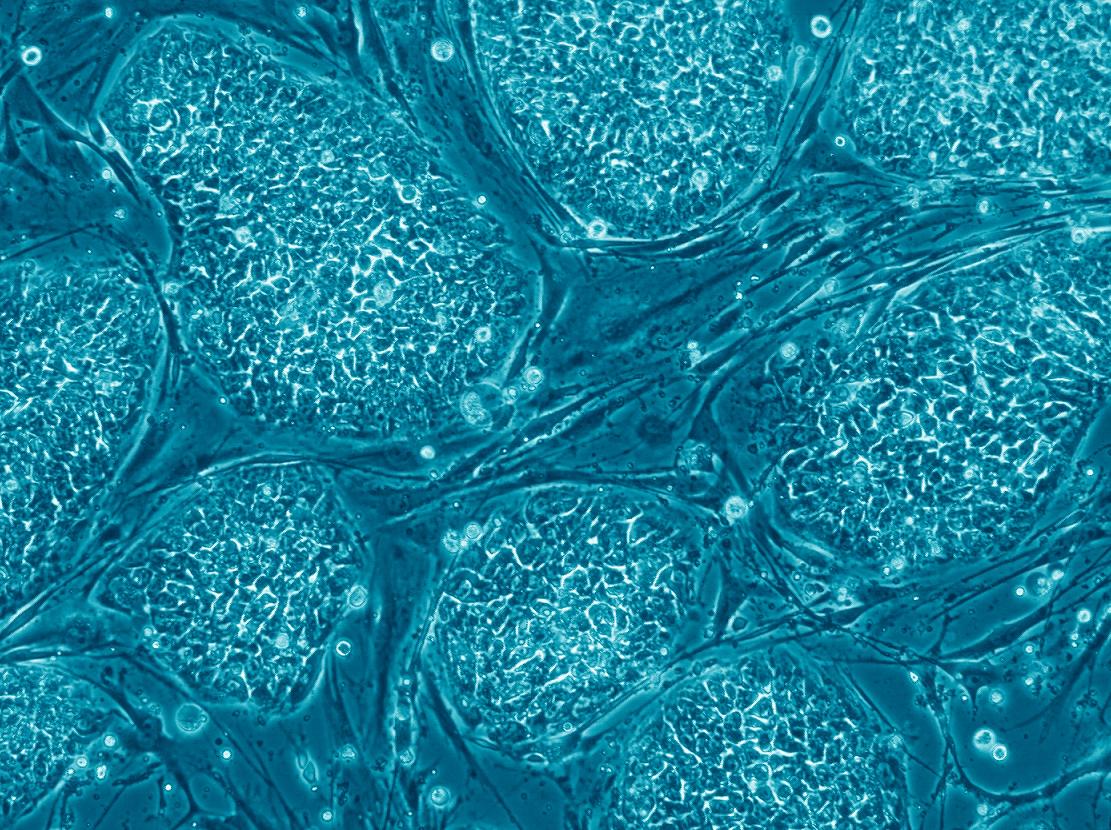
إن الوعد الكبير للخلايا الجذعية في الشمال هو قدرتها على الاندماج في مجموعة متنوعة من العلاجات الطبية المبتكرة، والتي ستسمح بالتعامل مع الأمراض التي لم يتم العثور على علاج لها حتى الآن - مثل أمراض الجهاز العصبي وأمراض القلب. ويمكن استخدام خطوط الخلايا الجذعية الجنينية البشرية والخلايا الجذعية المحفزة متعددة القدرات (خلايا iPS) كمصدر لإنتاج خلايا جذعية متعددة القدرات، وخلايا سلفية، وخلايا مصنفة، وسيتم زرعها في أجسام المرضى. حتى الآن، تم استخدام الخلايا الجذعية لجهاز الدم بشكل أساسي، المستمدة من التبرع بنخاع العظم، أو التبرع بالدم المحيطي أو دم الحبل السري الذي يتم جمعه عند الولادة، ويمكن استخدام الخبرة الواسعة المكتسبة في عمليات الزرع هذه في تطوير عمليات زرع الخلايا المستمدة من الخلايا الجذعية متعددة القدرات. في هذه المقالة المخصصة للتطبيقات الطبية للخلايا الجذعية، سنستعرض أولاً طرق العلاج الحالية ثم سنتناول لاحقًا بعض التطبيقات الطبية المستقبلية المعتمدة على الخلايا الجذعية، والتي هي في مراحل مختلفة من التطور.
نظام الدم
أصل خلايا الدم المختلفة في جسم الإنسان هو الخلايا الجذعية المكونة للدم، والتي توجد بشكل رئيسي في نخاع العظام. نظرًا لقصر عمر بعض خلايا الدم، يحتاج نظام الدم إلى التجديد المستمر: ينتج الجسم في المتوسط حوالي مائة مليار خلية دم جديدة يوميًا. ولذلك تلعب الخلايا الجذعية المكونة للدم دورًا مهمًا للغاية.
تم استخدام إجراء زرع الخلايا الجذعية المكونة للدم المشتقة من نخاع العظم لمدة 50 عامًا لاستعادة الدورة الدموية لمرضى سرطان الدم وأنواع السرطان الأخرى، الذين عولجوا لأول مرة بالإشعاع أو العلاج الكيميائي من أجل تدمير الخلايا السرطانية. بالإضافة إلى ذلك، يتم أيضًا استخدام زرع الخلايا الجذعية المكونة للدم لعلاج الأمراض التي تضررت فيها أجهزة الدم، مثل الثلاسيميا (مرض وراثي يتميز بخلل في الهيموجلوبين)، وفقر الدم اللاتنسجي (الذي يتميز بنقص خلايا الدم المختلفة بسبب نقص خلايا الدم المختلفة) إلى نخاع العظم التالف) وأمراض المناعة الذاتية المختلفة. اليوم، يتم إجراء عشرات الآلاف من عمليات زرع الخلايا الجذعية المكونة للدم في جميع أنحاء العالم كل عام.
توجد الخلايا الجذعية المكونة للدم بكميات كبيرة في نخاع العظم، ولذلك كان زرع نخاع العظم لسنوات هو الوسيلة الرئيسية لنقل هذه الخلايا الجذعية من شخص سليم إلى شخص مريض. ومع ذلك، فإن زرع نخاع العظم هو إجراء معقد نسبيًا يتطلب تخديرًا كاملاً أو موضعيًا للمتبرع، وبالتالي يوجد حاليًا تفضيل واضح لجمع الخلايا الجذعية المكونة للدم من نظام الدم المحيطي. عند الشخص البالغ، تترك الخلايا الجذعية النخاع العظمي استجابة لإشارة تأتي عبر السيتوكينات، وهي بروتينات صغيرة تستخدم للتواصل بين خلايا الجسم. من أجل تشجيع نقل الخلايا الجذعية من نخاع العظم إلى الدم في جسم المتبرع، جرت العادة على حقنه بمادة تؤدي إلى إتلاف الخلايا الأم لخلايا الدم الموجودة في الدورة الدموية وتخلق الحاجة لإنتاجها. خلايا دم جديدة (على سبيل المثال، السيتوكسان). في الخطوة التالية، يتم حقن عوامل النمو، مثل G-CSF وKitL، في جسم المتبرع، مما يشجع إطلاق الخلايا الجذعية في الدم. يمكن استخدام علامات مثل CD34، الموجودة على سطح الخلايا الجذعية المكونة للدم والخلايا السلفية التي تميزت عنها، في هذه المرحلة لتحديد الوقت الذي سيتم فيه جمع الدم من جسم المتبرع. من المعتاد إجراء عملية الجمع عندما يتم حساب 50-20 خلية تحمل علامة CD34 لكل ميكروليتر من الدم. يتم جمع الدم نفسه بإجراء بسيط يشبه التبرع بالدم الطبيعي، وهذه هي الميزة الكبيرة لهذه الطريقة.
قبل نقل الدم إلى جسم المريض، يمكن إثراء الدم بالخلايا الجذعية المكونة للدم والخلايا السلفية من خلال فرز الخلايا الذي يتم إجراؤه عن طريق تحديد علامات فريدة مثل CD34. وهذا مهم بشكل خاص في التبرع بالدم الذاتي لمرضى السرطان، وقد يمنع عودة الخلايا السرطانية إلى جسم المريض. ويتم الفرز بإحدى طريقتين: الفرز المغناطيسي أو الفرز الفلوري (FACS). يعتمد الفرز المغناطيسي على ربط جسيم يحتوي على حديد بجسم مضاد يتوافق مع جزيء فريد موجود على سطح الخلايا التي ترغب في تركها في الزرعة. عندما يتم التبرع بالدم بالقرب من المغناطيس، تنجذب هذه الخلايا إلى المغناطيس ويمكن جمعها. هذه الطريقة مناسبة للفرز السريع لكميات كبيرة من الدم، لكن لها عيبًا كبيرًا: يمكن استخدامها لإثراء طعم الدم بخلايا تحتوي على علامة واحدة فقط، وبالتالي فإن مستوى النقاوة ليس مرتفعًا، أي أن النتيجة قد يحتوي الدم على خلايا غير مرغوب فيها. يعتمد الفرز الفلورسنتي على ربط علامات الفلورسنت بالأجسام المضادة، حيث يتوافق كل منها مع أحد الجزيئات الفريدة الموجودة على سطح الخلايا التي تخضع للفرز. يتم تمرير خلايا الدم، واحدة تلو الأخرى، من خلال مجموعة من أشعة الليزر، ويتم الكشف عن وجود العلامات باستخدام أجهزة الاستشعار. باستخدام هذه الطريقة، من الممكن تحديد موقع الخلايا التي تحتوي على مجموعة محددة من العلامات التي تميز الخلايا الجذعية المطلوبة. بهذه الطريقة، يتم الحصول على طعم خلية نقية، لكن الطريقة بطيئة ومكلفة: بمساعدة FACS، يمكن فرز ما يصل إلى 50 خلية في الثانية، مقارنة بحوالي 10 ملايين خلية في الثانية باستخدام الطريقة المغناطيسية.
نظرًا للتكلفة المرتفعة حاليًا، لا يتم عادةً فحص التبرعات بالخلايا الجذعية المكونة للدم على الإطلاق أو يتم فحصها فقط بحثًا عن علامات CD34. وهذا يحد من فعالية العلاج، وخاصة في التبرع الذاتي. حتى في الطعم الخيفي، هناك ميزة كبيرة للفرز بمساعدة FACS، الذي يقوم بتصفية الخلايا التائية التي قد تسبب مرض الكسب غير المشروع مقابل مرض المضيف، حيث يهاجم الكسب غير المشروع الجسم.
مصدر آخر للخلايا الجذعية المكونة للدم هو دم الحبل السري، والذي يمكن جمعه عند الولادة (انظر مقال كيرين سيروتا "دم الحبل السري: وعد عند الفجر" في هذا العدد). وفي المستقبل سيكون من الممكن أيضًا استخدام الخلايا الجذعية الجنينية أو الخلايا الجذعية المحفزة متعددة القدرات، والتي تخضع للتمايز المباشر إلى خلايا جذعية مكونة للدم أو خلايا سلفية لخلايا الدم المختلفة. ومع ذلك، يجب الافتراض أن هذه التجارب لن تتزامن مع التجارب السريرية الأولى التي سيتم إجراؤها على الخلايا المشتقة من الخلايا الجذعية الجنينية. ويرجع ذلك إلى التوفر الكبير للخلايا الجذعية المكونة للدم من مصادر أخرى، وبسبب صعوبة إنتاج طعم خالي من الخلايا الجذعية متعددة القدرات، مما قد يسبب ظهور الأورام.
ومن ناحية أخرى، فمن الممكن أن يتم استخدام الخلايا الجذعية المكونة للدم المشتقة من تبرع شخص بالغ في المستقبل لإنتاج خلايا الجسم الأخرى، غير خلايا الدم. في السنوات الأخيرة، أصبح من الواضح أن الخلايا الجذعية يمكن أن تمر بعملية تحويل تمايز في الجسم، أي التمايز إلى خلايا ليست في سلسلة تمايزها الطبيعية، إلا أن كمية الخلايا التي تمر بهذه العملية بشكل طبيعي هي قليل. اليوم، من المعروف أن المواد التي يمكن أن تسبب تمايزًا عابرًا في مزارع الخلايا الجذعية. إذا كان من الممكن استخدام مثل هذه المواد من أجل زيادة عدد الخلايا التي تخضع لعملية تحويل التمايز في الجسم بشكل كبير، فسيكون من الممكن استخدام زراعة الخلايا الجذعية المكونة للدم لترميم الأنسجة المختلفة في الجسم، وليس بالضرورة للعلاج من نظام الدم. بالإضافة إلى ذلك، يمكن استخدام تمايز مزارع الخلايا الجذعية المكونة للدم، والذي يمكن الحصول عليه من خلال التبرع بالدم، بسهولة نسبية وبدون مشاكل أخلاقية بيولوجية، لإنتاج كميات كبيرة من الخلايا التي بالكاد ينتجها الجسم البالغ من تلقاء نفسه. ومع ذلك، فإن نمو ثقافة الخلايا الجذعية المكونة للدم في المختبر أكثر تعقيدًا من نمو الخلايا الجذعية الجنينية، وعلى الأقل في هذه المرحلة يواجه الباحثون صعوبة في محاكاة الظروف في نخاع العظم التي تسمح بتجديد الخلايا الجذعية المكونة للدم دون تخضع للتمايز.
وبالتالي فإن استعادة نظام الدم من خلال العلاج المعتمد على الخلايا الجذعية هو إجراء طبي قديم ومقبول، ومن المتوقع أن يستمر في التطور بفضل الخبرة الواسعة المكتسبة حتى الآن، وذلك بفضل التوافر الوفيرة للخلايا الجذعية المكونة للدم والخلايا الجذعية الجنينية. والتي يمكن استخدامها أيضًا كمصدر لخلايا جهاز الدم، وذلك بفضل الفهم الجيد لعملية الشفاء بهذه الطريقة. ومن المتوقع أن تؤدي زيادة كفاءة فرز الخلايا المزروعة وتطوير أساليب الطب الشخصي إلى تحسين كفاءة العلاج وتقليل خطر الرفض.
الجهاز العصبي
إن عدم وجود إمكانية عملية لتلقي متبرع بالخلايا العصبية أو الخلايا الدبقية من جسم المتبرع، ومحدودية قدرة الجسم على تجديد هذه الخلايا، يحد من قدرة الطب الحديث على علاج المرضى الذين يعانون من أمراض الجهاز العصبي. يهدف العلاج المقدم حاليًا لهؤلاء المرضى في الغالب إلى تقليل الضرر، وهو غير قادر على تحقيق الشفاء التام. ومع ذلك، فإن العلاجات المعتمدة على الخلايا الجذعية، والتي من المتوقع أن يدخل بعضها قريبًا مرحلة التجارب السريرية، قد تدفع هذا المجال عدة خطوات إلى الأمام. والأمل هو أن تسمح هذه العلاجات، التي تعتمد على زرع الخلايا التي وظيفتها استبدال الخلايا التالفة، باستعادة الجهاز العصبي جزئيًا أو كليًا في الأمراض التي تعتبر غير قابلة للشفاء حاليًا.
من المحتمل أن تشمل التجارب السريرية الأولى في هذا المجال زرع الخلايا الجذعية الجنينية التي خضعت للتمايز الجزئي إلى خلايا سلفية للخلايا الدبقية قليلة التغصن في أجسام المرضى الذين يعانون من إصابة شديدة في النخاع الشوكي. قد تؤدي عملية الزرع هذه إلى تحسين حركة هؤلاء المرضى بشكل كبير، خاصة إذا كان هناك تلف مزمن في طبقة المايلين (إزالة الميالين) من المحاور، وضعف وظيفتها نتيجة لذلك. نظرًا لخطر الإصابة بالأورام بعد زرع الخلايا المشتقة من الخلايا الجذعية الجنينية، تُبذل حاليًا جهود لفحص زرع خلايا جذعية أخرى، مثل الخلايا الجذعية اللحمية لنخاع العظم (وتسمى أيضًا الخلايا الجذعية الوسيطة)، في الجسم من الحبل الشوكي المصاب، على أمل أن تخضع هذه الخلايا الجذعية لعملية تحويل التمايز في الجسم. حتى الآن، لم يتم الحصول على نتائج مرضية في التجارب التي أجريت على حيوانات المختبر: كانت كمية خلايا الجهاز العصبي التي تم الحصول عليها بعد عمليات الزرع هذه منخفضة نسبيًا، وكان معدل موت الخلايا المبرمج (موت الخلايا المبرمج) في الحبل الشوكي مرتفعًا. قد يؤدي التلاعب الجيني بالجينات المرتبطة بالتمايز وموت الخلايا المبرمج إلى تحسين كفاءة الإجراء وزيادة نجاح العلاج. إذا نجحت التجارب السريرية على ضحايا النخاع الشوكي، فسيكون هذا أيضًا خبرًا جيدًا لمرضى التصلب المتعدد، وهو مرض التهابي يتميز بإزالة الميالين من المحاور في الجهاز العصبي. قد يؤدي زرع الخلايا الدبقية قليلة التغصن أو الخلايا السلفية إلى تحسن كبير في حالة المرضى الذين يعانون من هذا المرض الخطير.
من المحتمل أن يمر المزيد من الوقت قبل أن يتم إنشاء الطرق الطبية المعتمدة على الخلايا الجذعية كعلاج للأمراض التي تتميز بتلف الخلايا العصبية (الخلايا العصبية). وفي هذا السياق، فإن الهدف الرئيسي هو إيجاد علاج لمرض باركنسون. يحدث مرض باركنسون بسبب فقدان الخلايا العصبية المنتجة للدوبامين في الدماغ، والتي تربط المادة السوداء (المادة السوداء) بالجسم المخطط. حققت محاولات زرع أنسجة من الدماغ المتوسط البطني للأجنة المجهضة في الجسم المخطط بعض النجاح، وقد تم اكتشاف تحسن في الوظيفة لدى بعض المرضى. تتجلى العلاقة بين التحسن في الوظيفة وزرع الأعضاء في حقيقة أنه في أدمغة ثلاثة من المرضى الذين خضعوا لعملية زرع كهذه، والذين ماتوا لسبب آخر، تم العثور على خلايا عصبية منتجة للدوبامين في عملية الزرع. ومن ناحية أخرى، ساءت حالة بعض المرضى، وعانوا من أعراض مشابهة للأعراض الجانبية الناجمة عن الاستخدام المطول لعقار L-DOPA. وغني عن القول أن هناك صعوبة عملية في الحصول على كمية كبيرة من هذا النوع من الأنسجة للزراعة، وأن العلاج ينطوي على مشاكل أخلاقية بيولوجية خطيرة.
ويمكن استخدام الخلايا الجذعية الجنينية والخلايا الجذعية المحفزة متعددة القدرات في المستقبل كمصدر لكميات كبيرة من الخلايا العصبية المنتجة للدوبامين، لكن مرحلة التجارب السريرية على البشر لا تزال بعيدة نسبيا. تنبع صعوبة تطبيق هذه الطريقة من الحاجة إلى تقليل مخاطر تطور الورم، ومن الحاجة إلى إنتاج طعم خلوي يندمج بنجاح في الجهاز العصبي المعقد للدماغ. وفي الوقت نفسه، تُبذل الجهود لتطوير علاجات تشجع الخلايا الجذعية في الجسم على تمايز نفسها إلى خلايا عصبية منتجة للدوبامين، والتي ستحل محل الخلايا التالفة. ويتم ذلك عن طريق حقن عوامل النمو مثل TGF، والذي يعرف بأنه العامل الذي يؤثر على التطور المبكر للدماغ ويتم التعبير عنه بكمية محدودة في جسم الشخص البالغ. ولم تكن نتائج التجارب على حيوانات المختبر حاسمة، كما أن هذا النوع من العلاج لا يزال بعيدًا عن مرحلة التجارب السريرية.
يتميز مرض لو جيريج (ALS) بتدمير الخلايا العصبية الحركية في النخاع الشوكي، ويعتبر مرضًا غير قابل للشفاء، وعادةً ما يؤدي إلى تقصير عمر المرضى بشكل كبير. على الرغم من النجاح في إنتاج العصبونات الحركية من الخلايا الجذعية الجنينية والخلايا الجذعية العصبية متعددة القدرات (NSC)، إلا أنه لا يزال هناك طريق طويل لزراعة هذه الخلايا أو الخلايا السلفية لها بحيث يتم دمجها بنجاح في الجهاز العصبي المعقد لجسم الإنسان و استبدال الخلايا العصبية الميتة. من ناحية أخرى، أظهرت التجارب على حيوانات المختبر أن مثل هذا الزرع قادر على منع أو تقليل التدمير الإضافي للخلايا العصبية في النخاع الشوكي من خلال إفراز التغذية العصبية (التغذية العصبية) من الخلايا المزروعة. قوة عوامل النمو هذه تمنع موت الخلايا العصبية، ومن هنا أهميتها.
وقد تلعب الخلايا الجذعية أيضًا دورًا غير مباشر في العلاج المستقبلي لمرضى الزهايمر. زرع الخلايا التي تم تعديلها وراثيا للتعبير عن عامل نمو الأعصاب (NGF) قد يحسن حالة مرضى الزهايمر، حيث أن NGF معروف بقدرته على منع موت الخلايا العصبية. كانت التجارب السريرية الأولى، التي أجريت بمساعدة الخلايا الليفية المأخوذة من أجسام المرضى، ناجحة. وقد تكون الخلايا الجذعية أكثر فعالية في مثل هذا العلاج الجيني، وذلك بفضل خاصيتين تميزها: فهي سهلة إجراء التلاعب الجيني، وتتمتع بقدرة ممتازة على الهجرة، مما يسمح لها بالوصول إلى المكان الصحيح في الدماغ. ويعتبر زرع الخلايا العصبية المشتقة من الخلايا الجذعية، بهدف استبدال الخلايا التالفة في أدمغة مرضى الزهايمر، هدفا أبعد.
وفي العقد المقبل، من المتوقع حدوث تطورات مهمة في إدخال طرق تعتمد على الخلايا الجذعية لعلاج أمراض وإصابات الجهاز العصبي. إلى جانب العلاجات المستقبلية التي وصفناها، من الممكن أيضًا تحقيق تقدم في علاج السكتة الدماغية وسرطان الدماغ ومرض هنتنغتون والحالات الطبية الأخرى. إلا أن معرفتنا المحدودة بالجهاز العصبي وآليات الأمراض التي تصيبه لا تسمح بالتقدم السريع في هذا المجال الطبي المهم.
عضلة القلب
تعد أمراض القلب من الأسباب الرئيسية للوفاة في العالم. ويتميز الكثير منهم بنقص التروية، وهو نقص إمدادات الدم الذي يسبب نقص الأكسجين في أنسجة عضلة القلب. يؤدي نقص الأكسجين إلى موت خلايا عضلة القلب (الخلايا العضلية القلبية)، وقد يؤدي إلى أضرار تهدد الحياة. إن قدرة الجسم على إصلاح الضرر بمساعدة الخلايا الجذعية الجسدية محدودة، كما أن العلاجات الدوائية ومعظم العلاجات الجراحية غير قادرة أيضًا على إصلاح الأنسجة التالفة. تعتبر زراعة القلب حلاً جيدًا للعديد من المرضى الذين يعانون من قصور القلب الحاد، ولكن هذا الحل محدود بسبب قلة توفر الأعضاء للزراعة وخطر الرفض. إن تطوير إجراء طبي لزراعة خلايا عضلة القلب، يعتمد على الخلايا الجذعية، قد ينقذ حياة ملايين المرضى كل عام. في السنوات الأخيرة، أجريت التجارب السريرية الأولى في زراعة أنواع مختلفة من الخلايا الجذعية الجسدية، ويمكن استخدام المعلومات المجمعة في تطوير طرق زرع الخلايا المشتقة من الخلايا الجذعية الجنينية أو الخلايا الجذعية الجذعية.
إذا كان هناك تدفق دم معقول في جسم المريض، فيمكن زرع الخلايا في الأوردة، أي من خلال إجراء بسيط نسبيًا. ومع ذلك، هناك أفضلية للزراعة في الشرايين التاجية، التي تزود القلب نفسه بالدم، وذلك بسبب قرب موقع الزراعة من نقطة وصول الخلايا. في المرضى الذين يعانون من ضعف تدفق الدم، يجب إجراء عملية الزراعة في جدار حجرات القلب، عن طريق قسطرة القلب أو جراحة القلب المفتوح. لم يتم بعد توضيح طريقة عمل الخلايا المزروعة بشكل كامل. اليوم، من المقبول عمومًا أن قدرة هذه الخلايا على التمايز والاندماج في عضلة القلب محدودة، ويأتي تأثيرها الرئيسي من قدرتها على إطلاق عوامل النمو التي تؤدي إلى تكوين أوعية دموية جديدة (تكوين الأوعية الدموية) أو قدرتها لتشجيع الخلايا الجذعية للقلب (الخلايا الجذعية القلبية) على إصلاح الضرر.
على مدى السنوات العشر الماضية، تم زرع الخلايا العضلية الهيكلية، وهي خلايا سلفية ملتزمة للعضلات الهيكلية، في أجسام حوالي 10 مريض بالقلب. تم أخذ هذه الخلايا من أجسام المرضى، لذا فإن عملية الزرع لم تنطوي على خطر الرفض، لكن الخلايا الأرومة العضلية لم تندمج بشكل جيد مع خلايا عضلة القلب، وبلغ معدل بقائها على قيد الحياة بعد 100 أيام في المتوسط 3%. وفي الوقت نفسه، وبطريقة لم يتم شرحها بعد، كان لها تأثير إيجابي معين على حالة المرضى. يمكن أيضًا استخدام الخلايا الجذعية للقلب في عمليات الزرع الذاتي. تتمتع هذه الخلايا، التي تم تحديدها من خلال علامات فريدة، بقدرة شفاء عالية، وقد أظهرت التجارب على النموذج الحيواني بالفعل بعض النجاح. وتنبع الصعوبة الرئيسية من قلة كميتها في الجسم والحاجة إلى إيجاد طريقة لزيادة كميتها بشكل كبير في المختبر قبل الزرع.
أظهرت التجارب السريرية التي تم فيها زرع الخلايا الجذعية المكونة للدم في مرضى القلب أنه في بعضهم كان هناك تحسن معين في قدرة تدفق الدم في البطين الأيسر. ومع ذلك، تبين أن الفرضية الأولية المتعلقة بدرجة عالية من التمايز في الخلايا الجذعية المزروعة خاطئة. وأظهرت تجارب إضافية أن الخلايا الجذعية المكونة للدم المزروعة تمايزت إلى خلايا دم أو اندمجت (اندماج الخلايا) مع خلايا عضلة القلب، ولم تتمايز إلى خلايا عضلة قلب جديدة. يوجد اهتمام خاص بزراعة الخلايا الجذعية اللحمية. أظهرت هذه الخلايا الجذعية متعددة القدرات، والتي تتمايز في الجسم إلى خلايا عظمية وخلايا غضروفية وأنواع أخرى من الخلايا، في المختبر القدرة على التمايز إلى خلايا مشابهة لخلايا عضلة القلب الجنينية عند معالجتها بعامل إزالة ميثيل الحمض النووي يسمى 5-آزاسيتيدين. في ظل ظروف أخرى، وفي ظل وجود عوامل النمو البطانية، تمايزت الخلايا الجذعية اللحمية إلى خلايا بطانية (خلايا موجودة في الجدران الداخلية للأماكن المغلقة في الجسم، مثل القلب والأوعية الدموية). بدأت مؤخرًا التجارب السريرية الأولى، التي تتضمن زرع الخلايا الجذعية اللحمية والخلايا السلفية في الخلايا البطانية.
ولذلك فإن مجال زراعة الخلايا الجذعية كعلاج لأمراض القلب هو في مرحلة التجارب السريرية، وربما يرجع النجاح المحدود إلى حقيقة أنه لم يتم بعد العثور على الصيغة المثالية لزراعة الخلايا التي ستندمج بشكل كامل في عضلة القلب. . يركز اتجاه بحثي مختلف على تطوير القلب الاصطناعي الحيوي. في عام 2008، نجحت مجموعة بقيادة دوريس تايلور (تايلور) من جامعة مينيسوتا في إزالة الخلايا (إزالة الخلايا) من قلب فأر وإدخال خلايا من فئران أخرى في المصفوفة المتبقية خارج الخلية. وبهذه الطريقة تم الحصول على قلب نابض وفعال. من الممكن أنه على أساس طريقة إزالة الخلايا هذه، أو على أساس مصفوفة اصطناعية، سيكون من الممكن في المستقبل إنشاء قلوب شخصية، والتي ستحتوي على خلايا جذعية تحمل المعلومات الوراثية للمريض.
طب المستقبل
نظرة شاملة على مجال الاستخدامات الطبية للخلايا الجذعية تكشف أنها تنقسم إلى "قائمة" و"مستقبلية" - عندما تكون موجودة هي زراعة الخلايا الجذعية المكونة للدم، والتي استخدمت منذ سنوات بنجاح كبير لعلاج أمراض الدم و أنواع مختلفة من السرطان. من المحتمل أن يكون للخلايا الجذعية المأخوذة من جسم شخص بالغ القدرة على علاج أمراض إضافية، وفي العقد القادم، من المتوقع أن تستمر التجارب السريرية في زراعة الخلايا الجذعية الجسدية، مثل الخلايا الجذعية المكونة للدم والخلايا الجذعية اللحمية، لعلاج مرض ما. مجموعة متنوعة من الأمراض. عند الانتهاء منها، سيكون لدينا صورة أكثر اكتمالًا لخيارات العلاج بمساعدة هذه الخلايا. وتظهر الصورة التي تم رسمها بالفعل أنه حتى عندما فشلت الخلايا المزروعة في استبدال خلايا الجسم التالفة، فإنها منعت موت خلايا إضافية عن طريق إفراز عوامل النمو.
وفي الوقت نفسه، من المتوقع أن تبدأ التجارب السريرية الأولى في السنوات المقبلة، استنادًا إلى خطوط الخلايا الجذعية الجنينية، وربما لاحقًا أيضًا الخلايا الجذعية المحفزة متعددة القدرات. الهدف الرئيسي لهذه التجارب هو أمراض الجهاز العصبي، وخاصة الأمراض التنكسية التي لا يزال الطب يواجه صعوبة في التعامل معها. تعد هندسة الأنسجة هدفًا أبعد، لكن النجاحات المتعددة في مجال التمايز الموجه للخلايا الجذعية المختلفة قد تؤدي في النهاية إلى أن يصبح هذا الحلم أيضًا حقيقة.
بوكسا: الطب الشخصي والخلايا الجذعية
الطب الشخصي هو منهج طبي يجب من خلاله مراعاة المعلومات الجينية والبيوكيميائية للمريض، من أجل ضبط العلاج اللازم له. ومن المتوقع بالفعل أن نرى في المستقبل القريب المزيد والمزيد من الأدوية التي سيتم إعطاؤها لمجموعات من المرضى وفقًا لنتائج اختباراتهم الجينية والكيميائية الحيوية. في مجال زراعة الأعضاء، هناك حاجة خاصة لتكييف العلاج مع المريض، وذلك بسبب خطر الرفض بسبب عدم التوافق الجيني بين الخلايا المزروعة وخلايا المريض. إن استخدام الخلايا المستخرجة من جسم المريض بغرض إنشاء خط شخصي من الخلايا الجذعية المحفزة متعددة القدرات، أو خط من الخلايا الجذعية الجنينية المشتقة من الاستنساخ الطبي (انظر مقالنا "الخلايا ذات الإمكانات" في هذا العدد)، سيوفر حلاً كاملاً لمشكلة مشكلة الرفض، لأن المعلومات الوراثية الموجودة في الخلايا المزروعة ستكون مطابقة للمعلومات الوراثية الموجودة في خلايا جسم المريض. قد تلغي هذه الأساليب الحاجة إلى بنوك الخلايا الجذعية، لأنه من المتوقع أن تكون عملية إنشاء خط خلايا شخصي في حالة الحاجة إليها بسيطة وسريعة وربما رخيصة أيضًا.
تنسب إليه
جودي ميلاميد كاتس هي كيميائية تكمل دراسات الدكتوراه في علم الأحياء الدقيقة في الجامعة العبرية؛ عملت في Teva وMZP، وتعمل حالياً في مجال الكتابة والتعليم العلمي.
أرييه ميلاميد كاتس هو مهندس إلكترونيات ودكتوراه في الفيزياء، خريج معهد وايزمان للعلوم؛ تعمل حاليًا في كتابة وتطوير برامج تعليم العلوم وإلقاء المحاضرات في الموضوعات العلمية وتقديم خدمات الاستشارات العلمية.
www.arie-science.blogspot.com
ariejudy@gmail.com
لمزيد من القراءة
وزارة الصحة والخدمات الإنسانية، "الطب التجديدي"، أغسطس 2006.
http://stemcells.nih.gov/info/2006report/
Powell, JL, Hingorani, P., Grupp, SA and Kolb, EA، "زرع الخلايا الجذعية المكونة للدم"، eMedicine.
http://emedicine.medscape.com/article/991032-overview
كيم، سو ودي فيليس، جيه، "العلاج بالخلايا الجذعية في الأمراض العصبية: مراجعة"، مجلة أبحاث علم الأعصاب 87(10):2183-2200 (2009).
http://www.ncbi.nlm.nih.gov/pubmed/19301431
الخلايا قليلة التغصن المشتقة من hESC بواسطة جيرون:
http://www.geron.com/products/productinformation/spinalcordinjury.aspx
Lindvall، O. and Kokaia، Z.، "آفاق العلاج بالخلايا الجذعية لاستبدال خلايا الدوبامين العصبية في مرض باركنسون"، اتجاهات العلوم الدوائية 30(5):260-267 (2009).
http://www.ncbi.nlm.nih.gov/pubmed/19362379
Lee, J. and Terracciano, CM، "العلاج بالخلايا لإصلاح القلب"، النشرة الطبية البريطانية 94(1):65-80 (2010).
http://www.ncbi.nlm.nih.gov/pubmed/20200014
تايلور، دا، "من الخلايا الجذعية ومصفوفة الجثة إلى الأعضاء المهندسة"، الرأي الحالي في التكنولوجيا الحيوية 20(5):598-605 (2009).
http://www.ncbi.nlm.nih.gov/pubmed/19914057

تعليقات 3
ل 2:
هناك أيضًا خيار أبسط بكثير لزراعة الخلايا الجذعية، وهو يتضمن في الواقع تدمير جنين واحد فقط:
الخلايا الجذعية في الأيام الأولى للجنين (يتم الحصاد في الوقت المثالي بعد حوالي 5 إلى 7 أيام من الإخصاب، والذي يتم في المختبر، أو في الإخصاب في المختبر)، تتضاعف وتتقلص طوال الوقت، لأنه لا يوجد مكان بالداخل البيضة، وهي القشرة اللازمة للتكاثر.
أخرج الخلايا الجذعية من القشرة الواقية للبيضة (للمشيمة المستقبلية)، وسوف تستمر في التكاثر إلى ما لا نهاية، في محاولة لملء الفراغ.
لا أعلم، ربما يكون ورمًا في وسط سائل كما قلت. رأيته في أحد البرامج قبل سنوات قليلة والذي تناول فائدة الشيء.
وبالإضافة إلى ذلك فإن الولايات المتحدة الأمريكية من أغبى الدول من حيث التشريع.
لاحظ ما ينقص "الجنين" في الأسبوع الأول من "حياته" (الفترة المثالية لحصد الخلايا)
قلب
مخ
الجهاز التنفسي
الجهاز الهضمي
الجهاز التناسلي
وفي الحقيقة، أعتقد أن هذه الخصائص الخمس تمثل جميع المعايير التي حددها علماء الأحياء للإنتاج الحي.
بمعنى أن "الجنين" في الأسبوع الأول، رغم قدرته على التحول إلى إنسان، إلا أنه أقل من بكتيريا بمعنى:
فهو كائن غير حي.
وعلى الرغم من أنني أكره إشراك الدين في أي قضية تتعلق بالتطور الطبي أو التكنولوجي (أنا ملحد)، إلا أن اليهود على الأقل لديهم بعض العقل (ليس الأمر فقط أنهم من بين الدول الأكثر نجاحًا. ومن العار أن وهذا لا يعبر عنه إلا في الشتات =/)، ولا يحددون معيارهم للحياة إلا عندما يبدأ دماغ الجنين في النمو.
أود أن أبدي تعليقين:
اولا:
القانون المعني (ديكي ويكر) هو مثال للتشريعات غير المدروسة والضارة وغير الأخلاقية في نهاية المطاف - والمبنية على عقائد "أخلاقية" غير عقلانية.
المشكلة الأساسية في مسألة الأجنة هي السؤال ما هو ذلك المخلوق الذي هو كائن يحمل الحق في الحياة.
أما النظرة المسيحية، وهي في غاية التبسيط، فترى أن كل جنين هو كذلك، دون الالتفات إلى درجة نموه.
ويرى النهج الليبرالي، الذي يتسم بالتبسيط أيضا، أن الجنين لا يتمتع بأي حقوق، بما في ذلك الحق في الحياة، ما دام لم يولد بالفعل.
يعتمد كلا النهجين على فروق فنية بحتة: النهج المسيحي - على وجود مجموعة من الخلايا ذات إمكانات النمو، تسمى الجنين، حتى لو كانت خالية من أي وعي وحتى لو كانت خالية من أي صفات وظيفية؛ والليبرالي: أن الجنين في كل مرحلة يكون "متصلاً" جسدياً بأمه، حتى لو كان لديه وعي، وإذا كان لديه قدرة وظيفية فعلية خارج رحم أمه.
كلا الاتجاهين يؤديان إلى تشريعات ضارة وغير أخلاقية: الاتجاه المسيحي - في شكل تشريع من نوع قانون ديكي ويكر - من حيث أنه يمنع التطور العلمي الحيوي ويضر بفرص البشرية في الشفاء من الأمراض وأضرار الحوادث التي لا يمكن علاجها. إلا بطرق تعتمد على أساليب وتقنيات الخلايا الجذعية. الليبرالية - من حيث أنها تؤدي إلى القتل الجماعي للأجنة التي لديها وعي وحتى مهارات وظيفية فعلية.
في رأيي، هناك حاجة إلى وجهة نظر أساسية حول هذه القضية. منذ آلاف السنين، قدمت الشريعة اليهودية تمييزًا ذا معنى، يتعلق بنضج الجنين، حيث أنها تنكر وجود جنين حاملًا للحياة قبل أن يبلغ من العمر 41 يومًا، ولكنها تتخذ موقفًا مبدئيًا (الذي له مؤهلات معينة) بموجبها يصبح للجنين الحق في الحياة من هذا السن فصاعدا. اليوم نعلم بوضوح أن دماغ الجنين يعمل كهربائياً لأول مرة ابتداءً من اليوم الـ 41، لذلك يمكن اعتبار هذه المرحلة من التطور وفي هذا الوقت علامة أساسية فيما يتعلق بوجود جنين بوعي أولي.
ويبدو لي أنه إذا تم تجميد نمو الجنين بحيث لا يصل إلى هذه المرحلة من نشاط الدماغ، فلا داعي للخوف من أي خلل أخلاقي في استخدام خلاياه الجذعية أو تدمير الجنين. ، في أي وقت وفي أي عمر. على أية حال، حتى بدون تجميد نمو الجنين كما هو مذكور أعلاه، سيكون من الممكن استخدامه دون أي عائق أو تشابك أخلاقي، حتى اليوم الحادي والأربعين، لأنه في هذه المرحلة من "حياته" لا يمكن أن يتمتع الجنين بأي شخصية قانونية. لأنه يفتقر إلى الحد الأدنى من القدرة المعرفية.
ثانيًا:
ليس من الواضح بالنسبة لي على الإطلاق، فيما يتعلق برفض أمر المحكمة العليا، عدم التمييز بين البحوث التي تنطوي على تدمير الأجنة، وطرق البحث التي تتناول النمو "الصناعي" للخلايا الجذعية (ل مثال - في وسط سائل، كما ظهر مؤخرًا في إسرائيل). ويبدو قصر نظر المحكمة محيراً ومقلقاً، على خلفية منطق القانون، وهنا تضاف خطيئة الغباء إلى جريمة الفجور.
القانون المعني يسمى تعديل ديكي ويكر.
انظر هنا:
http://en.wikipedia.org/wiki/Dickey_Amendment