تعد أبحاث الخلايا الجذعية أحد المجالات "الساخنة" في الأبحاث البيولوجية والطبية اليوم. بعد عقد من الاكتشافات التي قادت الباحثين إلى فهم أفضل لنشاط الخلايا الجذعية في الجنين النامي وفي جسم الشخص البالغ، نحن الآن على عتبة عصر جديد في الطب، عصر يمكننا أن نحاول فيه لعلاج المرضى الذين يعانون من مجموعة واسعة من الأمراض التي لا يزال الطب الحديث لا يعرف كيفية التعامل معها
إمكانات غير محدودة
الخلايا الجذعية هي خلايا لم تخضع بعد لعمليات التمايز النهائية، أي الخلايا التي لا تزال لديها القدرة على أن تصبح نوعًا مختلفًا من الخلايا. يتكون الجنين الذي يبلغ من العمر بضعة أيام فقط من الخلايا الجذعية، وفي وقت لاحق من الحمل، عندما تبدأ أعضاء الجسم في البناء، تصبح نسبتها النسبية أصغر فأصغر. ومع ذلك، يمكن العثور على الخلايا الجذعية في مراحل مختلفة من التمايز في كل من الطفل الخارج من رحم أمه وفي الشخص البالغ.
من الخصائص المهمة الأخرى للخلايا الجذعية قدرتها غير المحدودة على الانقسام، والتي تنتج أيضًا عن التعبير العالي عن التيلوميراز. وفي ظل الظروف المناسبة، تستمر هذه الخلايا في الانقسام إلى الأبد وتنتج جيلًا بعد جيل من الخلايا الجذعية؛ وفي ظل ظروف أخرى، توجد على سبيل المثال في الجنين النامي، فإن معظم الخلايا الجذعية تتمايز وتنتج خلايا محددة تقوم ببناء الأنسجة المختلفة. بعد الولادة، تستمر الخلايا الجذعية في العمل كمستودع لإنشاء خلايا جديدة، وتتمايز حسب الحاجة وتحل محل الخلايا التالفة أو الميتة. تتمتع الخلايا الجذعية المختلفة بإمكانات تمايز مختلفة: يمكن للخلايا الجذعية الأولية في الجنين أن تصبح في النهاية، بعد سلسلة من عمليات التمايز، أيًا من أكثر من مائتي نوع من الخلايا الموجودة في جسم الإنسان البالغ بالإضافة إلى خلايا الأنسجة خارج الجنين. مثل المشيمة. أما الخلايا الجذعية الأخرى فهي محدودة في قدرتها على التمايز، وهي قادرة على أن تصبح أنواعًا قليلة فقط من الخلايا أو نوعًا واحدًا فقط.
إن عملية زرع نخاع العظم هي في الواقع عملية زرع خلايا جذعية مكونة للدم، أي الخلايا الجذعية التي خضعت للتمايز الجزئي وأصبحت الآن قادرة على التطور إلى خلايا دم من جميع الأنواع. وقد تم قبول مثل هذه الزراعة منذ سنوات كعلاج للعديد من أمراض الدم، ولأمراض أخرى يكون من الضروري فيها استعادة نظام الدم وجهاز المناعة بعد العلاج الطبي (انظر مقالنا "الخلايا الجذعية في خدمة الطب" القادم قريباً).
ويهدف الباحثون اليوم إلى تنمية الخلايا الجذعية في المختبر بكمية كافية، والتي يمكن استخدامها كمصدر لأنواع مختلفة من الخلايا التي سيتم زرعها في جسم المرضى وتوفير علاج للعديد من الأمراض الأخرى. إن إيجاد طرق لإنشاء خلايا مناسبة لعملية زرع ناجحة وآمنة هو الهدف الأساسي لأبحاث الخلايا الجذعية هذه الأيام. بالإضافة إلى عمليات زرع نخاع العظم، تُستخدم الخلايا الجذعية أيضًا لمجموعة متنوعة من الأغراض: زراعتها كمزرعة خلوية لاختبار عمل الأدوية؛ دراسة الأمراض الوراثية باستخدام الخلايا الجذعية ذات العيوب الوراثية؛ البحث عن السرطانات الناجمة عن الخلايا الجذعية المعيبة؛ دراسة عمليات الشفاء الطبيعية في الجسم؛ ودراسة أساسية لآليات تمايز الخلايا الجذعية وتطور الجنين من بويضة واحدة إلى كائن حي كامل.
سنتناول في هذه المقالة دور الخلايا الجذعية في الجسم، وتاريخ أبحاث الخلايا الجذعية، وطرق البحث المستخدمة في هذا المجال الرائع والقضايا الأخلاقية الحيوية التي يثيرها.
من البيضة إلى الإنسان
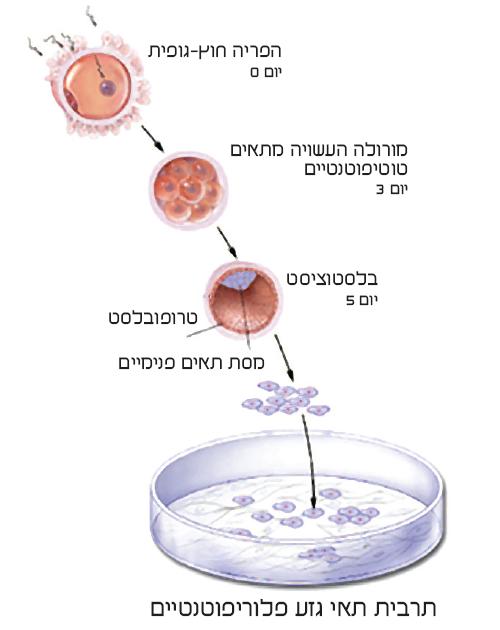
تنشأ خلايا الجسم في البويضة المخصبة، وهي البيضة الملقحة، وهي الخلية الجذعية الرئيسية التي سيتطور منها الجنين أثناء الحمل. بعد الإخصاب، تبدأ اللاقحة بالانقسام، وفي غضون أيام قليلة يتم تشكيل مجموعة من عشرات الخلايا التي لا تزال تشكل خلايا جذعية تتمتع بأعلى إمكانات التمايز.
هذه الخلايا، والتي تسمى الخلايا الجذعية الكاملة، يمكن أن تصبح أثناء تمايز أي خلية في الجسم، وكذلك خلايا خارج الجنين، مثل خلايا المشيمة. تأخذ مجموعة الخلايا، التي تسمى التوتية، شكل كرة مجوفة في اليوم الخامس من الحمل. وتتكون الكرة المجوفة، وهي الكيسة الأريمية، والتي تتكون في هذه المرحلة من حوالي 100 خلية، من قوقعة ومجموعة من الخلايا الداخلية المجاورة لها في مساحة محدودة. سوف تصبح طبقة الوشاح، الأرومة الغاذية، المشيمة مع تجذير الكيسة الأريمية في بطانة الرحم بعد بضعة أيام، في حين أن الخلايا الموجودة داخل الكيسة الأريمية ستصبح الجنين نفسه. تتكون كتلة الخلايا الداخلية هذه من خلايا جذعية ذات قدرة تمايز عالية جدًا، وهي مصدر جميع خلايا الجسم لدى الشخص البالغ. تسمى هذه الخلايا بالخلايا الجذعية متعددة القدرات، ولها أهمية كبيرة في أبحاث الخلايا الجذعية.
يبدأ التمايز الأول للخلايا الجذعية متعددة القدرات في نهاية الأسبوع الثاني من الحمل، في عملية تسمى المعدة. ثم تتكون في الجنين ثلاث طبقات من الخلايا، يكون شكلها في هذه المرحلة يشبه القرص. هذه هي الطبقات الجرثومية التي تشكل مصدر أنسجة الجسم المختلفة التي تتطور في الجنين في وقت لاحق من الحمل. يتطور الدماغ والجهاز العصبي والأعضاء الحسية والجلد من الطبقة الخارجية (الأديم الظاهر)؛ يتطور الهيكل العظمي والعضلات والأنسجة الضامة والجهاز الدوري من الطبقة المتوسطة (الأديم المتوسط)؛ في حين أن الجهاز الهضمي والجهاز التنفسي يتطوران من الطبقة الداخلية (الأديم الباطن). الخلايا الجذعية التي تبني الطبقات الجرثومية هي خلايا جذعية متعددة القدرات، أي خلايا جذعية يمكنها التمايز إلى مجموعات من الخلايا، لكن لا يمكن لأي منها أن يكون مصدرًا لجنين كامل.
وفي وقت لاحق، تمر هذه الخلايا بعدة مراحل من التمايز. بعضها يصبح خلايا محددة في الأنسجة المختلفة، والبعض الآخر يستمر في التكاثر كخلايا جذعية حتى بعد الولادة. هذه الخلايا هي مستودع الخلايا الجذعية الجسدية في جسم الشخص البالغ. عند الضرورة، تدخل الخلايا الجذعية الجسدية مسار التمايز، وفي نهايته يتم تشكيل خلايا محددة. تسمى الخلية التي تدخل مسار التمايز، وبالتالي لا يمكنها الاستمرار في الانقسام إلى الأبد، بالخلية السلفية الملتزمة وتعمل كمصدر لمجموعة من الخلايا من نوع واحد أو أنواع فردية. تعد الخلايا الجذعية المكونة للدم، القادرة على التمايز إلى أنواع مختلفة من خلايا الدم وخلايا الجهاز المناعي، مثالاً على الخلايا الجذعية الجسدية التي قد تتمايز، عند الضرورة، إلى خلايا سلفية ملتزمة ومنها إلى خلايا الدم المختلفة. وتظهر هذه الخلايا بكميات كبيرة نسبياً في دم الحبل السري الذي يمكن جمعه عند الولادة، كما أنها توجد بانتظام في نخاع العظم لدى الشخص البالغ. وكميتها كبيرة نسبياً نظراً لحاجة الجسم إلى تجديد مخزون خلايا الدم المختلفة. وبنفس الطريقة، تكون كمية الخلايا الجذعية في الأمعاء كبيرة نسبيًا عند الشخص البالغ. من ناحية أخرى، فإن كمية الخلايا الجذعية التي يمكن أن تتمايز إلى خلايا عضلة القلب أو الخلايا العصبية منخفضة، لذلك قد يكون الضرر الذي يلحق بهذه الأعضاء غير قابل للعلاج.
تتمتع الخلايا الجذعية الجسدية بقدرة منخفضة نسبيًا على التمايز، وعادة ما تكون قادرة على التمايز إلى عدد صغير من أنواع الخلايا. ولهذا السبب، يقتصر استخدامها كخلايا مخصصة للزراعة على أمراض معينة فقط، ولا يكون ممكنًا إلا إذا أمكن جمع كمية كافية من الخلايا من جسم المتبرع. تعتبر عملية زرع نخاع العظم أو زراعة الدم الغني بالخلايا الجذعية إجراء طبي مقبول كعلاج للعديد من الأمراض المتعلقة بجهاز الدم. لكن العلاجات المماثلة، التي قد تساعد ملايين المرضى الذين يعانون من أمراض أخرى تسبب تلفًا لا رجعة فيه للأنسجة، غير ممكنة في هذه المرحلة، لأنه لا يزال من غير الممكن الحصول على كمية كافية من الخلايا المصنفة أو الخلايا الجذعية الجسدية التي يمكنها التمايز إلى خلايا. والتي سوف تحل محل الخلايا التالفة. وهكذا، على سبيل المثال، من أجل مساعدة المرضى الذين يعانون من إصابة شديدة في النخاع الشوكي، يجب زرع خلايا تسمى الخلايا الدبقية قليلة التغصن التي تنتج المايلين، وهي المادة العازلة التي تغلف المحاور العصبية وتسمح لها بتوصيل الإشارات العصبية. لسوء الحظ، لا توجد طريقة عملية لتلقي تبرع من شخص آخر بالخلايا الدبقية قليلة التغصن أو الخلايا السلفية القادرة على التمايز إلى هذه الخلايا.
الخلايا الجذعية الجنينية قد تغير الصورة. هذه الخلايا عبارة عن خلايا جذعية متعددة القدرات، والتي يتم استخلاصها من كتلة الخلايا الداخلية في الكيسة الأريمية بعد خمسة أيام من التخصيب في المختبر (الشكل 1). يمكن للخلايا الجذعية الجنينية، في ظل الظروف المناسبة، أن تستمر في التكاثر كخلايا جذعية متعددة القدرات وتكون بمثابة مصدر لملايين الخلايا، والتي في ظل ظروف معملية أخرى سوف تتمايز إلى نوع الخلية المرغوبة. وبهذه الطريقة يمكن الحصول على كمية كافية من الخلايا المحددة المعدة للزراعة. ومع ذلك، قبل أن يصبح هذا الإجراء الطبي رؤية مبتذلة، من الضروري تحقيق أقصى قدر من السلامة الطبية. وعلى وجه الخصوص، هناك ثلاثة مخاطر رئيسية تعيق بدء التجارب السريرية على نطاق واسع: رفض الكسب غير المشروع، والالتهابات في الخلايا المزروعة، وتطور الأورام في جسم المريض. وقد أصبحت هذه المخاطر واضحة خلال أبحاث الخلايا الجذعية على مدى 150 عاما الماضية.
القدرة على التمييز هي سيف ذو حدين
منذ القرن التاسع عشر وحتى يومنا هذا، تقدمت أبحاث الخلايا الجذعية في ثلاث قنوات منفصلة - دراسة الخلايا الجذعية في نظام الدم، ودراسة الأورام في الجسم البشري، وتطوير الإخصاب في المختبر. تتعلق القناة الأولى بفهم موقع ووظيفة الخلايا الجذعية الجسدية في جسم الإنسان البالغ. أول من أدرك أن النخاع العظمي يحتوي على خلايا تتكون منها خلايا الدم المختلفة هو الباحث الألماني إرنست نيومان، الذي ادعى ذلك في وقت مبكر من عام 19. وفي بداية القرن العشرين، بدأ نيومان وآخرون في استخدام مصطلح " "الخلايا الجذعية" أيضاً للدلالة على الخلايا المكونة للدم ("صانعة الدم") في نخاع العظم، وهذا بالإضافة إلى المعنى الذي كان للتركيبة سابقاً - خلايا في الجنين الأولي. ومنذ بداية القرن الماضي، أصر الباحثون على التضحية بين الخلايا الجذعية الجسدية والخلايا الجذعية الجنينية.
كان أول تطبيق طبي لرؤى نيومان هو زرع نخاع العظم لدى المرضى الذين يعانون من أمراض الدم، لكن مشكلة الرفض، أي ميل الجسم إلى رفض عملية زرع تحتوي على معلومات وراثية مختلفة عن معلوماته، تعني أن عمليات الزرع هذه لم تصبح روتينية إلا في النصف الثاني من القرن العشرين، عندما تم تطوير العلاج الدوائي الذي يمنع الرفض. ومن المتوقع أن تشكل خطورة رفض العضو المزروع مشكلة كبيرة في تطوير عمليات زراعة الخلايا الجذعية الأخرى، وقد يأتي الحل النهائي لهذه المشكلة من اتجاهات غير متوقعة.
في القرن التاسع عشر، أصبح الباحثون من فرنسا وألمانيا مهتمين بورم نادر وغريب يسمى الورم المسخي - "الورم الوحشي" باللغة اليونانية. الورم المسخي هو ورم حميد، عادة، يحتوي على خليط من الخلايا الناشئة من جميع الطبقات الجرثومية. في بعض الأحيان توجد أنسجة تشبه الأعضاء داخل الورم، وحتى قطع من الجلد أو أسنان كاملة أو شعر. وفقا لتكوين الخلايا الموجودة في الورم المسخي، فمن الواضح أنه ينشأ من خلية واحدة أو أكثر من الخلايا متعددة القدرات، ولكن طريقة تكوينه ليست مفهومة تماما. ومع ذلك، يبدو أن أحد أنواع الورم المسخي قد تم فك شفرته: يُعتقد أن الورم المسخي في المبيض ينشأ من بويضة خضعت للتوالد العذري، أي بدأت في الانقسام دون إخصاب. ومن المحتمل أن تتطور أنواع أخرى من الورم المسخي عندما يكون الشخص المريض لا يزال في طور النمو في رحم أمه، نتيجة وجود خلل في تمايز الخلايا الجذعية الجنينية. وهنا يتجلى أحد المخاطر المرتبطة بزراعة الخلايا المستمدة من زراعة الخلايا الجذعية الجنينية المتمايزة كليًا أو جزئيًا: إذا بقيت الخلايا الجذعية متعددة القدرات في المزرعة المزروعة، فقد تتطور إلى ورم. ولذلك لا بد من إيجاد طرق للتخلص من جميع الخلايا متعددة القدرات قبل زرعها، أو التسبب في موتها المبرمج عن طريق التعديل الوراثي.
لا ينشأ الورم المسخي من الخلايا الجذعية فحسب، بل ينشأ أيضًا من أنواع أخرى من السرطان. من المفترض أن العديد من أشكال السرطان تنتج عن سلسلة من الطفرات التي حدثت في الخلايا الجذعية الجسدية والخلايا السلفية التي تم إنشاؤها منها، والتي بدأت في التكاثر بطريقة غير منضبطة. ومن ثم، فإن دراسة الخلايا الجذعية في المختبر، وخاصة التغيرات الجينية المستهدفة لهذه الخلايا، يمكن أن تعلمنا الكثير عن السرطان وتساعد في البحث عن علاج لمختلف أشكال المرض.
الأجنة كمصدر للخلايا الجذعية
أجريت المحاولات الأولى لإجراء الإخصاب في المختبر في نهاية القرن التاسع عشر، ولكن حتى هنا استغرق الأمر وقتًا طويلاً قبل أن تنضج التقنية وتصبح إجراءً مقبولاً، بعد حوالي مائة عام. وُلد أول "طفل أنبوب" في بريطانيا عام 19. وفي وقت لاحق، تبين أن هذه الطريقة، المصممة لمساعدة الأزواج الذين يعانون من صعوبات في الخصوبة، مهدت الطريق للإنتاج المنتظم للخلايا الجذعية الجنينية البشرية.
يتضمن التخصيب في المختبر، في المرحلة الأولى، العلاج الهرموني لدى المرأة، والذي يهدف إلى إنضاج عدة بويضات في وقت واحد. وفي الخطوة التالية، يتم استخراج ما معدله عشر بويضات من مبيضيها. ويتم تخصيب هذه البويضات بالخلايا المنوية، ويتم نقل بعض الأجنة الناتجة إلى الرحم بعد بضعة أيام. ويتم تجميد بقية الأجنة في النيتروجين السائل لإجراء المزيد من التجارب. ومعظم هذه الأجنة، التي يقدر عددها اليوم بمئات الآلاف في جميع أنحاء العالم، يتم تدميرها بعد عدة سنوات إذا لم يرغب الزوجان في الحمل مرة أخرى أو التبرع بها لزوجين آخرين.
في بعض البلدان، يمكن للزوجين التبرع بالأجنة الزائدة للبحث. في إسرائيل والعديد من البلدان الأخرى، لا يتم الدفع للأزواج الذين يقومون بذلك، ويُحظر أيضًا إنشاء أجنة زائدة عن عمد. عادة ما يتم تدمير الأجنة التي يتبين أنها معيبة أثناء الفحص المجهري، أو التي تم اكتشاف عيب وراثي فيها. يتم الكشف عن العيوب الوراثية في اختبار يسمى اختبار ما قبل الزرع؛ هذا اختبار لا يؤذي الجنين النامي، ويتضمن إزالة خلية واحدة، وهي القسيم الأريمي، من التوتية المكونة من ثماني خلايا، ونقلها إلى الاختبار الجيني. هناك في الواقع اهتمام بين الباحثين بتلقي التبرع بالأجنة التالفة، والتي كان من المتوقع أن يتم تدميرها على أي حال. تعتبر الخلايا الجذعية المأخوذة من هذه الأجنة أداة مهمة في فهم تأثير العيوب الوراثية على الجنين النامي.
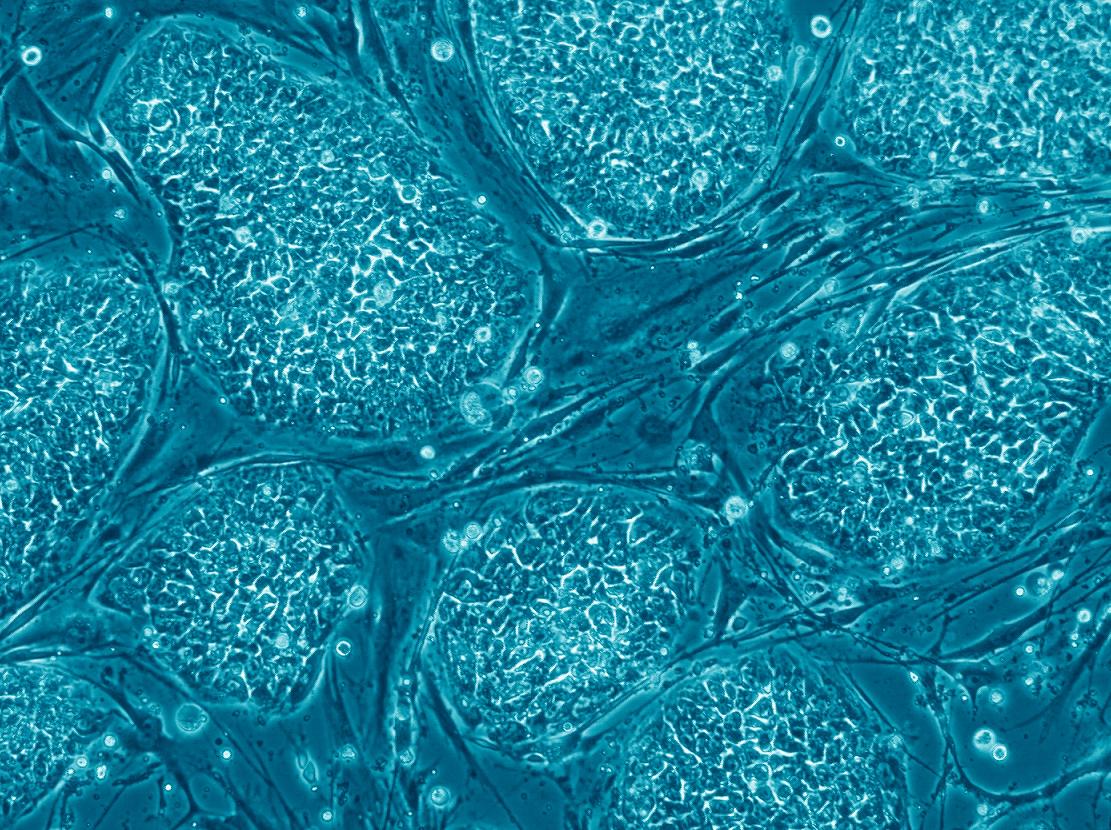
أدى خلق الأجنة عن طريق التخصيب في المختبر في نهاية المطاف إلى تحقيق تقدم كبير في أبحاث الخلايا الجذعية. كان الباحث البريطاني مارتن إيفانز (إيفانز) على دراية بمجال الخلايا الجذعية من دراساته السابقة في الأورام المسخية، لكنه أدرك أنه من أجل تطوير طرق مخبرية أكثر دقة كان عليه الحصول على الخلايا الجذعية من مصدر آخر. في عام 1981، نجح إيفانز، مع زميله ماثيو كوفمان، في استخراج الخلايا الجذعية الجنينية من الكيسة الأريمية في الفأر وإنشاء مزرعة خلوية منها (الشكل 2). تُسمى مزرعة الخلايا الجذعية المستقرة من مصدر واحد بخط الخلايا الجذعية، ويمكن للخلايا الموجودة فيه أن تستمر في الوجود بشكل غير متمايز طالما تم الحفاظ على الظروف المناسبة. لاحقًا، استخدم إيفانز خط الخلايا الجذعية الذي أنتجه لإنشاء فئران معدلة وراثيًا. لهذا العمل حصل على جائزة نوبل في الطب عام 2007.
حدث الاختراق التالي في عام 1998. كانت المجموعة البحثية لجيمس طومسون (طومسون) من جامعة ويسكونسن في الولايات المتحدة، والتي تعاونت مع البروفيسور يوسف إتزكوفيتس-إلدور من التخنيون ومستشفى رامبام في حيفا، أول من أنتج خلايا جذعية جنينية بشرية وخلق خلية جذعية بشرية. خط الخلايا الجذعية منها. يتم استخراج الخلايا الجذعية الجنينية الصغيرة من كتلة الخلايا الداخلية في الكيسة الأريمية، ولهذا يجب ثقب طبقة الأرومة الغاذية وإزالة الخلايا الداخلية. في هذه العملية يتم تدمير الجنين ولا يستمر في التطور. يتم زراعة الخلايا الجذعية الجنينية البشرية على ركيزة من خلايا الفأر، وعادة ما تكون الخلايا الليفية، والتي تمت معالجتها بحيث لا تنقسم (الشكل 3). وهي عبارة عن ركيزة لزجة تحمل الثقافة وتزودها بالمواد المغذية والعوامل المختلفة التي تفرزها الخلايا الليفية والتي تعتبر ضرورية للحفاظ على خصائص الخلايا الجذعية الجنينية.
تعتبر ركيزة خلية الفأر مشكلة لسببين: قد تخترق المستضدات من خلايا الفأر إلى الخلايا البشرية وتتسبب في رفضها أثناء عملية الزرع؛ ويمكن أن تنتقل مسببات الأمراض من خلايا الفئران إلى الخلايا البشرية وتسبب المرض. ولهذا السبب، تحاول العديد من الشركات تطوير ركيزة اصطناعية بديلة قبل بدء التجارب السريرية، وبالفعل، سيتم استخدام الركيزة الاصطناعية الجديدة التي تم تطويرها لشركة Geron الرائدة في مجال التكنولوجيا الحيوية لزراعة الخلايا المعدة للزرع.
في الآونة الأخيرة، نجح الفريق البحثي للبروفيسور بنيامين روبنوف، من مستشفى هداسا، في زراعة خلايا جذعية جنينية بشرية معلقة دون تمايز الخلايا. ووجد فريق الباحثين أنه عندما تمت زراعة الخلايا الجذعية في سائل يستخدم للتمايز الموجه إلى الخلايا العصبية، لم يتمايز جزء كبير من الخلايا الجذعية. مع تحسين البروتوكول، تم العثور على طريقة عملية لنمو كمية كبيرة من الخلايا الجذعية البشرية، والتي ظلت متعددة القدرات. الطريقة الجديدة لها آثار على القدرة على إنتاج كميات كبيرة من الخلايا الجذعية بجهد قليل نسبيًا (الشكل 4).
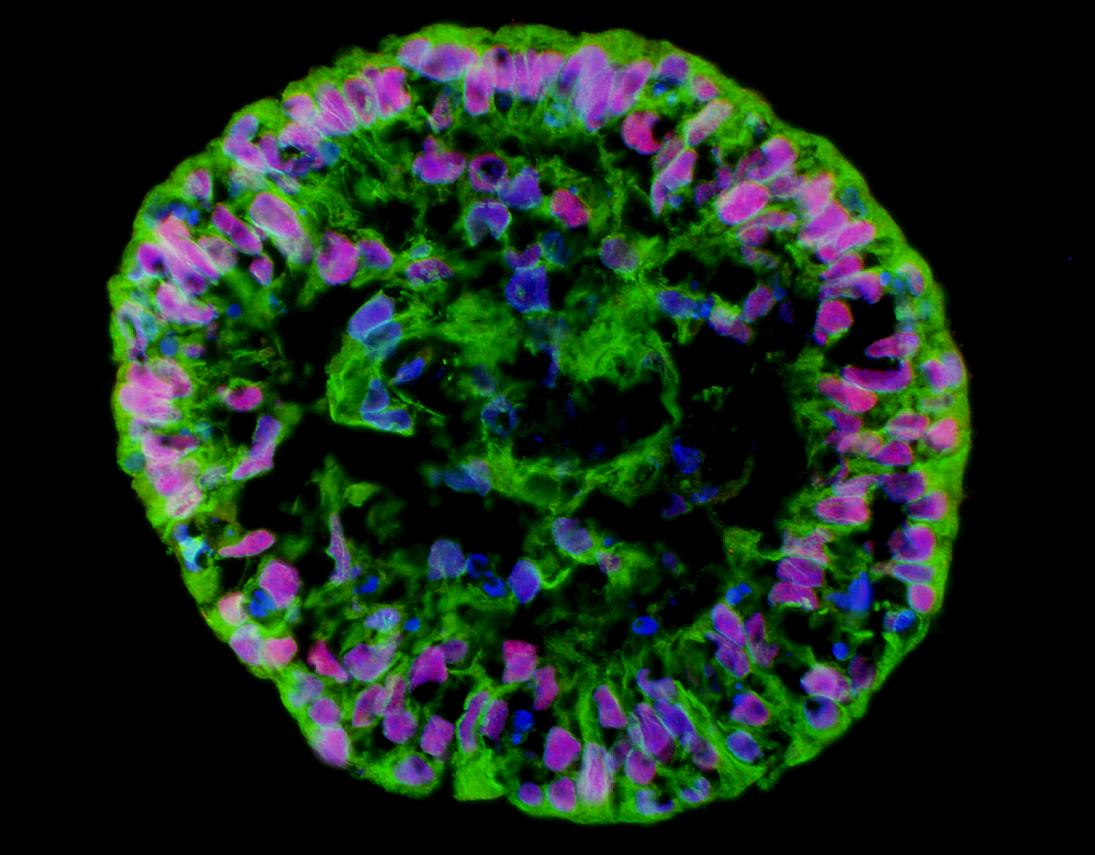
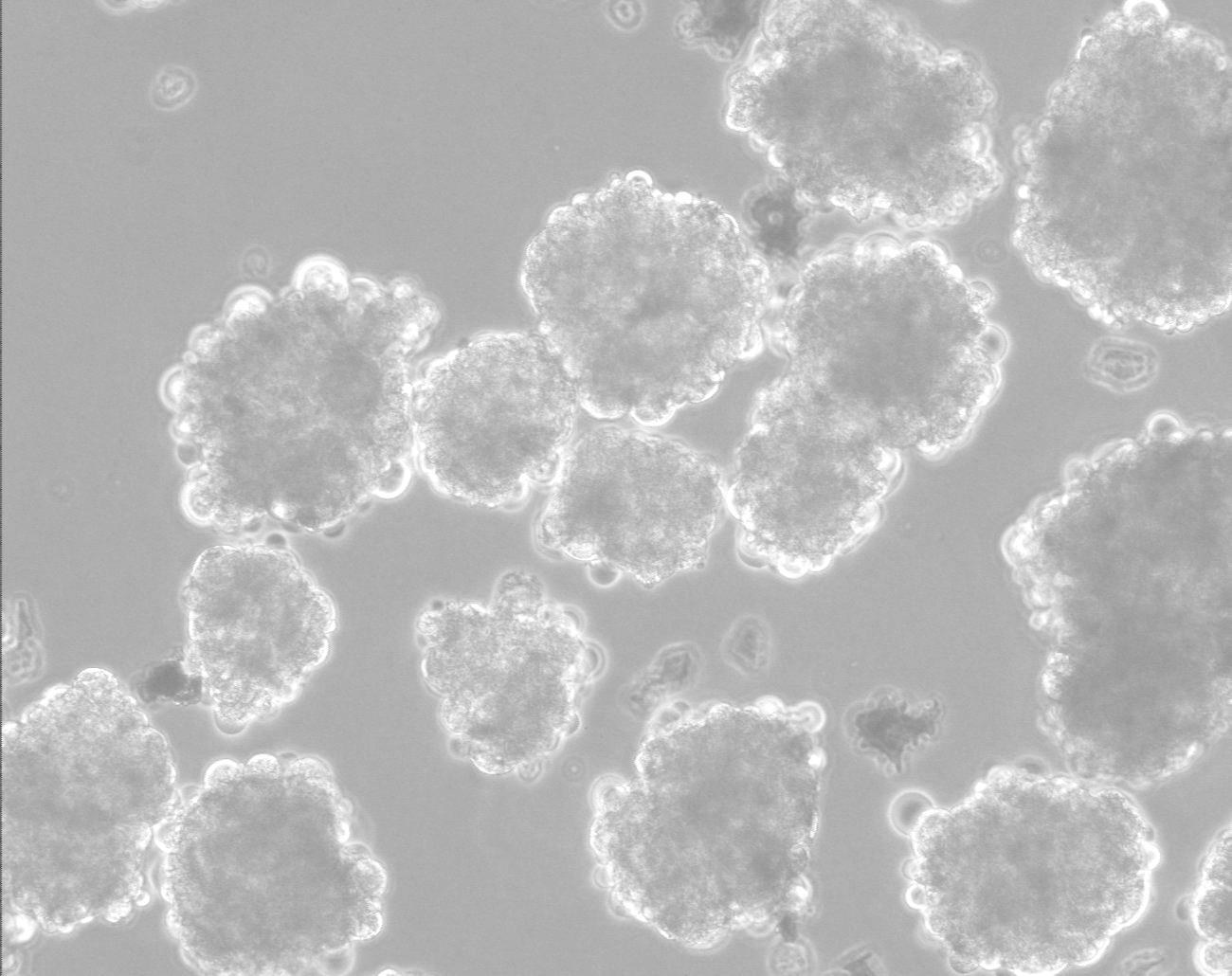
بعد أن تنمو مزرعة الخلايا الجذعية متعددة القدرات بشكل طبيعي ودون تمايز لمدة ستة أشهر، يمكن إعلانها خطًا خلويًا. يوجد اليوم بالفعل عدة مئات من خطوط الخلايا هذه حول العالم. يجب فحص مزرعة الخلايا الجذعية مرة أخرى كل بضعة أشهر للتأكد من احتفاظها بتعدد القدرات. يتضمن الاختبار عادةً تتبع معدل القسمة؛ فحص مجهري يهدف إلى التأكد من عدم ظهور أي خلايا مفروزة؛ تحديد عوامل النسخ التي تميز الخلايا الجذعية غير المصنفة، مثل Nanog وOct4؛ تحديد العلامات الموجودة على سطح الخلايا والتي تميز الخلايا الجذعية غير المصنفة؛ فحص النمط النووي بالمجهر. والتحقق من النمو الطبيعي بعد التجميد والذوبان والنقل إلى طبق بتري جديد. ومن الضروري أيضًا التأكد من عدم تلف قدرة تمايز الخلايا. ولهذا الغرض، يتم نقل كمية صغيرة من الخلايا إلى ركيزة سائلة لتكوين معلق، ويتم التحقق مما إذا كان الجسم الشبيه بالجنين (الجسم الجنيني) الذي يحتوي على خلايا جذعية مصنفة من الطبقات الجرثومية الثلاث قد بدأ في التشكل (انظر الشكل في بداية المقال). هناك طريقة أخرى للتحقق من حدوث التمايز وهي حقن الخلايا في فأر ذي جهاز مناعي مكبوت (لمنع الرفض). مثل هذا الحقن يجب أن يخلق ورمًا مسخيًا حميدًا في جسده.
يوفر كل خط خلوي للباحثين مصدرًا لا حصر له من الخلايا الجذعية المعروفة خصائصها، والتي يمكن، إذا لزم الأمر، الحصول على خلايا مختلفة مرتبة من خلال التلاعب الجيني أو إضافة عوامل محددة. ويمكن استخدام الخلايا التي تم فرزها كمزرعة لاختبار تأثير الأدوية الجديدة قبل طرحها في السوق أو كمصدر للخلايا للزراعة لدى المرضى. ومع ذلك، فإن خطر الرفض لا يزال قائما، ومن أجل التغلب عليه، هناك حاجة إلى أساليب أخرى.
العقبات الأخلاقية
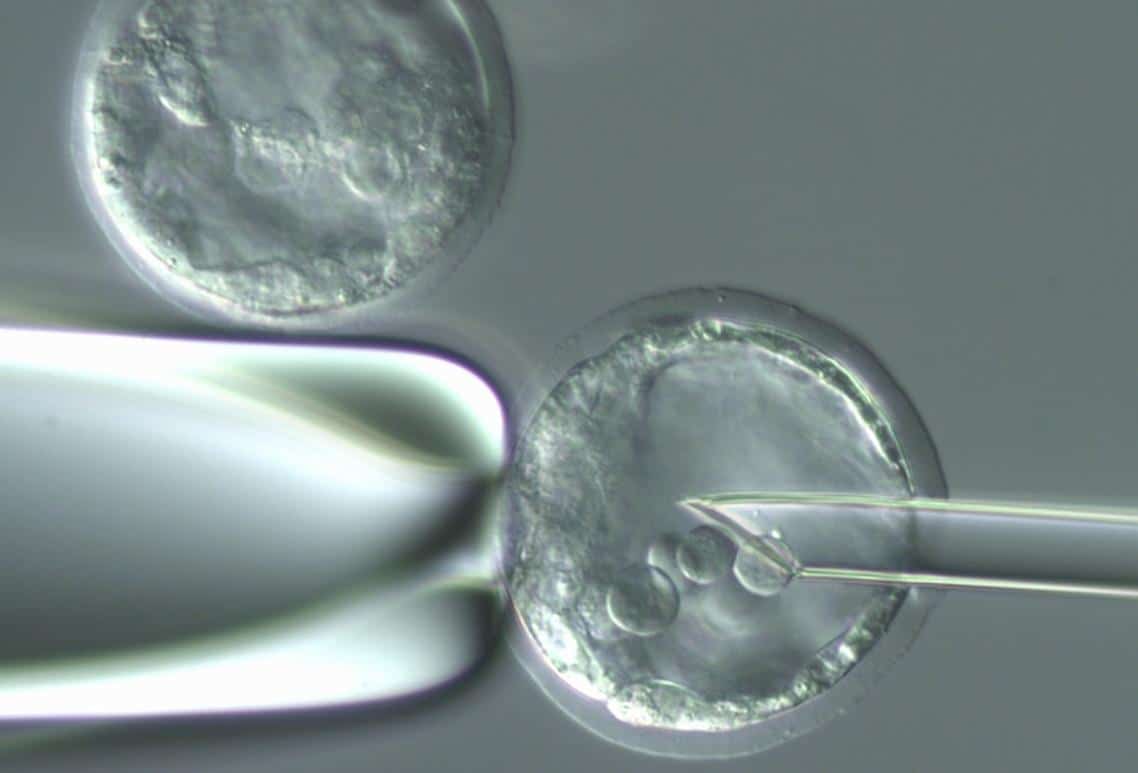
ومن أجل تجنب رفض عملية الزرع دون تثبيط الجهاز المناعي للمريض، وهو إجراء طبي يحتمل أن يكون خطيرا، فمن المطلوب أن تكون المعلومات الوراثية في الخلايا المزروعة هي نفس المعلومات الوراثية في خلايا جسم المريض. والجواب على هذا التحدي هو الاستنساخ الطبي. يعتمد الاستنساخ على نقل نواة من خلية جسدية طبيعية، عادة ما تكون خلية جلدية، إلى بويضة غير مخصبة تم إزالة النواة منها. يؤدي النبض الكهربائي إلى التنشيط، وبعد ذلك تبدأ البويضة في الانقسام. عندما يصل الجنين إلى مرحلة الكيسة الأريمية، يمكن استخلاص الخلايا الجذعية الجنينية التي تحتوي على المعلومات الوراثية للمريض منه. وبهذه الطريقة، يمكن إنشاء خط خلايا جذعية شخصي لكل مريض يحتاج إلى عملية زرع، والتغلب على خطر الرفض.
وتثير هذه الطريقة اعتراضات من نوعين: يرى البعض أن استنساخ الخلايا البشرية، حتى لو لم يسفر عن ولادة طفل، هو عمل غير أخلاقي، وسيؤدي إلى إباحة استنساخ البشر لأغراض الإنجاب؛ إن إنتاج الخلايا الجذعية من الجنين أثناء تدميره يمثل أيضًا مشكلة أخلاقية بيولوجية في نظر الكثيرين، حتى لو كانت الأجنة هي التي سيتم تدميرها على أي حال. وهذه المسألة تتعلق بمسألة اللحظة التي يصبح فيها الجنين إنساناً. هذا السؤال ليس علمياً بحتاً، وفي مناقشته يجب أيضاً أن تؤخذ في الاعتبار الاعتبارات الثقافية والدينية. وفي نظر المسيحية الكاثوليكية، فإن لحظة الحمل هي لحظة بداية الحياة، ومن هنا كانت معارضة الفاتيكان الشديدة لإنتاج الخلايا الجذعية الجنينية. أما اليهودية والإسلام فيزعمان أن قانون الجنين في مراحل الحمل الأولى ليس كقانون الجنين الذي على وشك أن يولد. وبحسب الرأي الشائع في اليهودية، من الممكن استخدام الخلايا الجنينية للبحث، والتي بالتأكيد لن يتم نقلها إلى الرحم.
ومع ذلك، يمكن التعامل مع المسألتين الأخلاقيتين بطريقة مختلفة - من خلال التطورات التكنولوجية العلمية التي من شأنها أن تلغي الحاجة إلى إيذاء الأجنة، وضرورة الاستنساخ لإنشاء خط من الخلايا الجذعية الشخصية. وقد تم بالفعل العثور على حلين من هذا القبيل في الآونة الأخيرة.
تتكرر الخلايا في الوقت المناسب
الحل الأول والأبسط يسمح بإنشاء خط من الخلايا الجذعية الجنينية دون تدمير الجنين. يتضمن الاختبار الجيني قبل الزرع للجنين الذي تم إنشاؤه عن طريق التخصيب في المختبر إزالة خلية واحدة - القسيم الأريمي - من التوتية. إذا تبين أن الخلية طبيعية، يمكن نقل الجنين إلى الرحم: إزالة الخلية الواحدة لا تؤذي الجنين، ويمكن أن يتطور إلى طفل سليم. والآن نجح الباحثون في استخدام هذه الخلية المنفردة، بدلاً من التشخيص الجيني، لإنشاء مزرعة للخلايا الجذعية.
أما الحل الثاني الأكثر تعقيدًا فيتعامل أيضًا مع مشكلة الرفض. والفكرة من وراء ذلك هي عكس اتجاه التمايز، أي أخذ خلية جسدية من جسم إنسان بالغ وإعادتها إلى الحالة متعددة القدرات التي ميزت أحد أسلافها الأوائل. ويتم ذلك من خلال تغيير جيني في الخلية الجسدية، مما يجعلها تفرز جينات معينة. تقوم هذه الجينات بتشفير عوامل النسخ، مثل Oct4 المذكورة سابقًا، والتي تميز الخلية الجذعية غير المصنفة. الخلايا الناتجة، والتي تسمى الخلايا الجذعية المستحثة متعددة القدرات (خلايا iPS)، لها خصائص الخلايا الجذعية الجنينية الطبيعية: يمكنها الانقسام والبقاء خلايا جذعية أو التمايز إلى خلايا من الطبقات الجرثومية الثلاث. وقد تم تسجيل النجاح الأول في هذا المجال في مختبر الباحثة اليابانية شينيا ياماناكا، التي نجحت عام 2006 في إعادة خلايا الفئران البالغة إلى حالتها الجنينية. وبعد مرور عام، تمكنت مجموعة يامانكا ومجموعة الباحث الأمريكي طومسون من تحقيق إنجاز مماثل في الخلايا البشرية.
وماذا بعد؟
وفي السنوات المقبلة، من المتوقع أن تبدأ التجارب السريرية على البشر، والتي تجريها شركات التكنولوجيا الحيوية الرائدة مثل جيرون. في أول تجربة مخطط لها، سيتم زرع الخلايا السلفية قليلة التغصن، والتي سيتم إنتاجها من الخلايا الجذعية الجنينية البشرية، في أجسام المرضى الذين يعانون من إصابة شديدة في النخاع الشوكي. قد يساعد هذا العلاج المرضى على تحريك أطرافهم. سيتم استخدام الخلايا العصبية والخلايا الأخرى المرتبطة بها، والتي سيتم إنتاجها من الخلايا الجذعية، في مجموعة متنوعة من العلاجات المبتكرة للأمراض التي تؤثر على الدماغ والجهاز العصبي، مثل مرض الزهايمر ومرض باركنسون ومرض لو جيريج (ALS). وإذا نجح الطب التجديدي، الذي يعتمد على زرع خلايا متمايزة عن الخلايا الجذعية متعددة القدرات، في علاج هذه الأمراض وغيرها من الأمراض الخطيرة، مثل أمراض القلب، فإن ملايين المرضى حول العالم سيكون لديهم أمل جديد.
من المواضيع الرائعة، التي ما زال باحثو الخلايا الجذعية بعيدين عن فهمها، هو مجموعة الآليات اللاجينية - أي الآليات الوراثية التي لا تشتق من تسلسل الحمض النووي - والتي تسبب تمايز الخلايا الجذعية وتطور الأعضاء في الجسم. الجنين المتنامي. من المعروف أن التمايز يتميز بالحد من التعبير عن جينات معينة، وأن العوامل التي تنشطه هي مواد كيميائية تفرزها خلايا أخرى، والاتصال الجسدي مع الخلايا المجاورة والجزيئات الموجودة في السائل المحيط بالخلايا (البيئة الدقيقة). لكن الصورة التفصيلية لم يتم الكشف عنها بعد. ربما عندما تتضح هذه التفاصيل، سنكون قادرين على تحقيق الوعد الأكبر للخلايا الجذعية، ألا وهو تخليق أعضاء كاملة مخصصة للزراعة.
الإطار 1: وماذا عن إسرائيل؟
هل تقوم أيضًا بإجراء أبحاث على الخلايا الجذعية المحفزة متعددة القدرات (خلايا iPS)؟
يعد توليد الخلايا الجذعية المحفزة المحفزة إنجازًا مهمًا. انضممنا إلى الأبحاث في هذا المجال، ونشرنا ثلاث مقالات فيه خلال العام ونصف العام الماضيين. في المقالة الأخيرة قمنا بمقارنة نموذج المرض الوراثي في الخلايا الجذعية الجنينية ونموذج مماثل في الخلايا الجذعية متعددة القدرات. لقد اكتشفنا أن النماذج متشابهة في كثير من النواحي، ولكنها تختلف عند نقطة حرجة معينة. على الرغم من أوجه التشابه بين نوعي الخلايا، فمن المهم مواصلة استكشاف الاختلافات.
هل ستحل هذه الخلايا محل الخلايا الجذعية الجنينية أم أن استخدامها الطبي سيكون محدودا؟
الباحثون على وشك إجراء تجارب سريرية على الخلايا الجذعية الجنينية في الولايات المتحدة. ومن ناحية أخرى، فإن الاستخدام الطبي للخلايا الجذعية المستحثة لا يزال غير آمن، لأن التلاعب الجيني ضروري حاليا لتخليقها. ولذلك أستطيع أن أقول على وجه اليقين أن التجارب السريرية على الخلايا الجذعية الجنينية سوف تسبق التجارب السريرية على الخلايا الجذعية المستحثة. ومن ناحية أخرى فإن الخلايا المستحثة تحمل معها ابتكارا كبيرا وهو إمكانية إنتاج الخلايا المستحثة من جسم المريض نفسه وإعادة إليه خلايا مطابقة وراثيا لخلايا جسده. بهذه الطريقة، لن يحدث رفض للكسب غير المشروع.
أين يقف البحث من حيث القدرة على التحكم في تمايز الخلايا الجذعية؟
في السنوات العشر الأخيرة، تم تطوير العديد من البروتوكولات لتمييز الخلايا الجذعية الجنينية إلى أنواع مختلفة من الخلايا، مثل خلايا الجلد والأعصاب والكبد. تتمثل الصعوبة الرئيسية في الوقت الحالي في الحصول على ثقافة تحتوي على خلايا مصنفة فقط. هناك طرق تسمح لنا بالحصول على ثقافة نظيفة تقريبًا للخلايا المصنفة، على سبيل المثال - بمساعدة ماسح ضوئي للخلايا. ومع ذلك، فإن كمية الخلايا التي تم الحصول عليها بهذه الأساليب صغيرة نسبيا.
في التجارب السريرية المقرر إجراؤها في الولايات المتحدة، والتي سيتم فيها زرع الخلايا في أجسام المرضى الذين أصيبت أعمدتهم الفقرية بجروح خطيرة، ليس القصد هو استخدام ماسح ضوئي للخلايا، بل استخدام مزارع غير نظيفة تمامًا من حيث المصطلح من تكوين الخلايا، على الرغم من الخطر الواضح المتمثل في تطور الأورام من الخلايا غير المصنفة. أحد المقترحات هو زرع الخلايا في المرحلة التي تكون فيها خلايا سليفة، بحيث تخضع للتمايز الأخير في جسم المريض. بهذه الطريقة، سيتم تقليل خطر تطور الورم، وسيتم تحقيق ميزة أخرى - تجدد الخلايا المزروعة أنسجة المريض بمرور الوقت. الخطر هو أنهم قد لا يفرقون بشكل صحيح، ولمعرفة هذه النقطة من الضروري مواصلة البحث الأساسي.
كيف يمكنك التعامل مع خطر الأورام؟
زرع الخلايا الجذعية غير المصنفة أمر خطير. لقد أظهرنا لأول مرة أن هذه الأورام حميدة، إلا أن هذه مشكلة خطيرة. لقد قمنا بتطوير بعض الاستراتيجيات للتغلب عليها. أولاً، قمنا بتطوير طريقة لفصل أنواع الخلايا، حتى نتمكن من زرع الخلايا التي لا تسبب الأورام فقط. ثانياً، أظهرنا كيف يمكن القضاء على الورم إذا تشكل، أو بدلاً من ذلك استخدام التلاعب الجيني الذي يتضمن إدخال "جين انتحاري" من شأنه أن يتسبب في الموت المخطط له للخلايا التي قد تشكل ورماً.
أين موقع إسرائيل فيما يتعلق بالنتائج والإنجازات في أبحاث الخلايا الجذعية؟
ومن حيث العدد المطلق للدراسات، تحتل إسرائيل المرتبة الثالثة في العالم، بعد بريطانيا العظمى، وفي دراسة مقارنة تبين أن باحثين من البلاد شاركوا في نصف المقالات العشرين المهمة في هذا المجال. وهذا على الرغم من أن الدعم الحكومي لأبحاث الخلايا الجذعية محدود للغاية.
السؤال الأخير: هل تعتقد أنه سيكون من الممكن النجاح يوما ما في زراعة أعضاء كاملة من الخلايا الجذعية المعدة للزراعة؟
هذا سؤال مهم جدا. يتضمن تكوين الجنين عمليتين: التمايز وتكوين الأنسجة. لقد نجحنا في تحقيق التمايز في المختبر، لكننا مازلنا نفشل في تكوين نسيج كامل. يجري العمل أيضًا في هذا الاتجاه في مختبري، ولدينا بعض الأفكار الجديدة. يعد إنشاء الأعضاء في المختبر أحد الأهداف الرئيسية طويلة المدى لأبحاث الخلايا الجذعية.
الإطار الثاني: كلمة المشرع
ونظرًا لقضايا أخلاقيات علم الأحياء التي يثيرها إنتاج الخلايا الجذعية من الأجنة واستخدام تقنيات الاستنساخ، فقد كانت هذه القضية مطلوبة من قبل الهيئات التشريعية في العديد من البلدان. واختارت كل دولة طريقها الخاص، بحسب "المناخ العلمي" السائد في الدوائر الحكومية والجمهور، وإشراك الجمهور والمنظمات غير البرلمانية في المسائل الأخلاقية والاعتبارات الدينية والثقافية. وتكشف مراجعة التشريعات في مختلف البلدان عن وجود اتفاق واسع النطاق إلى حد ما حول قضيتين: حظر استنساخ البشر لأغراض التكاثر وحظر استخدام الأجنة البشرية التي يزيد عمرها عن أسبوعين لأغراض البحث.
الخلايا الجذعية الجنينية والكنيسة
يمكن تقسيم القيود القانونية في مختلف البلدان إلى ثلاثة مستويات. تمنع الدول الأكثر صرامة إجراء أي أبحاث حول الخلايا الجذعية. تضم هذه المجموعة بشكل رئيسي الدول التي تتميز بتأثير قوي للكنيسة الكاثوليكية، مثل بولندا وإيرلندا. أما المجموعة الثانية فتضم الدول التي تسمح بإنتاج الخلايا الجذعية الجنينية، لكنها لا تسمح بتخليق أجنة محددة مسبقا لهذا الغرض. ولذلك لا يمكن الحصول على الخلايا الجذعية إلا من الأجنة التي تم إنشاؤها لغرض التكاثر في الإخصاب في المختبر، والتي لم تعد هناك حاجة إليها لهذا الغرض. وتشمل هذه المجموعة إسرائيل وكندا. تسمح السياسة الأكثر ليبرالية بتخليق الأجنة لأغراض البحث، ولكنها تقصر نموها واستخدامها على الفترة الأولى من تطورها. وتنتمي بريطانيا العظمى والصين إلى المجموعة الثالثة.
بين بوش وأوباما
ولا تندرج كل دولة ضمن إحدى هذه المجموعات الثلاث. وتسمح ألمانيا بإجراء الأبحاث على الخلايا الجذعية الجنينية، لكنها تحظر إنتاجها على أراضيها. والوضع في الولايات المتحدة أكثر تعقيدا. لا يوجد قانون فيدرالي يحظر أبحاث الخلايا الجذعية الجنينية، ولكل ولاية من ولايات الولايات المتحدة الحق في أن تحدد لنفسها ما هو مسموح وما هو غير مسموح به في مجالها. ويتنوع نطاق القيود في مختلف البلدان، بدءًا من الحظر الكامل وانتهاءً بسياسة متساهلة وليبرالية. في الدول المتساهلة، عادة ما يكون هناك استثمار خاص ضخم في أبحاث الخلايا الجذعية، ويُسمح للدولة نفسها بالاستثمار بسخاء في الأبحاث - لكن أموال الأبحاث الفيدرالية تخضع لقرار الرئيس. ג'ורג' בוש, כאשר כיהן כנשיא, התנגד לחקר תאי גזע עובריים, אך אִפשר מימון פדרלי קטן שיועד לשורות תאי גזע אשר נוצרו לפני אוגוסט 2001. אובמה נקט עמדה הפוכה, וביטל את ההגבלות של בוש על חקר מאות שורות תאי הגזע שנוצרו במהלך העשור الاخير. إلا أن التمويل الفيدرالي أصبح الآن مشروطاً بالموافقة على الرتب وفقاً للمبادئ التوجيهية الأخلاقية التي تمت صياغتها العام الماضي، وليس من المؤكد على الإطلاق أن جميع الرتب، حتى تلك التي تم إنشاؤها قبل إعلان بوش، سوف تتلقى التمويل السخي من إدارة أوباما. إدارة.
المربع 3: مسألة علم الوراثة
علم التخلق هو مجال يتعامل مع دراسة الآليات الوراثية، التي تشارك في تحديد النمط الظاهري والتعبير الجيني والتي لا تشتق من تسلسل الحمض النووي. يتم تحديد خاصية تعدد القدرات للخلايا الجذعية الجنينية في المقام الأول من خلال عدد صغير من عوامل النسخ. من بين عوامل النسخ هذه يمكننا أن نذكر Oct4، وSox2 nanogut، والتي يتم التعبير عنها في الخلايا الجذعية الجنينية البشرية. أظهرت التجارب التي تم فيها إنتاج الخلايا الجذعية متعددة القدرات لأول مرة أن إدخال كمية صغيرة من الجينات التي تشفر عوامل النسخ مثل هذه قادر على التسبب في عودة الخلية الجسدية المصنفة إلى حالة متعددة القدرات.
تؤثر عوامل النسخ في الخلايا الجذعية على التعبير عن الجينات التي ترمز للبروتينات، والتي تحدد الخصائص اللاجينية للخلية. وهكذا، على سبيل المثال، قد تسبب هذه البروتينات مثيلة للحمض النووي، أي إضافة مجموعة ميثيل (CH3-) إلى مكان محدد في الحمض النووي، مما يسبب توقف التعبير عن بعض عوامل النسخ التي تميز المادة متعددة القدرات. ولاية. تؤثر عملية المثيلة هذه، والتي سيتم توريثها أيضًا من قبل أحفاد الخلية (مثيلة دي نوفو)، على الخروج من الحالة متعددة القدرات وبداية التمايز. من ناحية أخرى، فإن إزالة الميثيل من أماكن محددة في الهستونات - البروتينات المشاركة في تعبئة الحمض النووي في الكروماتين - قد تتسبب في استمرار التعبير عن عوامل النسخ التي تميز الحالة متعددة القدرات، وبالتالي الحفاظ على الخلايا الجذعية في حالتها متعددة القدرات.
بالإضافة إلى آليات المثيلة وإزالة الميثيل، من المحتمل أن يكون هناك العديد من الآليات اللاجينية الأخرى التي بدأ الباحثون في اكتشافها في السنوات الأخيرة. وتشمل هذه الآليات تعديلات ما بعد الترجمة في الهستونات، والتغيرات الهيكلية في الكروماتين والتغيرات في بنية النواة. إن الفهم الأكثر اكتمالًا للآليات اللاجينية والعلاقات المعقدة بينها سيمكن من فهم عمليات التجديد والتمايز في الخلايا الجذعية المختلفة، وسيسمح لنا بالتحكم بشكل أكثر فعالية في الخلايا الجذعية التي تنمو في المزرعة والخلايا الجذعية في الخلايا الجذعية. جسم الإنسان.
عن المؤلفين
جودي ميلاميد كاتس هي كيميائية تكمل دراسات الدكتوراه في علم الأحياء الدقيقة في الجامعة العبرية؛ عملت في Teva وMZP، وتعمل حالياً في مجال الكتابة والتعليم العلمي.
أرييه ميلاميد كاتس هو مهندس إلكترونيات ودكتوراه في الفيزياء، خريج معهد وايزمان للعلوم؛ تعمل حاليًا في كتابة وتطوير برامج تعليم العلوم وإلقاء المحاضرات في الموضوعات العلمية وتقديم خدمات الاستشارات العلمية.
مدونة آرييه
ariejudy@gmail.com
لمزيد من القراءة:
* موقع المعاهد الوطنية للصحة حول الخلايا الجذعية، مع قائمة محدثة من المصادر والمبادئ التوجيهية الجديدة للموافقة على خطوط الخلايا الجذعية:
http://stemcells.nih.gov/
* رسوم متحركة عن الخلايا الجذعية :
* مقالة موسوعة ستانفورد للفلسفة حول أخلاقيات أبحاث الخلايا الجذعية:
http://plato.stanford.edu/entries/stem-cells/
* تقرير اللجنة الاستشارية لأخلاقيات علم الأحياء التابعة للأكاديمية الوطنية الإسرائيلية للعلوم حول استخدام الخلايا الجذعية الجنينية لأغراض البحث الطبي:
http://bioethics.academy.ac.il/hebrew/report1/Report1-h.html
* مجموعة مقالات عن الخلايا الجذعية في الطبيعة :
http://www.nature.com/stemcells/index.html
* مقالات أساسية في تاريخ أبحاث الخلايا الجذعية:
و. أول إنشاء لخط الخلايا الجذعية الجنينية للفأر:
إيفانز، إم جي وكوفمان، إم إتش، "إنشاء ثقافة الخلايا متعددة الإمكانات من أجنة الفئران"، طبيعة 292(5819):154-156 (1981).
ب. أول إنشاء لخط الخلايا الجذعية الجنينية البشرية:
Thomson، JA،itskovitz-Eldor، J.، Shapiro، SS، Waknitz، MA، Swiergiel، JJ، Marshall، VS and Jones، JM، "خطوط الخلايا الجذعية الجنينية المستمدة من الكيسات الأريمية البشرية"، العلوم 282 (5391): 1145- 1147 (1998).
ثالث. أول إنشاء لخلايا الفأرة iPS:
تاكاهاشي، ك. وياماناكا، إس.، "تحريض الخلايا الجذعية متعددة القدرات من مزارع الفئران الجنينية والأرومات الليفية البالغة بواسطة عوامل محددة"، الخلية 126(4):663-676 (2006).
رابع. توليد خلايا iPS من الإنسان:
Takahashi، K.، Tanabe، K.، Ohnuki، M.، Narita، M.، Ichisaka، T.، Tomoda، K. and Yamanaka، S.، "تحريض الخلايا الجذعية متعددة القدرات من الخلايا الليفية البشرية البالغة بواسطة عوامل محددة"، الخلية 13(5):861-872 (2007).
Yu، J.، Vodyanik، MA، Smuga-Otto، K.، Antosiewicz-Bourget، J.، Frane، JL، Tian، S.، Nie، J.، Jonsdottir، GA، Ruotti، V.، Stewart، R.، سلوكفين، II وطومسون، JA، "خطوط الخلايا الجذعية المحفزة المستحثة المستمدة من الخلايا الجسدية البشرية"، العلوم 318(5858):1917-1920 (2007).
ال. أول استنساخ طبي لجنين بشري:
فرينش، أيه جيه، آدامز، كاليفورنيا، أندرسون، إل إس، كيتشن، جيه آر، هيوز، إم آر، وود، إس إتش، "تطوير الكيسة الأريمية المستنسخة البشرية بعد النقل النووي للخلايا الجسدية مع الخلايا الليفية البالغة"، الخلايا الجذعية 26(2):485-493 (2008).
و. أول استخدام للقسيم الأريمي كمصدر لخط الخلايا الجذعية الجنينية البشرية:
Klimanskaya، I.، Chung، Y.، Becker، S.، Lu، SJ and Lanza، R.، "Human Embryonic Stem Lines Derived from Single Blastomeres"، Nature 444(7118):481–485 (2006).

تعليقات 3
المقال أبهرني. يتم تقديم هذا الموضوع المهم هنا بطريقة مشرقة ومثيرة. شكرًا لك.
مقالة أساسية ممتازة، شكرا.
فيما يتعلق بالتجارب السريرية على الخلايا الجذعية الجنينية - فمن المحتمل جدًا أنه بالإضافة إلى تجربة شركة Geron على إصابات النخاع الشوكي، ستبدأ قريبًا تجربة علاج ضمور ستارغاردت البصري في الولايات المتحدة.
وتتوقع شركة Advanced Cell Technology أن تتلقى إجابة إدارة الغذاء والدواء بشأن الموافقة على التجربة في نهاية شهر أغسطس، وإذا تمت الموافقة عليها - فسوف تبدأ فعليًا بعد ثلاثة أشهر.
إن نجاح هذه التجربة سيمهد الطريق أيضًا لتجارب في علاج AMD.