نجح العلماء في تطوير طريقة مبتكرة يمكن من خلالها "النظر" إلى البروتينات أثناء طيها - في أقل من ميلي ثانية - إلى الأشكال المتقنة والملتوية التي تحدد نشاطها.
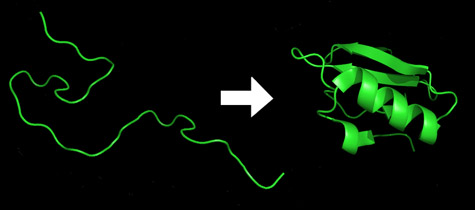
لدى الإنسان حوالي ثلاثين ألف جينة مسؤولة عن تخليق أكثر من مليوني بروتين. جزيئات البروتين هي التي تقوم بمعظم العمل في الخلايا.
يتم الحصول على البروتينات كسلاسل مستقيمة من الأحماض الأمينية التي تطوى بشكل مستقل إلى ما يسمى "بشكلها الطبيعي" في غضون بضعة أجزاء من الثانية/ثانية. يعتمد نشاط البروتين بشدة على شكله النهائي. على سبيل المثال، غالبًا ما توصف الإنزيمات والجزيئات التي تغيرها بأنها تتناسب معًا مثل القفل ومفتاحه. وبالمنطق نفسه، تكون البروتينات غير المطوية مسؤولة عن عدد من أمراض التنكس العصبي من أسوأ الأنواع، مثل مرض الزهايمر، ومرض باركنسون، ومرض جنون البقر.
طرق الاختبار الحالية غير قادرة على مطابقة السرعة التي تطوى بها البروتينات. إن التنبؤ بالشكل القابل للطي للبروتينات دون معرفة مسبقة يتطلب استخدام أجهزة كمبيوتر عملاقة قوية أو طريقة "الحوسبة السحابية" (باستخدام قوة الحوسبة المشتركة لعدد كبير من أجهزة الكمبيوتر المنزلية). وفي كلتا الحالتين، يعد التنبؤ طريقة طويلة وغير دقيقة في بعض الأحيان، ونتيجة لذلك، فإن التأخر في فهم العلاقة بين البروتين وبنيته يؤدي إلى إبطاء استخدام معلومات تسلسل الحمض النووي في مجالات الطب والتكنولوجيا الحيوية. إن الطريقة المتطورة لمراقبة العمليات التي تطوي فيها البروتينات وتتكشف، قد توفر في النهاية نوع التفاصيل اللازمة لتحسين جودة التنبؤ ببنية البروتين.
في العدد الأخير من النسخة الإلكترونية من مجلة الجمعية الكيميائية الأمريكية، يصف ثلاثة علماء، بقيادة الدكتور مايكل إل. جروس، أستاذ الكيمياء بجامعة واشنطن في سانت لويس، بحثًا أوليًا استخدموا فيه نهجًا مبتكرًا لملاحظة طي بروتينات صغيرة تسمى بارستار.
وتشبه طريقتهم، بشكل عام، الطريقة التي يتم من خلالها تصوير المقذوفات الطائرة أو البالونات المنفجرة اليوم باستخدام ستروبوسكوب (جهاز لتتبع الأجسام في حركة دائرية) وكاميرا عالية السرعة. يستخدم العلماء نسخة موازية من هذه الطريقة المعروفة "لمراقبة" البروتينات القابلة للطي. "الضوء القوي" في هذه الحالة هو قفزة في درجة الحرارة و"الكاميرا" عبارة عن تفاعل كيميائي يتم قياس نتيجته باستخدام مطياف الكتلة الحساس.
يوضح الباحث الرئيسي: "تخيل البروتين كسلسلة من آلاف الذرات المرتبطة ببعضها بواسطة النوابض". "إذا قمنا بتعليق هذه السلسلة من السقف بخيط وتركناها تتأرجح، تخيل العدد الهائل من الأشكال التي ستنتج."
إن الشكل الطبيعي لبروتينات البارستار وتسلسل الأحماض الأمينية الخاصة بها معروف ومعترف به. ما هو غير معروف هو كيف يلتوي التسلسل ويطوى إلى شكله الهيكلي النهائي. ولحسن الحظ بالنسبة للعلماء، فإن بروتينات بارستار، على عكس معظم البروتينات، لا تطوي عند درجة حرارة صفر درجة مئوية، ولا تبدأ في الطي إلا بعد تسخينها. يستغرق الطي نفسه ميكروثانية فقط.
بدأ العلماء الاختبار عن طريق حقن محلول بارد من البروتينات وكمية صغيرة من بيروكسيد الهيدروجين في ألياف ضوئية مجوفة صغيرة. وفي الخطوة التالية، يتم تسخين كتل صغيرة من العينة الموجودة في الألياف باستخدام نبضات ليزر سريعة. تقوم النبضة الأولى بتسخين المحلول إلى النقطة التي يتم فيها تفضيل تكوين بروتين معين بقوة. تقوم النبضة الثانية بتكسير بعض جزيئات بيروكسيد الهيدروجين إلى نصفين، يشكل كل منهما جذرًا نشطًا للغاية (الهيدروكسيل). تتفاعل هذه الجذور بسرعة مع أجزاء البروتين المعرضة للمحلول، و"تميزها" بذرات الأكسجين. ردود الفعل الجذرية يجب أن تكتمل بسرعة كبيرة؛ وإلا فإن بعض العلامات ستحدث في الأجزاء الداخلية من الهيكل. وفي غضون ميكروثانية، تعمل الأحماض الأمينية التي تعمل ككاسحات جذرية على تحييد أي جذور زائدة متبقية، لمنعها من كسر الروابط أو تغيير شكل البروتين. تتكرر هذه العملية مراراً وتكراراً حوالي خمسمائة مرة، مع الحصول على "صور" للمسار الذي يغير فيه البروتين تكوينه بسرعة. ويشير الباحث الرئيسي إلى أن "الجذور لا تحدد جميع الذرات". "ومع ذلك، فإنها تحدد حوالي نصف الأحماض الأمينية، وهي نتيجة جيدة جدًا. معظم المواد الكيميائية الأخرى تكون انتقائية للغاية أو بطيئة جدًا بالنسبة لهذا النوع من التجارب." يوضح الباحث: "نقوم بجمع كل قطرة من البروتين المسمى عندما تترك الألياف".
"في الخطوة التالية، نقوم بتقطيع البروتين ببطء وبعناية باستخدام إنزيم يقوم بتكسير سلاسل الأحماض الأمينية في نقاط محددة ومحددة مسبقًا، للحصول على قطع البروتين المعروفة، المعروفة باسم الببتيدات. يتم بعد ذلك فصل أجزاء البروتين هذه وفقًا لطبيعتها باستخدام الفصل اللوني السائل، ثم "يزن" مطياف الكتلة كمية كل نوع من هذه الأنواع لمعرفة ما إذا كانت تحمل علامة الأكسجين أم لا. "باستخدام نفس الجهاز، نستمر في تكسير أجزاء البروتين مرارًا وتكرارًا والتحقق مما إذا كانت تحتوي على الأكسجين المسمى."
يوضح الباحث: "نظرًا لأننا نستخدم مقياسًا كيميائيًا وليس مقياس اختبار فيزيائي، فإننا قادرون على فحص العملية بمزيد من التفصيل". "نحن قادرون على تحديد أي جزء من الهيكل النهائي يتم طيه أولاً، وأي جزء يتم طيه ثانيًا، وهكذا."

تعليقات 2
لقد قرأت للتو مقالة طويلة للبروفيسور دورون أورباخ على موقع "هادوس" وأحزنتني.
إن المعركة من أجل سلامة العقل البشري طويلة وصعبة، ويبدو أننا نخسرها.
نحن بحاجة إلى إنشاء دولة ملحدة على جزيرة ما في المحيط الهادئ وترك الإنسانية لتتدبر أمرها.
أوصي بدورتين ممتازتين في علم الأحياء وأبحاث الدماغ، في الدورة الأولى تم أيضًا شرح موضوع طي البروتين بشكل جيد:
http://www.youtube.com/view_play_list?p=ACC83028E0CBD671
http://www.youtube.com/view_play_list?p=D8C99F67C81778E8