الألياف الشبيهة بالليغو والتي تتشكل بسبب طفرة واحدة في البروتين قد تكون بمثابة سقالة للبنى النانوية

البروتينات الموجودة في أجسامنا هي "مخلوقات" اجتماعية، فهي تتواصل مع بعضها البعض دون توقف. لكن كما هو الحال في العلاقات بين الأشخاص، فإن العلاقات بينهم أيضًا تتقوض من وقت لآخر، وتتشكل علاقات جديدة مكانهم قد تضر بصحتنا. على سبيل المثال، طفرة واحدة فقط في الهيموجلوبين - البروتين الذي يحمل الأكسجين في الدم - تكفي لجزيئات الهيموجلوبين لتلتصق ببعضها البعض، على غرار مكعبات الليغو، وتنتج ألياف طويلة وصلبة. تتسبب هذه الألياف في استطالة خلايا الدم الحمراء، وهو ما يحدث بالضبط في مرض فقر الدم المنجلي.
لأكثر من 50 عامًا، كان مرض فقر الدم المنجلي هو المثال الوحيد المعروف للعلم عن طفرة تسبب تكوين ألياف تشبه الليغو، ولكن الدكتور إيمانويل ليفي وافترض أعضاء مجموعته في قسم البيولوجيا الهيكلية بمعهد وايزمان للعلوم أن هذه الألياف كان يجب أن تظهر بشكل متكرر أثناء التطور. مثلتم الإبلاغ عنها مؤخرًا في المجلة العلمية الطبيعةلقد أظهر الباحثون أنه من السهل جعل البروتينات تنظم نفسها في بنية تشبه لعبة الليغو. قد يكون للنتائج الجديدة آثار على البحوث الطبية الحيوية ودراسة المواد النانوية.
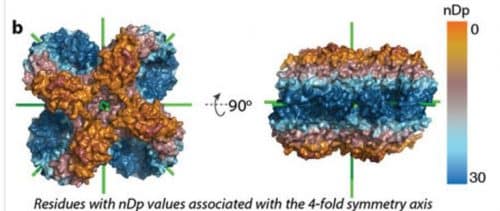
استمد الدكتور ليفي وفريقه إلهامهم للبحث من التماثل الذي يتيح التصاق الهيموجلوبين. يتم إنشاء مجموعات من البروتينات المتماثلة من وحدات متطابقة - حتى إذا قمت بقلبها فإنها ستظل تبدو كما هي، مثل كعكة أوريو قليلاً. وبما أن نفس الجين ينتج وحدات متطابقة، فإن أي طفرة تحدث في الجين تكرر نفسها عدة مرات في كتلة البروتين - وبسبب التماثل، يتم التعبير عنها على كلا الجانبين. إذا تسببت هذه الطفرة في الالتصاق، فستستمر الجزيئات في الالتصاق ببعضها البعض أكثر فأكثر، مما يؤدي إلى إنتاج ألياف أطول فأطول. في هذه العملية، تحتفظ وحدات بناء الركام بشكلها الأصلي - على عكس، على سبيل المثال، ركام الأميلويد الذي يغير شكله في عملية إنتاج "اللويحات" التي تميز مرض الزهايمر.
تؤدي الطفرة التي تسبب الالتصاق إلى تغيير على سطح البروتين: فهي تحل محل الحمض الأميني المحب للماء ("المحب للماء") بحمض أميني كاره للماء ("كاره للماء"). عندما تتحرك جزيئات البروتين في بيئتها المائية، تفضل الأجزاء الكارهة للماء التفاعل مع بعضها البعض.
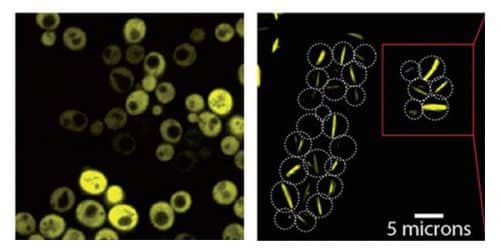
أجرى الدكتور ليفي ومجموعته - الدكتور هيكتور جارسيا سيسادوس والطالب الباحث تشارلي إمبورور-موت مع الدكتور نداف إيلاد من قسم البنى التحتية للبحوث الكيميائية - تجارب لأول مرة على مجموعة بروتينية متناظرة تتكون من ثماني وحدات متطابقة. يوضح الدكتور ليفي: «بهذه الطريقة، مقابل كل طفرة في جين البروتين، تلقينا سبع طفرات إضافية مجانًا في المجموعة التي تم إنشاؤها». تسببت الطفرة بتغيير واحد فقط في البروتين: استبدال حمض أميني محب للماء بحمض أميني "لزج" وكاره للماء. لقد تسببوا في مثل هذه الطفرات في جينات 11 بروتينًا متماثلًا - ما بين طفرة واحدة وثلاثة طفرات في كل جين - وتسببوا في التعبير عن هذه الجينات في خلايا الخميرة مع إضافة بروتين فلوري يسمح بالتتبع. في 30 من أصل 73 نسخة من البروتينات التي تم إنشاؤها في التجربة، لوحظت ظاهرة مشابهة للتجميع الذاتي - إنشاء ألياف تشبه الليغو. يتم تنظيم حوالي نصف هذه البروتينات في ألياف مرتبة، والنصف الآخر يلتصق ببعضه البعض في كتل غير متبلورة. وعندما قام العلماء بتصوير خلايا الخميرة عبر المجهر من أجل مراقبة نموها، رأوا أن مجموعات من الألياف قد تشكلت في هذه الخلايا على طول سطح الخلية بالكامل، من طرف إلى آخر.
لكن السؤال الذي يطرح نفسه: إذا كان العلماء قادرين على إعادة إنتاج ألياف مشابهة بهذه السهولة للألياف المتكونة في فقر الدم المنجلي، فلماذا لم يتم ملاحظة هذه الظاهرة حتى الآن في أبحاث الطب الحيوي؟ هناك إجابتان محتملتان لهذا السؤال: أولا، اكتشف علماء المعهد أن البروتينات المتناظرة طبيعيا تحتوي على العديد من الأحماض الأمينية المحبة للماء على السطح، مما يقلل من خطر التجميع الذاتي. بالإضافة إلى ذلك، يعتقد الدكتور ليفي أن العلماء ربما شاهدوا بالفعل مثل هذه الالتصاقات في الماضي، لكنهم افترضوا أنها كانت بروتينات ذات طيات مضطربة - بدون أهمية بيولوجية. "بعد أن اكتشفنا مدى سهولة تشكيل مثل هذه التركيبات، ربما يبدأ الآن علماء آخرون في التعرف عليها في مواقف مختلفة."
ويوضح الدكتور ليفي أيضًا: "إن ما يميز بحثنا هو بساطته: فنحن لم نستخدم حسابات معقدة ولم نقم بمسح آلاف الطفرات من أجل العثور على الطفرات المناسبة. لقد بدأنا ببنية موجودة واستخدمنا طريقة بسيطة لجعل الألياف تتجمع ذاتيًا. إذا كان من الممكن تحفيز تكوين الألياف في الخميرة بهذه الطريقة البسيطة، فربما يمكن استخدام هذه الألياف كهيكل عظمي للبنى النانوية".

תגובה אחת
هل كمية وأنواع البروتينات متشابهة في جميع الكائنات الحية وأيضا بالنسبة للحمض النووي الذي يشفر في شفرته تجميع البروتينات نفسها وماذا عن النباتات