يجب إزالة البروتينات التالفة والبروتينات التي أنهت دورها في الخلية وتكسيرها، ولكن في الوقت نفسه يجب الحرص على عدم إرسال البروتينات الأساسية عن طريق الخطأ إلى "التقطيع".

يجب إزالة البروتينات التالفة والبروتينات التي أنهت دورها في الخلية وتكسيرها، ولكن في الوقت نفسه يجب الحرص على عدم إرسال البروتينات الأساسية عن طريق الخطأ إلى "التقطيع". وتكشف دراسة جديدة أجراها علماء المعهد، بقيادة الدكتورة ميشال شارون من قسم الكيمياء البيولوجية، عن كيفية عمل إنزيم "الإنقاذ"، الذي يمنع الانهيار غير المرغوب فيه للبروتينات الأساسية. ينقذ هذا الإنزيم، من بين أمور أخرى، البروتينات التي تثبط الأورام السرطانية - مثل p53 وشقيقه الأقل شهرة، p73 - وبالتالي يحمي من السرطان.
يتم تحلل البروتينات التالفة، أو البروتينات التي انتهت وظيفتها، من خلال عملية "بيروقراطية" منظمة ومضبوطة، حيث يتم تمييز البروتينات المرشحة للتحلل بملصق خاص - يوبيكويتين - ونقلها إلى "تحلل" الجناح "، البروتيزوم. بعد التعرف على الملصق - والذي يتم باستخدام وحدة معينة من البروتيزوم - يدخل البروتين إلى وحدة أخرى، تعمل بمثابة "التقطيع"، حيث يتم تقسيمه إلى مكوناته. ومع ذلك، وبصرف النظر عن العملية "البيروقراطية"، التي أدى اكتشافها إلى حصول روز وهيرشكو وتشيكنوفر على جائزة نوبل في الكيمياء لعام 2004، فإن أهمية عملية تحلل أخرى سلبية وأكثر "تلقائية" أصبحت واضحة بشكل متزايد في السنوات الأخيرة. اتضح أن بعض البروتينات - التي تفتقر إلى بنية مطوية ومرتبة، كليًا أو جزئيًا - يمكن أن تجد طريقها إلى آلة التقطيع دون المرور بخطوات وضع العلامات وتحديد الهوية. هذه ليست عملية هامشية: ما يقرب من ثلث البروتينات الموجودة في الخلية تشتمل على أجزاء غير مطوية، بما في ذلك البروتينات المهمة لوظيفة الخلية، والتي تلعب أدوار التحكم ونقل الإشارة. في الواقع، يتم تكسير خمس بروتينات الخلية بهذه الطريقة. ظاهريًا، هذه "مكنسة كهربائية" فعالة تحافظ على النظام والنظافة في المقصورة. ولكن كيف تمنعه من ضخ كل ما يأتي في طريقه؟ إن التحقيق في هذا السؤال معقد - لأن الطريقين، "البيروقراطي" والسلبي، موجودان جنبًا إلى جنب في الخلية.
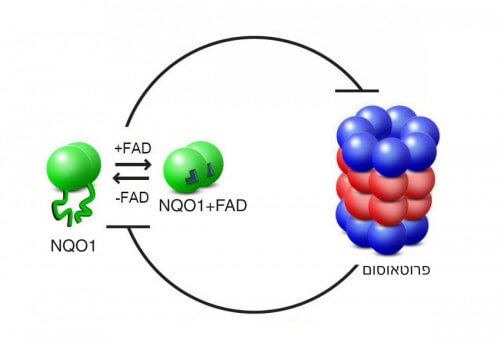
قبل عدة سنوات، اكتشف البروفيسور يوسف شاؤول، رئيس قسم علم الوراثة الجزيئية في المعهد، أول دليل للإجابة: لقد حدد "المنقذ"، الذي يمنع الانهيار غير المرغوب فيه للبروتينات في البروتيزوم. وهو إنزيم يسمى NQO1، الذي يعيش حياة مزدوجة: فهو يحارب مركبات الأكسجين التفاعلية، وبالتالي يحمي الخلية من الإجهاد التأكسدي، وبالإضافة إلى ذلك، فإنه يحمي أيضًا البروتينات الأساسية من التحلل. كيف بالضبط يفعل هذا؟ كان هذا السؤال محور البحث الحالي الذي أجراه أورين موسكوفيتش، ونمرود حزان، وهوديا كيسر، وجيلي بن نيسان، والدكتور يتسحاق ميخاليفسكي من مجموعة الدكتور شارون. وللتحقق بشكل متعمق من التفاعلات بين إنزيم NQO1 والبروتيزوم في مسار التحلل السلبي، أنشأ العلماء نظامًا تجريبيًا اصطناعيًا، أدخلوا فيه الإنزيم ووحدة "التقطيع" للبروتيزوم فقط - دون الوحدة المسؤولة عن التعرف على تسمية يوبيكويتين. هذه هي الطريقة التي تمكنوا من عزل واستكشاف الطريق المطلوب. أما العامل الثالث الذي أضافه العلماء إلى النظام فهو جزيء مشتق من فيتامين ب2 يسمى FAD. إنه ربط جزيئين FAD بالإنزيم المكون من وحدتين من NQO1 مما يسمح له بأداء وظائفه في الخلية.
كشف اختبار إنزيم NQO1 باستخدام طرق قياس الطيف الكتلي أن ارتباط جزيئات FAD يعمل على استقرار بنيته المكانية. عندما اختبر العلماء شكلاً آخر من الإنزيم، حيث يكون موقع الارتباط FAD معيبًا، وعندما أزالوا جزيئات FAD من إنزيم طبيعي، تم إنشاء إنزيم عديم الشكل، غير قادر على الانطواء إلى بنية منظمة. اكتشف لاحقًا أن هذه الإنزيمات عديمة الشكل تتحلل في البروتيزوم، و"تختفي" من النظام التجريبي. ومن ناحية أخرى، عندما أضاف العلماء كميات كبيرة من FAD إلى النظام التجريبي، تمكنوا من إعادة الإنزيمات - الطبيعية والمتحولة - إلى شكلها، وبالتالي حفظها من التحلل.
البحث في خلايا حاييم، الذي تم بالتعاون مع البروفيسور يوسف شاؤول وطالب البحث من مجموعته، بيتار تسافكوف، وسع الصورة. لم يؤد إعطاء فيتامين ب2 إلى الخلايا البشرية إلى زيادة مستوى NQO1 واستقرار بنيته فحسب، بل أدى أيضًا إلى زيادة مستوى p53. وتم الحصول على صورة مماثلة من خلال فحص خلايا سرطان الثدي التي لا تحتوي على الإنزيم بسبب الخلل في ارتباط FAD. كانت إضافة B2 إلى هذه الخلايا قادرة على إنقاذ NQO1، مما سمح له بإنقاذ p53.
تكشف نتائج البحث، التي نُشرت مؤخرًا في المجلة العلمية Molecular Cell، أن التفاعل بين البروتيزوم وNQO1 يعتمد على التثبيط المتبادل: حيث يقوم البروتيزوم بتكسير إنزيمات NQO1 غير المهيكلة، في حين أن الإنزيم "يحجب بجسمه" النشاط المدمر للبروتين. البروتيزوم، وبهذه الطريقة يقي من التدهور ليس فقط نفسه، ولكن أيضًا البروتينات الأخرى. أحد العناصر المهمة في هذه السيطرة المتبادلة هو عامل التغذية الخارجي - فيتامين ب2، الذي يؤثر على بنية الإنزيم، وبالتالي يتحكم في وظيفته. ويعتقد العلماء أنه من الممكن أن الظاهرة التي اكتشفوها، وهي أن العامل الأيضي يؤثر على وظيفة النظام من خلال التأثير على البنية، ليست فريدة من نوعها بالنسبة للطريق الذي درسوه.
إن الطفرة التي تضعف قدرة NQO1 على الارتباط بـ FAD، والتي يبلغ معدل انتشارها بين الأشخاص البيض حوالي 4٪، موجودة في خمس سكان آسيا. وتعني الطفرة أن الخلايا غير قادرة على التعامل بشكل جيد مع الإجهاد التأكسدي، وتحتوي على مستويات منخفضة من p53 وp73، ولهذا السبب فهي عرضة للإصابة بالسرطان - وخاصة سرطان الثدي وسرطان الدم. وتشير نتائج البحث إلى الأهمية الغذائية لفيتامين ب2، خاصة لدى الأشخاص الذين يعانون من الطفرة.
يعتمد التفاعل بين البروتيزوم وNQO1 على التثبيط المتبادل

תגובה אחת
كيف "يعرف" NQO1 كيفية حفظ البروتينات المطلوبة وعدم حفظ البروتينات التي حان وقتها؟ شكرا.