لقد تبين أن الحمض النووي الريبوزي (RNA)، الذي ظل لفترة طويلة مجرد جزيء مسؤول عن تنظيم شؤون الخلية، يمثل طفرة في عالم جديد من العلاج الطبي
منذ اكتشاف البنية المزدوجة للحمض النووي في عام 1953، اتسمت البيولوجيا الجزيئية بعدد مشاركين أكبر من أبطال الرواية الروسية. وقد حدد علماء الأحياء عشرات الآلاف من الجزيئات التي توجه وتشكل الفوضى المنظمة التي تسود خلايا الجسم، واستخلصوا آلاف الأدوية والعلاجات من هذه النتائج.
لعقود من الزمن، كان نجوم الدراما يأتون من معسكرين: الحمض النووي، أو الحمض النووي الريبي منقوص الأكسجين، الذي يعمل بمثابة مستودع للمعلومات الجينية التي بالكاد تتغير مع مرور الوقت، والبروتينات، التي تقوم بعمل الجينات. وقد أدت الأبحاث على البروتينات إلى اختراقات طبية، مثل الأنسولين الاصطناعي والإنترفيرون وجيل جديد من الأدوية المضادة للسرطان، كما أن العلاج الجيني الذي يستخدم شرائح الحمض النووي المعدلة يمهد الطريق لتطوير علاجات للهيموفيليا والعمى الوراثي وأمراض أخرى لم يكن هناك حل في السابق [انظر: الفصل الثاني من الشفاء الجيني، ريكي لويس، مجلة ساينتفيك أمريكان إسرائيل، يونيو-يوليو 2014].
ومع ذلك، في مسيرة التقدم الطبي، تم نسيان نوع ثالث من الجزيئات البيولوجية: الحمض النووي الريبوزي (RNA)، أو الحمض النووي الريبوزي، الذي يحتوي، مثل شقيقته الأكثر شهرة، على معلومات وراثية ولكن استقراره الكيميائي أقل. وبالتالي، غالبًا ما تقوم الإنزيمات بتفكيكه في البيئة الكيميائية المضطربة للخلية.
ورغم أن العلماء عرفوا منذ زمن طويل أن الحمض النووي الريبوزي يشارك عند نقطة معينة في كل عملية خلوية تقريبا، إلا أنهم نسبوا إليه دورا ثانويا في صورة الحمض النووي والبروتينات. في الخمسينيات والستينيات من القرن العشرين، اعتقد علماء الأحياء أن الحمض النووي الريبي (RNA) كان نوعًا من ابنة الزوجة التي تنقل الرسائل، وتنسق الإمدادات، وتحافظ بشكل عام على ترتيب الخلايا. تم الحفاظ على هذه الصورة لعدة أجيال.
ومع ذلك، كان كل هذا قبل أن يتلقى جزيء الحمض النووي الريبوزي (RNA) تحولًا في الصورة حدث مثل العصا السحرية. كشفت سلسلة من الاكتشافات في أواخر القرن العشرين عن أشكال جديدة من الحمض النووي الريبوزي (RNA) لم تكن مدبرة منزل متواضعة على الإطلاق. بل عرفت جزيئات الحمض النووي الريبوزي (RNA) كيفية تنظيم سلوك جزيئات الحمض النووي والبروتينات وتسبب زيادة أو إبطاء عمل جزيئات معينة. وباستخدام جزيئات الحمض النووي الريبوزي (RNA) هذه، يمكن للعلماء محاولة تطوير علاجات جديدة للسرطان والأمراض المعدية ومجموعة واسعة من الأمراض المزمنة.
وفي العقد الماضي، سارع العلماء إلى تحقيق الاكتشافات الجديدة. لقد زادت وتيرة الاكتشافات، وتم إنشاء العشرات من الشركات الناشئة التي تهدف إلى الاستفادة من النتائج، والآن تلوح في الأفق أيضًا بعض العلاجات الواعدة.
وفي الوقت نفسه، زادت الفائدة الاقتصادية من تدفق ضئيل إلى تدفق استثمارات بمليارات الدولارات. وتشمل المعاملات الأخيرة إطلاق شركة Editas Medicine في نهاية عام 2013، والتي حصلت على 43 مليون دولار من رأس المال الاستثماري. تركز الشركة جهودها على تقنية RNA "الساخنة" والمتطورة، والمعروفة باسم CRISPR. تلقت شركة أقدم، وهي شركة النيلان للأدوية، والتي تأسست في عام 2002، 700 مليون دولار في يناير 2014 لتطوير، من بين أمور أخرى، مجموعة من أدوية الحمض النووي الريبوزي (RNA) لعلاج الحالات القاتلة في نظام الدم وأمراض الكبد واضطرابات الجهاز المناعي.
ويأتي التمويل على شكل "موجات"، كما يقول روبرت ماكلاود، نائب رئيس قسم الأورام والأبحاث في شركة الأدوية "إيزيس"، التي جمعت ما يقرب من 3.8 مليار دولار منذ تأسيسها في عام 1989. وقد تمت الموافقة على منتجها الرائد، كينامرو، من قبل إدارة الغذاء والدواء الأمريكية (FDA) في عام 2013 كدواء الحمض النووي الريبوزي (RNA) للأشخاص الذين يعانون من اضطراب وراثي نادر يعطل بشكل كبير قدرتهم على معالجة الكوليسترول ويعرضهم بشكل خاص لخطر الإصابة بالمرض. نوبة قلبية أو سكتة دماغية.
كما هو الحال في أي مجال سريع التطور، كانت هناك بعض العقبات والتحويلات على طول الطريق، ولن يصمد كل اكتشاف أمام اختبار الزمن. ومع ذلك فإن الباحثين يشعرون بالدوار من الإثارة. إنهم يشعرون كما لو أنهم اكتشفوا قارة جديدة وسيستكشفونها بحثًا عن اختراقات محتملة.
الدور المساعد
من السهل أن نفهم لماذا نسب علماء الأحياء الجزيئية أدوار النجوم إلى الحمض النووي والبروتينات وليس إلى الحمض النووي الريبي (RNA). تشكل اللبنات الأساسية للحمض النووي - الأدينين والثايمين والسيتوزين والجوانين، أو A وT وC وG - كتاب التعليمات الأساسي لكل كائن حي تقريبًا في عالمنا. وإحدى أهم العمليات التي يديرها الحمض النووي (باستخدام الكود) هي تكوين البروتينات.
البروتينات بدورها تشكل البنية ثلاثية الأبعاد للخلايا وتسمح لها بالقيام بمعظم وظائفها: فهي توفر نضارة الجلد ومظهره الشبابي وقوة القلب مع مرور الوقت. كما يقومون أيضًا بتشغيل وإيقاف الحمض النووي استجابةً للإشارات الواردة من البيئة، وتحديد أفضل طريقة لاستخدام السكر في الخلايا وتنظيم قدرة الخلايا العصبية على نقل الرسائل إلى بعضها البعض في الدماغ. تؤثر الغالبية العظمى من الأدوية اليوم، من الأسبرين إلى زولوفت، على البروتينات، إما عن طريق منع نشاطها أو عن طريق تغيير الكمية التي تتشكل فيها.
حقيقة أن معظم الأدوية تؤثر على نشاط البروتينات لا تعني بالضرورة أن الباحثين يستطيعون تطوير دواء لكل بروتين مستهدف. الأدوية الأكثر شيوعًا هي جزيئات صغيرة يمكنها البقاء على قيد الحياة عند تناولها ومرورها عبر المعدة الحمضية. عند امتصاصها من الجهاز الهضمي، يجب أن تتناسب مع المواقع النشطة للبروتينات المستهدفة مثل المفتاح الذي يتناسب مع القفل. ومع ذلك، هناك مجموعات معينة من البروتينات لا يناسبها هذا النهج التقليدي: تلك التي تخفي موقعها النشط عميقًا داخل قنوات ضيقة أو تلك التي ليس لها موقع نشط لأنها جزء من الهيكل العظمي الداخلي للخلايا وبالتالي فهي لا "تستجيب للعلاج من تعاطي المخدرات"، وفقا لماكليود.
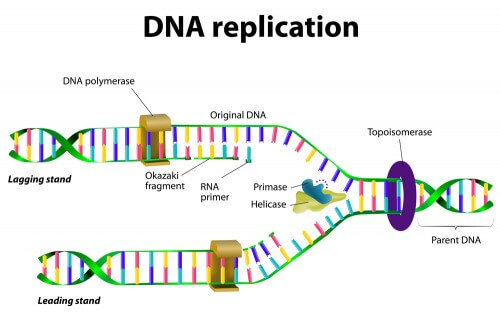
تم تصميم أدوية الحمض النووي الريبوزي الجديدة للتغلب على هذا الحاجز الذي لم يكن من الواضح حتى وقت قريب كيفية التغلب عليه. لقد عرف علماء الأحياء منذ فترة طويلة أن الحمض النووي الريبي (RNA) يعمل كوسيط كفؤ ينسخ أو يعيد إنتاج تعليمات الحمض النووي في تسلسل تكميلي (يطابق C إلى G، على سبيل المثال) ثم يترجم الكود إلى بروتينات ثلاثية الأبعاد. يتم إنشاء هذا النوع من الحمض النووي الريبي (RNA)، المعروف باسم messenger RNA (mRNA)، في النواة ويهاجر إلى السيتوبلازم، حيث تقوم هياكل تسمى الريبوسومات، بالتعاون مع نوع آخر من الحمض النووي الريبي (RNA)، بنقل الحمض النووي الريبي (tRNA)، وقراءة الرسالة وتوصيل الأحماض الأمينية. (مركبات تحتوي على النيتروجين) إلى سلاسل طويلة تصبح بروتينات. ولكن يمكن للحمض النووي الريبوزي أن يفعل أكثر من ذلك بكثير.
ولادة نجم
تم تمهيد الطريق لاختراق الحمض النووي الريبوزي (RNA) في عام 1993 من خلال تحديد أول جزيئات microRNA (تم منح العلماء الذين فعلوا ذلك جائزة وولف للطب في يونيو 2014 في كنيست مشكان في القدس - المحررون). MicroRNAs عبارة عن قطع RNA قصيرة بشكل غير نمطي ترتبط بخيوط RNA المرسال وتمنع الريبوسومات من التقدم في تجميع البروتين [انظر الإطار في الصفحة التالية]. ومن الواضح أن الخلايا تستخدم جزيئات microRNA لتنسيق الجداول الزمنية لإنتاج العديد من البروتينات، خاصة في المراحل الأولى من تطور الكائن الحي. وبعد خمس سنوات، توصل الباحثون إلى إنجاز آخر عندما أظهروا أن جزيئات الحمض النووي الريبوزي (RNA) القصيرة المختلفة تعمل بشكل فعال على إسكات ترجمة الجينات إلى بروتينات عن طريق قطع الحمض النووي الريبي المرسال. وهذا الاكتشاف، الذي كان علامة فارقة، حصل على جائزة نوبل عام 2006.
في ذلك الوقت بدا أن الجميع، وليس فقط خبراء الحمض النووي الريبوزي (RNA)، كانوا مهتمين باستخدام هذا الجزيء، الذي تم تجاهله ذات يوم، للتأثير على طريقة تكوين البروتينات. تسمى عملية قطع الحمض النووي الريبي المرسال بواسطة شرائح RNA قصيرة بتداخل الحمض النووي الريبي (RNAi) وتسمى جزيئات الحمض النووي الريبي النشطة في هذه العملية بالحمض النووي الريبي المتداخل القصير (siRNA). كما أدركت مجموعة واسعة من العلماء أنهم يستطيعون حل مشكلة البروتينات التي لا تستجيب للعلاج الدوائي من خلال تطوير تركيز النشاط من المنتج النهائي، وهو البروتين، إلى المرحلة التي يشارك فيها الحمض النووي الريبوزي (RNA) في سلسلة العمليات إنتاج البروتينات.
أكثر من 200 دراسة تجريبية تتعامل مع microRNA أو siRNA مسجلة حاليًا في قاعدة بيانات الحكومة الأمريكية للتجارب السريرية وتهدف إلى تشخيص وعلاج كل شيء تقريبًا، بدءًا من مرض التوحد وحتى سرطان الجلد. ومن الوعود التي يقطعونها: علاج المصابين بفيروس إيبولا، الذي يسبب مرضًا مميتًا للغاية، والذي يخشى خبراء الإرهاب من إمكانية استخدامه كسلاح بيولوجي، وفيروس التهاب الكبد الوبائي سي، الذي يسبب التهاب الكبد المزمن لحوالي 150 مليون شخص حول العالم. وهو السبب الرئيسي لسرطان الكبد [انظر الإطار الموجود على اليسار والمربع الموجود على الجانب الآخر من الصفحة].
ماذا في المستقبل؟
بينما تتقدم الأدوية التي تحتوي على microRNA أو siRNA في السباق إلى العيادات، فإن جيلًا جديدًا من النجمات ينتظر الآن التمرين. يجب أن تعمل هذه الأدوية المستقبلية حتى في وقت مبكر من سلسلة العمليات، على جزيء الحمض النووي نفسه. ويعتمد أحد هذه الأساليب على تسلسلات كريسبر الموجودة في البكتيريا، وقد أطلق عليها بحماس اسم "جنون كريسبر" في مجلة العلوم العلمية. وهناك نهج آخر، يعتمد على جزيئات طويلة من الحمض النووي الريبوزي غير المشفر (lncRNA)، لا يزال يثير الشكوك حول فائدته.
تسلسلات كريسبر هي تسلسلات غريبة من أجزاء الحمض النووي المتكررة الموجودة في البكتيريا والكائنات الحية الشبيهة بالبكتيريا. وتتفاعل هذه التسلسلات مع مجموعة من البروتينات المرتبطة بهذه التسلسلات والمعروفة باسم Cas. تعمل تسلسلات كريسبر وبروتينات كاس المختلفة على إنشاء نظام دفاع بكتيري ضد الفيروسات.
ولهذه البروتينات وظيفة واحدة: قطع الحمض النووي للفيروس إلى نصفين وتدميره. تقوم الخيوط التكميلية من الحمض النووي الريبي (RNA) بتوجيه البروتينات إلى هدفها: أجزاء معينة من الحمض النووي الفيروسي. ولكن من أين يأتي هذا الحمض النووي الريبي (RNA)؟ مثل نسخة مجهرية من رياضة الجوجيتسو، تأخذ الخلايا الحمض النووي الريبي (RNA) من الفيروسات الغازية وتصنع منه عاملًا مزدوجًا يوجه بروتينات Cas إلى المكان المحدد حيث من المفترض أن يتم قطعها.
على الرغم من اكتشاف عناصر كريسبر لأول مرة في عام 1987 في البكتيريا، إلا أن العلماء لم يبدأوا في اعتماد هذا النظام على مجموعة واسعة من الأنسجة الحيوانية، بما في ذلك البشر، إلا في عام 2012. إن إنشاء دليل RNA في المختبر يسمح للباحثين بتوجيه بروتينات Cas بدقة مثالية إلى الموقع المطلوب في النواة لقطع جزيئات الحمض النووي. في الواقع، لقد حولوا آلية الدفاع البكتيرية إلى أداة دقيقة لتحرير الجينات.
مثل هذه التكنولوجيا الدقيقة يمكن أن تحدث ثورة في العلاج الجيني، وقد يحدث هذا في وقت أقرب مما نعتقد.
اليوم، لا يستطيع الباحثون الطبيون إلا حقن الحمض النووي التصحيحي بشكل عشوائي في المرضى الذين يعانون من جينات معيبة على أمل أن تجد بعض المواد الوراثية طريقها على الأقل وتبدأ في العمل في المكان الصحيح. التطوير الكامل لتقنية CRISPR/Cas يمكن أن يغير الوضع ويسمح للباحثين باختيار مكان تغيير الحمض النووي للمريض بدقة. يقول جورج إم تشيرش، أستاذ علم الوراثة في كلية الطب بجامعة هارفارد، والمؤسس المشارك لـ Editas والمستشار العلمي لمجلة Scientific American: "في وقت مبكر من عام 2015، من المفترض أن نرى بعض التجارب باستخدام طريقة كريسبر". ويضيف: "الطريقة تأتي في الواقع جاهزة". "يمكنك أخذها من البكتيريا دون الحاجة إلى إجراء تغييرات تقريبًا. وتقريبًا أي دليل RNA نريده سيصل إلى الموقع الذي يعمل فيه. إنه سريع ويسمح بتغييرات دائمة في الحمض النووي."
وتأمل تشرش أن تنتقل شركة إيديتاس إلى التجارب السريرية مباشرة بعد الانتهاء من الدراسة على الحيوانات. وقد تم مؤخرًا إنشاء شركات أخرى تتمحور حول تقنية كريسبر، بما في ذلك شركة Caribou Biosciences وشركة Egenesis.
الاكتشاف الأكثر إثارة للجدل بين الاكتشافات الحديثة في مجال الحمض النووي الريبوزي (RNA) يرتبط بـ lncRNA. تأتي تسلسلات الحمض النووي الريبوزي الطويلة هذه، التي تم وصفها لأول مرة في عام 2002، من النواة وتبدو للوهلة الأولى مثل الحمض النووي الريبي المرسال، لكنها تفتقر إلى تسلسل الحروف اللازمة لبدء عملية الترجمة.
لماذا تحتاج الخلية إلى كل هذا الـ RNA الزائد؟ لا شك أن جزءًا من هذا الحمض النووي الريبي (RNA) قد تم إنشاؤه من تكاثر الإصدارات المبكرة من الجينات التي انهارت مع مرور الوقت ولم تعد تعمل. (أحد الاكتشافات الأكثر إثارة للدهشة للثورة الوراثية هو أن كل الحمض النووي الموجود في النواة تقريبًا يتم نسخه، وليس فقط الأجزاء التي ترمز للبروتينات). ومن المحتمل أن تكون أجزاء أخرى من الحمض النووي الريبوزي دليلاً على هجمات من الماضي البعيد من قبل أنواع معينة من الحمض النووي الريبوزي. الفيروسات التي يمكنها دمج مادتها الوراثية في الحمض النووي للخلية لنقلها إلى الأجيال القادمة.
ولكن ماذا لو كان جزء من lncRNA يمثل طريقة لتنظيم الجينات لم تكن معروفة من قبل، طريقة لا تتطلب طفرات خطيرة في الحمض النووي ولا تعتمد على البروتينات كلاعبين رئيسيين؟ يقول جون رين، الباحث في الحمض النووي الريبي في جامعة هارفارد، إن الحمض النووي مطوي مثل الأوريجامي. يمكنك صنع طائرة أو رافعة من قطعتين متطابقتين من الورق، ومن الممكن أن يكون للـ lncRNA دور ما في الحفاظ على الحمض النووي مطويًا بالترتيب الصحيح. وكما يمكن لخطأ في الأوريجامي أن يخلق طائرًا ورقيًا بلا أجنحة، كذلك، على سبيل المثال، قد يسبب الـ lncRNA الزائد السرطان حتى لو لم تكن هناك طفرة في جينات الخلية.
الاحتمال الآخر الذي تتم دراسته هو أن جزيئات lncRNA يمكنها ربط نفسها بأجزاء مختلفة من جزيئات الحمض النووي، وتغيير بنيتها ثلاثية الأبعاد وتعريضها للنشاط أو إخفائها.
العديد من الأنواع الأخرى من جزيئات الحمض النووي الريبي غير المشفرة قد تكون بمثابة منظمات جينية مهمة، أو بدلاً من ذلك قد تكون أشباحًا وراثية. إحدى الصعوبات في دراسة جزيئات الحمض النووي الريبي (RNA) غير المشفرة هي أنها لا تنتج بروتينات، لذلك من الصعب إثبات أنها تقوم بشيء مهم. يقول جون ماتيك، كبير الباحثين في جزيئات الحمض النووي الريبي غير المشفرة ومدير المعهد الأخضر للأبحاث الطبية في أستراليا: "أعتقد أن الوقت مبكر جدًا، وهذه مجرد البداية". "لقد تم الكشف عن عالم جديد تمامًا هنا."
عندما ينظر المرء إلى مجموعة واسعة من مركبات الحمض النووي الريبي (RNA) التي تم تصميمها واختبارها، يبدو أن الميزة الأكثر جاذبية لهذه الجزيئات هي بساطتها. وخلافاً للبروتينات، التي يجب توصيف بنيتها الثلاثية الأبعاد بدقة من أجل تطوير أدوية فعالة، فإن الحمض النووي الريبي (RNA) يتكون بشكل أساسي من تسلسل ثنائي الأبعاد (إذا تجاهلنا في الوقت الحالي بعض الأشكال ثلاثية الأبعاد التي يمكن لجزيئات الحمض النووي الريبي أن تخلقها). يقول ماكليود: "إنها تحول مشكلة ثلاثية الأبعاد، حيث يجب على جزيء صغير أن يتناسب بدقة حيوية مع موقع على بروتين مثل مفتاح القفل، إلى مشكلة خطية ثنائية الأبعاد". بفضل مشروع الجينوم البشري، أصبح الباحثون يعرفون بالفعل معظم التسلسلات المهمة في الجينوم. كل ما عليهم فعله هو تصنيع خيط الحمض النووي الريبوزي (RNA) التكميلي، ومن ثم ضمان الوصول إلى الهدف.
وبطبيعة الحال، لا تزال هناك حاجة إلى بذل الجهود لوضع الخطة موضع التنفيذ، ولكن في الوقت الحالي على الأقل يعمل طاقم العمل السحري.
______________________________________________________________________________
باختصار
ثلاثة من أهم الجزيئات المعقدة في الكائنات الحية هي DNA و RNA والبروتينات. لعقود من الزمن، أرجع علماء الأحياء النشاط الأكثر أهمية في الخلية إلى الحمض النووي والبروتينات؛ كان الحمض النووي الريبوزي (RNA) مهمًا بالتأكيد ولكنه كان يعتبر مزودًا لخدمات الدعم.
كشفت سلسلة من الاكتشافات في نهاية القرن العشرين عن عدة أشكال من الحمض النووي الريبوزي (RNA) لها وظائف تنظيمية نشطة في الخلايا: فهي تحدد البروتينات التي سيتم إنتاجها وبأي كمية، بل وتسكت بعض الجينات.
وتسمح هذه الأفكار الجديدة للعلماء بخلق عالم جديد من الأدوية التجريبية ضد البكتيريا والفيروسات والسرطان والأمراض المزمنة المختلفة والتي ستكون أكثر دقة وفعالية من الأدوية المتوفرة اليوم.
جرعة جديدة ضد التهاب الكبد الوبائي سي / كريستين جورمان
يعد MicroRNA الموجود في خلايا الكبد هدفًا لدواء قد يحيد عدوًا قاتلًا وصامتًا
قبل 25 عامًا لم يكن أحد يسمع عن فيروس التهاب الكبد الوبائي سي، أما اليوم فهو السبب الرئيسي لسرطان الكبد وسبب رئيسي لعمليات زراعة الكبد. ويقتل الفيروس نحو 350,000 ألف شخص سنويا في العالم. في الولايات المتحدة، يموت عدد أكبر من الأشخاص بسبب التهاب الكبد C مقارنة بالإيدز.
يمكن علاج العدوى، لكن العلاج يكون مصحوبًا بآثار جانبية منهكة. ويسبب العلاج التقليدي بالإنترفيرون والريبافيرين الحمى والصداع والإرهاق والاكتئاب وفقر الدم. يمكن أن يستمر هذا العلاج لمدة تصل إلى 11 شهرًا ويقضي على العدوى لدى 50% إلى 70% من المرضى. ومؤخرًا، عندما بدأوا أيضًا في استخدام مثبطات الأنزيم البروتيني، وهو نوع من الأدوية تم استخدامه لأول مرة ضد فيروس نقص المناعة البشرية، تحسن معدل الشفاء وانخفض وقت العلاج. ولسوء الحظ، فإن الأدوية الجديدة تعمل فقط ضد سلالة التهاب الكبد C الشائعة في أمريكا الشمالية وأوروبا واليابان، وليست فعالة بنفس القدر في بقية أنحاء العالم.
أدوية الحمض النووي الريبوزي قد تحسن الوضع. في عام 2013، أظهر الباحثون أن عقارًا تجريبيًا يُدعى ميرافيرسن، والذي يعمل على جزيئات الحمض النووي الريبي الميكروي (microRNA) في خلايا الكبد، قلل بشكل كبير من كمية فيروس التهاب الكبد C لدى معظم المرضى الذين تلقوا العلاج، وفي بعضهم حتى أقل من عتبة التشخيص. يتكون الدواء التجريبي من تسلسل قصير من الحمض النووي الذي تكمل "حروفه" بدقة تسلسل الحروف الموجودة في microRNA، مما يمكّن الدواء من استهداف الهدف بدقة.
يلعب هذا microRNA، المعروف باسم miR-122، دورًا في إنتاج العديد من البروتينات في الكبد. ولكن على عكس معظم جزيئات microRNA، يبدو أنه لا يمنع إنتاج البروتينات بل يسرعها. عندما يتمكن فيروس التهاب الكبد C من دخول الخلية، فإنه يربط نفسه بـ miR-122 لضمان إنشاء العديد من نسخ الفيروس. يؤدي حظر miR-122 أيضًا إلى حظر ثقافة الفيروس.
التأثير الجانبي الرئيسي هو الاحمرار في موقع الحقن، والذي يختفي في النهاية. وبما أن العلاج موجه ضد هدف موجود في الخلايا المضيفة وليس ضد أحد بروتينات الفيروس (مثل مثبطات الأنزيم البروتيني)، فيجب أن يكون العلاج فعالاً ضد جميع سلالات التهاب الكبد C.
على الرغم من أن التجربة صُممت لتدوم أربعة أسابيع فقط (عادت العدوى في نهاية المطاف إلى جميع المرضى الذين عولجوا)، إلا أن هناك سببًا للاعتقاد بأن العلاج الأطول باستخدام ميرفيرسن سيكون أكثر فعالية. يقول هاري إل إيه جنسن، كبير العلماء في معهد الأبحاث العامة في تورونتو والمؤلف المشارك لهذه الدراسة التي نشرت في مجلة "التفكير هو أنه إذا قمنا بحجب مزرعة الفيروس لأطول فترة ضرورية، فسيكون من الممكن علاج المرض". صحيفة الطب الانكليزية الجديدة.. تستمر التجارب.
كريستين جورمان تكتب عن الصحة والطب.
دحر إرهابيي الطبيعة / فريس جابر
يمكن للعلاج المعتمد على الحمض النووي الريبوزي (RNA) أن يوقف فيروس الإيبولا
يعتقد الأشخاص الذين يصابون بفيروس الإيبولا في البداية أنهم مصابون بالأنفلونزا: الحمى والقشعريرة وآلام العضلات. ثم يبدأ النزيف. عندما يهاجم الفيروس الخلايا في جميع أنحاء الجسم لتكرار نفسه، فإنه يسيطر ويسبب تلف الكبد والرئتين والطحال والأوعية الدموية. وفي غضون أيام تفشل الأعضاء ويدخل المرضى في غيبوبة. وقد أدت بعض الفاشيات، خاصة في وسط وغرب أفريقيا، إلى مقتل ما يصل إلى 90% من المصابين.
وقد يتغير هذا الاحتمال الخطير. قام توماس دبليو جيزبيرج، الذي يعمل الآن في الفرع الطبي بجامعة تكساس في جالفستون، والعديد من المتعاونين بمعالجة ستة قرود، أصيبت سابقًا بالفيروس، باستخدام جزيئات الحمض النووي الريبي المتداخل القصير (siRNA)) وأنقذوا حياتهم. في يناير 2014، تم الإبلاغ عن نجاح العلاج في أول اختبار للسلامة على متطوع بشري سليم. وقد تلقى أحد زملاء جيسبيرج، جان ماكليلان، وفريقه من شركة الأدوية تاكميرا في برنابي، كولومبيا البريطانية، منحة بقيمة 140 مليون دولار من وزارة الدفاع الأمريكية لمواصلة تطوير العلاج.
معًا، قام العلماء بتصميم siRNA من شأنه أن يمنع فيروس الإيبولا من إنتاج بروتين معين والذي بدونه لا يستطيع تكرار نفسه. يقول جيزبيرج: "إذا قمت بإزالة هذا البروتين، فمن الناحية النظرية فإنك تقضي على كل شيء". ويقوم الباحثون بتصميم siRNA آخر لإحباط إنتاج بروتين ثان يستخدمه الفيروس لإضعاف جهاز المناعة لدى المصابين. لا يوجد خطر من أن يتداخل سيرنا مع النشاط الخلوي الطبيعي لأن البروتين المستهدف الفيروسي غير موجود في خلايا البشر أو الحيوانات الأخرى على الإطلاق.
قام ماكليلان وزملاؤه بتغليف سيرنا في فقاعات من الدهون التي يمكن أن تمر بسهولة عبر أغشية الخلايا. وقاموا بحقن الدواء في بعض قرود المكاك الريسوسي التي أصيبت بفيروس الإيبولا قبل أقل من ساعة. وفي إحدى التجارب، نجا اثنان من كل ثلاثة قرود، تلقوا أربع جرعات علاجية، في الأسبوع التالي للتعرض للفيروس. وفي تجربة ثانية، مصممة لاختبار فعالية جرعة أكبر، نجت جميع القرود الأربعة التي تلقت سبع حقن من siRNA. وأظهرت الاختبارات أن جزيئات الفيروس في دم القرود المعالجة كانت أقل بكثير من تلك الموجودة في الحيوانات المصابة غير المعالجة. اجتازت قرود المكاك حقنة siRNA بأمان، وظلت القرود التي نجت بصحة جيدة حتى بعد مرور 30 يومًا.
يقول جيري كوفنجر من جامعة مانيتوبا، الذي يعمل على تطوير علاج آخر للإيبولا يعتمد على الأجسام المضادة، إن الدراسة كانت "علامة فارقة". وهو يعتقد أن جيسبيرج وفريقه "يقودون الجهود نحو التطوير السريري".
باريس جابر وهو محرر مشارك في مجلة ساينتفيك أمريكان.
المزيد عن هذا الموضوع
RNAs الصامتة الصغيرة: الكون المتوسع. ميغا غيلديال وفيليب د. زامور في مراجعات الطبيعة علم الوراثة، المجلد. 10، ص. 94-108، فبراير 2009.
http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2724769/
تطوير علاجات MicroRNA. إيفا فان رويج وآخرون. في أبحاث الدورة الدموية، المجلد. 110، لا. 3، ص. 496-507، 3 فبراير 2012. http://circres.ahajournals.org/content/110/3/496.long
التحكم في التعبير الجيني بواسطة نظام كريسبر-كاس. ديفيد بيركارد ولوتشيانو أ.مارافيني تقارير F1000 برايم، المجلد. 5، المادة رقم. 47؛ 1، نوفمبر، 2013.

تعليقات 5
اليوم، نوفمبر 2020، أفهم أكثر ما كتبه بوينت أعلاه
معجزات,
عندما تسألني "ما هو العمل الذي يجب أن يقوم به أي شخص للسيطرة على الآخرين"، ما نوع الإجابة التي تتوقعها؟ بعد كل شيء، أنا لست الشخص الذي سوف يدمر براءتك.
نقطة
لا أستطيع فهم عمق تفكيرك حقًا. مكتوب في التعليق أن أحد الدوافع الرئيسية هو المال.
ومن أين تستنتج من هذا الرغبة في السيطرة على الناس؟ ما هي مصلحة أي شخص في السيطرة على الآخرين؟ لكسب المال؟ لقد قلنا ذلك بالفعل، أليس كذلك؟ ماذا تفعل مرة أخرى؟ حتى كراهيتك للإنسانية ليست جديدة علينا..
ولا يخطئن أحد، فإن ما يدفع إلى كل هذا ليس حب الإنسانية أو حب المعرفة. ونحن هنا نتحدث عن العوامل التي تريد السيطرة على تعداد البشر والاستعانة بالعلم والعلماء لتحقيق ذلك.
"وإحدى أهم العمليات التي يديرها الحمض النووي (باستخدام الكود) هي تكوين البروتينات." دانا لا تدير أي شيء. إنه رابط في العملية البيولوجية.