تشبه الخلايا الجذعية ينبوع الشباب، فهي إكسير الحياة الذي سيصلح يومًا ما عضلة القلب المتعبة والمتضررة، أو يضع حدًا لمرض تنكسي. ولكن الواقع لا يزال بعيدا عن التوقعات. إن الدراسة التي أجراها مؤخراً البروفيسور ديفيد جافول وشركاؤه الباحثون من قسم البيولوجيا الجزيئية للخلية في معهد وايزمان للعلوم قد تقدم في المستقبل حلاً لبعض المشاكل المرتبطة بالاستخدام الطبي من الخلايا الجذعية.

يتم إجراء العديد من الدراسات على الخلايا الجذعية في الخلايا الجذعية الجنينية، وهي الخلايا الأولية للجنين النامي. الخلايا الجذعية الجنينية قادرة على التمايز في أي اتجاه وتصبح أي نوع من الخلايا في الجسم. وبفضل هذه الميزة الفريدة، فهي لا تعتبر أداة بحث مثالية فحسب، بل تعتبر أيضًا -على الأقل من الناحية النظرية- دواءً مثاليًا، قد يشكل الأساس لعلاج قائمة طويلة من الأمراض، خاصة تلك المتعلقة بالشيخوخة.
وتنكس الخلايا. والمشكلة هي أن المصدر الوحيد لهذه الخلايا هو الأجنة البشرية، مما يضع قيودا أخلاقية على استخدامها.
في عام 2006، اقترح العالم الياباني شينيا ياماناكا طريقة لحل المشكلة، مما أثار ضجة في عالم العلوم: فقد أظهرت أبحاثه أنه من الممكن "إعادة برمجة" خلايا الجلد الناضجة، بحيث تصبح خلايا شبيهة بالخلايا الجذعية الجنينية. . هذه الخلايا ليست متطابقة تمامًا مع الخلايا الجذعية الجنينية، ولكنها تتمتع بالقدرة على التمايز إلى أي نوع من الخلايا. كانت عملية "إعادة برمجة" الخلايا بسيطة بشكل مدهش: فقد تبين أنه يكفي إدخال أربعة جينات في الحمض النووي لخلية الجلد لإعادة عقارب الساعة إلى الوراء، وتغيير الخلايا التي تم تحديد مصيرها منذ زمن طويل. تمت تسمية الخلايا الجديدة باسم iPS (الجذع المستحث متعدد القدرات.

يقول البروفيسور جافول: "إن أهمية هذا الاكتشاف لم تكن فقط في تطبيقاته الطبية الحيوية المستقبلية المحتملة، ولكن أيضًا في حقيقة أنه قلب الافتراض القديم القائل بأن تمايز الخلايا هو عملية أحادية الاتجاه لا يمكن عكسها أبدًا. "
في الواقع، على الرغم من أن خلايانا عادة ما تكون "مقفلة" في مسار مغلق، إلا أن خلايا جميع أنسجتنا - من العضلات إلى الجلد - تحتوي في الواقع على جميع الأدوات الجينية اللازمة لتكوين جميع أنواع الخلايا. ومن أجل إعادة برمجتها، نحتاج، بمعنى ما، إلى معرفة كيفية تنشيط جينات معينة وإيقاف نشاط جينات أخرى، وبالتالي العودة إلى حالة الخلية الجذعية الجنينية. وتبين أن الجينات الأربعة اللازمة لإعادة البرمجة تنتمي إلى مجموعة صغيرة من الجينات التي تنشط جينات أخرى في الخلايا الجذعية الجنينية. بعد تمايز الخلايا، يتم "إسكات" هذه الجينات.
وعلى الرغم من هذا التقدم، لا يمكن استخدام خلايا iPS الجديدة كجهاز طبي. والمشكلة هي أن الجينات الأربعة التي تم إدخالها فيها بغرض إعادة البرمجة تظل في مكانها داخل الحمض النووي، وتستمر في العمل -وتنشيط جينات إضافية- حتى في المرحلة التي من المفترض أن يتم إسكاتها. مثل هذا النشاط قد يسبب عمليات سرطانية وطفرات ضارة. ويقول البروفيسور جافول: "في الواقع، فإن أي إدخال للحمض النووي في الجينوم أمر خطير، وقد يؤدي إلى نتائج غير متوقعة".

لهذا السبب، منذ إنشاء أول خلايا iPS، يبحث العديد من العلماء عن طريقة لتجنب المخاطر. ومن بين أمور أخرى، تم اقتراح طرق معقدة لإزالة قطع الحمض النووي بعد الانتهاء من عملها. وفي نهج آخر، يتم استبدال إدخال الجينات بالإدراج المباشر لمنتجات الجينات - البروتينات. لكن كلا النهجين لا يزالان يمثلان مشكلة. اختار البروفيسور جافول وزملاؤه الدكتور إدوارد يعقوبوف والبروفيسور شموئيل (شابيلكا) روزنبلات من جامعة تل أبيب والبروفيسور جدعون رافي من المركز الطبي شيبا شيبا في تل هشومير وجامعة تل أبيب، طريقًا وسطًا. تعتمد طريقتهم على العامل الوسيط بين الحمض النووي والبروتين: جزيئات الحمض النووي الريبي المرسال (mRNA)، التي تقود برنامج إنتاج البروتينات من نواة الخلية إلى مصانع البروتين - الريبوسومات. تتحلل جزيئات الحمض النووي الريبوزي (RNA) بعد فترة قصيرة، وهو أمر يمكن أن يمنع المشاكل الناشئة عن بقاء المواد الوراثية الأجنبية في الخلية. ومن السمات الأكثر أهمية للحمض النووي الريبي (RNA) أنه لا يندمج في الجينوم، وبالتالي لا يشكل خطرًا على تكوين الطفرات. من ناحية أخرى، يتم إنشاء البروتينات التي تشفرها، وطيها ومعالجتها بواسطة آلية الخلية المضيفة، لذلك من المتوقع أن تعمل بشكل صحيح ودون تدخل داخلها. أنشأ العلماء RNA المرسال من الجينات الأربعة اللازمة لإعادة البرمجة في المختبر، وحقنوه في الخلايا الناضجة المزروعة في المزرعة. وكرروا عملية الإدخال عدة مرات، وبعد أسبوع عبرت الخلايا الناضجة عن جينات مميزة لنشاط الخلايا الجذعية الجنينية. وعندما تم نقل الخلايا إلى سطح نمو آخر، بدأت الخلايا - الناشئة من النسيج الضام - في نمو أذرع طويلة مميزة للخلايا العصبية. أطلق الباحثون على هذه الخلايا اسم iPS - RiPS التي تم إنشاؤها باستخدام الحمض النووي الريبي (RNA). ويلزم إجراء تجارب إضافية للتحقق مما إذا كانت الخلايا الجديدة تتمتع بالفعل بجميع خصائص الخلايا الجذعية المحفزة متعددة القدرات.
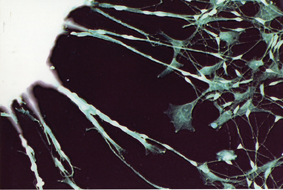
البروفيسور جافول: "لقد أثبتنا في هذه المرحلة أنه من الممكن إجراء إعادة البرمجة باستخدام الحمض النووي الريبي المرسال، وأنه يعمل كبديل فعال للحمض النووي. ويبدو أن الأساليب المعتمدة على الحمض النووي الريبوزي (RNA) ستلعب دورًا مهمًا جدًا في برمجة الخلايا." وقد أبدت العديد من المجموعات البحثية، بما في ذلك تلك التي تأمل في تطوير التطبيقات الطبية الحيوية، اهتمامًا بالفعل بالطريقة الجديدة. البروفيسور جافول: "الخلايا الجذعية المعاد برمجتها باستخدام الحمض النووي الريبي (RNA) قد تعزز تطوير الطب الشخصي بواسطة الخلايا. في المستقبل، سيكون من الممكن إنشاء خلايا iPS عن طريق إعادة برمجة خلايا شخص بالغ، ثم تحويل هذه الخلايا الجذعية لاحقًا إلى نوع الخلية المرغوبة - أيضًا باستخدام الحمض النووي الريبوزي الرسول للجينات المسؤولة عن التمايز المطلوب، مثل العضلات، العصب، الخ. ويمكن استخدام هذه الخلايا لعلاج العديد من الأمراض، بما في ذلك تلك التي لا يمكن علاجها اليوم".

تعليقات 8
أرغب في سماع رأي متخصص حول وظيفة الخلايا الجذعية في صناعة مستحضرات التجميل. ما مدى نجاحها حقًا. شكرًا مقدمًا.
تحية وبعد
هل هناك علاج رحيم بالخلايا الجذعية لمرض هنتنغتون؟
مرض يتيم لا يكاد يعالج.
شكرا لكم مقدما
شكرا جزيلا لك R.H.
دانيال ،
وصفك غير دقيق. الغرض من التسخين هو فتح الشريط المزدوج إلى شريطين منفردين وليس "عبور الحمض النووي"
يمكنك إضافة الاشعال إلى التفاعل. البادئات عبارة عن تسلسلين قصيرين من الحمض النووي المفرد الذين تقطعت بهم السبل (حوالي 2 قاعدة) تتطابق وتحدد الجزء الذي تريد تضخيمه.
التفاعل الكيميائي الذي يربط البادئات هو ببساطة الاقتران الأساسي المعتاد لـ AT وGC. نظرًا لأن البادئات قصيرة، فإن درجة حرارة ارتباطها أعلى من درجة حرارة الشريط المفرد الأصلي، وبالتالي عند درجة حرارة التلدين (حوالي 60 درجة مئوية، وفقًا لتسلسل البادئات) سوف ترتبط، لكن الشريط الثاني من الحمض النووي لن يرتبط . ينضم البوليميريز ومن البادئات إلى نسخ القالب الذي تم إرفاقه به.
آمل أن يكون الشرح واضحًا، وإذا لم يكن الأمر كذلك، فما عليك سوى إلقاء نظرة على الرسم البياني وسيكون واضحًا.
أود أن أطرح سؤالاً لا يتعلق بالضرورة بالجزء المطروح، وأتمنى الحصول على إجابة مفصلة.
عند وضع أي جين في جهاز PCR، فإن الخطوة الأولى هي تسخين الجهاز إلى حوالي تسعين درجة مئوية. لعبور المقطع المعطى إلى قسمين ومن هناك يتصل التمهيدي بذلك القسم (متقاطع). ومن هناك جزيء بوليميراز الحمض النووي. يستمر في بناء تسلسل مطابق أعلى القطعة، مما يؤدي إلى ازدواجها. وأود أن أعرف من أين يأتي هذا التمهيدي إلى القطعة حتى يتمكن الجزيء من الاستمرار. وأود أن أعرف ما هي التفاعلات الكيميائية التي تسبب ذلك.
فلماذا لا تنجح هذه الطريقة أيضًا في صنع بروتينات أخرى في الخلايا الطبيعية مثل تلك المطلوبة في الأمراض الوراثية مثل التليف الكيسي.
أو البروتينات التي يؤدي نقصها إلى نشوء السرطان وغيره.
يمكن للشخص أن يفسر؟
لطيفة، تبدو جيدة حقا