البروفيسور-طورت مشنا دافنا فايس من كلية الهندسة الطبية الحيوية في التخنيون طريقة لتقدير القدرة النقيلية للأورام السرطانية. 90% من وفيات السرطان ناجمة عن النقائل، لذا فإن الكشف المبكر عنها يحسن فرص المريض في البقاء على قيد الحياة
إن النهج البحثي الذي تم تطويره في التخنيون سيمكن من التنبؤ المبكر والسريع بتكوين النقائل السرطانية. ستسمح هذه المعلومات للأطباء بمعالجة هذه النقائل بالفعل في المراحل الأولى من تكوينها، وبالتالي تحسين فرص المريض في البقاء على قيد الحياة.
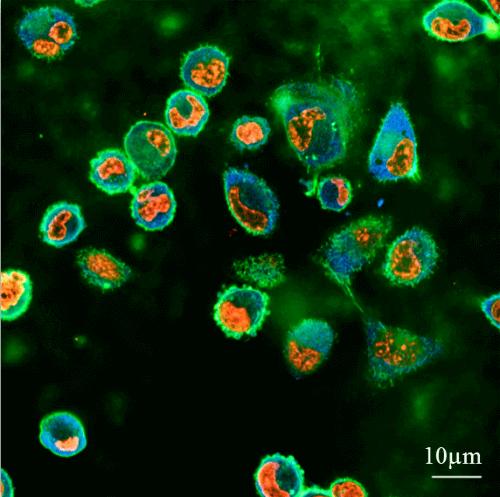
تم تقديم النهج المذكور لأول مرة في عام 2013 واستمر تطويره منذ ذلك الحين في عدة اتجاهات، والذي تم عرضه في ثلاث مقالات نشرتها مؤخرًا الأستاذة المشاركة دفنا فايس من كلية الهندسة الطبية الحيوية في التخنيون. يقوم البروفيسور مشنا فايس، رئيس مختبر علم الأحياء الميكانيكي للسرطان والجروح، بدراسة القوى الميكانيكية التي تمارسها الخلايا النقيلية على أنسجة الجسم - وهي الخلايا ذات القدرة النقيلية العالية. تم إجراء البحث باستخدام أسطح هلامية صناعية تم إنتاجها في مختبر البروفيسور ميشنا فايس والتي تحاكي صلابتها الأنسجة الرخوة في الجسم. الهدف: قياس القدرة النقيلية للخلايا السرطانية. وفي التجارب المعملية، يتم اختبار القوى التي تحفز مثل هذه الخلايا على نفس الأسطح المراد دفعها إليها.
وعلى النقيض من علاج الأورام الأولية، والذي يتم حاليًا بكفاءة عالية، فإن علاج نقائل السرطان معقد وصعب. يتم إرسال هذه النقائل إلى الأعضاء السليمة من خلال الجهاز اللمفاوي والأوعية الدموية، ويصعب اكتشافها في المراحل الأولى من تطورها. عندما يتم اكتشافها، عادةً في مرحلة تكون فيها كبيرة بالفعل ومنتشرة، يكون التعامل معها طبيًا معقدًا للغاية. وهذا هو السبب في أن النقائل السرطانية مسؤولة عن حوالي 90% من الوفيات الناجمة عن السرطان.
في العقود الأخيرة، تم تطوير طرق مختلفة لتحديد القدرة النقيلية للخلايا، تعتمد بشكل أساسي على العلامات الجينية والبيولوجية. وعيب هذه القياسات هو أنها باهظة الثمن، وتستغرق وقتا طويلا، ولا تنطبق على أمراض السرطان مثل سرطان البنكرياس، والتي لم يتم بعد تحديد العلامات التي تشير إليها. في الواقع، لم يتم حتى الآن تقديم أي طريقة فعالة ودقيقة وعامة بما فيه الكفاية لقياس إمكانات النقيلي الأساسية للتنبؤ بتكوين النقائل.
وفي الأبحاث التي أجراها البروفيسور المشارك فايس، وجد أن التغيرات في بنية الخلية وقدرتها على ممارسة القوة الميكانيكية قد توفر هذه المعلومات الحيوية بطريقة كمية دقيقة. تتيح هذه الطريقة، التي لا تعتمد على الجينات المحددة للورم، إجراء قياس سريع (خلال ساعات قليلة) وتخصيصه للمريض.
إن أسطح الهلام الاصطناعية التي طورها البروفيسور ميشنا فايس تشبه في مستوى صعوبتها الأنسجة الرخوة، وبالتالي تجعل من الممكن دراسة الظروف التي تمارس فيها الخلايا القوة على الأنسجة التي تحاول اختراقها. تتيح هذه الطريقة تحديد مقدار القوة التي تمارسها والفرق في سلوك أنواع الخلايا المختلفة. يوضح البروفيسور فايس: "تسعى الخلية السرطانية إلى اختراق الأنسجة الطبيعية والسيطرة على مناطق بداخلها. لذلك، أثناء التطور، طورت الخلايا السرطانية مرونة هيكلية تسمح لها بالتليين أو التصلب من أجل الدفع عبر المناطق الضيقة".
بناءً على خصائص الأنسجة السليمة وبنيتها، تغير الخلايا السرطانية خصائصها في جوانب مثل الشكل والبنية الداخلية والصلابة الهيكلية. "من المثير للاهتمام أن نلاحظ أنه في ظل ظروف معينة، فإن سر الخلايا السرطانية ليس الصلابة بل النعومة - فالخلية السرطانية أكثر ليونة ومرونة من الخلية السليمة، والخلية النقيلية أكثر ليونة ومرونة. تتكيف الخلايا السرطانية مع البيئة بسرعة، وطريقتنا تعتمد على تحديد التغيرات التي تحدث فيها".
ثلاث مقالات
المقالة الأولى من بين الثلاثة، تم نشره في مجلة الميكانيكا الحيوية والنمذجة في علم الأحياء الميكانيكية ويستند إلى العمل البحثي للأستاذ سونوبولا مصالحة. ركزت هذه الدراسة على الخلايا التي ترتبط ببيئتها ولكنها لا تحاول اختراق الأنسجة. واكتشف مصالحة فرقا بين الخلايا الحميدة وخلايا سرطان الثدي، التي تمارس قوة أكبر على الأنسجة رغم أنها لا تحاول اختراقها. هذه الخلايا، على الرغم من أنها ليست غازية بعد في تلك المرحلة، إلا أنها تؤثر على الخلايا المحيطة ويمكن أن تحسن قدرتها على الاختراق. تم توضيح ظاهرة التآزر بين الخلايا المجاورة في مقال آخر.
المادة الثانية تم نشره في مجلة هندسة الأنسجة بالتعاون مع طالبة ما بعد الدكتوراه مارتا ألفاريز إليزوندو. تركز هذه الدراسة على العلاقة بين قدرة هجرة الخلايا والنفاذية الميكانيكية المقاسة في المختبر على المواد الهلامية. النتائج الرئيسية: السرعة مهمة. الخلايا التي تنتمي إلى مجموعات سكانية فرعية تتميز بقدرة أكثر تطورًا على الحركة هي تلك التي تمارس قوة أكبر في محاولة لاختراق الأنسجة. وتبين في الدراسة أن طريقة الاختبار التي تم تطويرها في مختبر البروفيسور مشنا فايس هي أكثر فعالية بكثير من الطرق التقليدية لاختبار هذه الخصائص، وتوفر تشخيصًا لخصائص الخلية خلال ساعات قليلة.
في المادة الثالثة، الذي نشر في مجلة حوليات الهندسة الطبية الحيوية، تم بناء نموذج يحاكي بشكل أكثر دقة العمليات التي تحدث في الجسم. وفي الدراسة التي قادتها طالبة الدكتوراه يوليا ميرهار، وجد أن الخلايا تصبح أكثر غزوًا عندما تتحرك في مجموعات أو تكون متقاربة مكانيًا، والتفسير بسيط: الخلايا التي تعمل معًا تمارس ضغطًا مشتركًا على الأنسجة وبالتالي تزيد فرصتهم في اختراقها. وفقًا للأستاذ المشارك فايس: "مع هذا الاكتشاف، نعتزم المضي قدمًا وتطوير تنبؤ سريع وكمي لتكوين النقائل بناءً على حركة المجموعة من الخلايا."

اتضح أن الخلايا السرطانية تتفاعل بشكل مختلف مع الأنسجة. ليست القوة العمودية التي تمارسها عليها أقوى فحسب، بل يتم أيضًا الالتصاق قبل محاولة الاختراق بقوة أكبر مع زيادة حركة الخلية. "تبقى الخلية السرطانية مستديرة، مع منطقة اتصال صغيرة، في حين أن الخلايا الحميدة تستطيل وتزيد مساحة الاتصال مع الأنسجة. يمكن القول أن الخلايا الحميدة مشغولة فقط بالالتصاق والوظيفة بينما الخلية ذات الإمكانات النقيلية توجه نفسها لتغيير بيئتها والتغلغل في الأنسجة. ولهذا الغرض، تنظم الخلية النقيلية نفسها بطريقة مختلفة تمامًا من حيث الشكل وتتواصل بطريقة ميكانيكية مختلفة مع الخلايا الأخرى في بيئتها ومع بيئتها. هذه هي القرائن التي قد تساعدنا في الكشف المبكر والسريع عن هذه الخلايا بناءً على خصائصها الميكانيكية. هذه القدرات هي بالطبع نتيجة للتغيرات الجينية، ولكن مع النهج الذي طورناه ليست هناك حاجة للحصول على معلومات حول هذه التغييرات.
في هذه الأيام، واستنادًا إلى موافقات لجنة هلسنكي التي تم تلقيها بالفعل في عام 2015، بدأ البروفيسور المشارك فايس في التحقق من النتائج المتعلقة بالأورام الحقيقية التي تمت إزالتها من أجسام مرضى سرطان الثدي وسرطان البنكرياس وسرطان المعدة بالإضافة إلى نوع ساركوما إيوينج. الأورام النموذجية للأطفال والشباب. ويوضح البروفيسور المشارك فايس أن البحث يعتمد على "بقايا" أنسجة الورم التي لا حاجة لها، حتى فيما يتعلق بالفحص المرضي. "وفقًا للنتائج الأولية، يبدو أننا تمكنا بالفعل من تحديد الخلايا النقيلية في هذه الأنسجة بناءً على خصائصها الميكانيكية. هدفنا التطبيقي هو تطوير نظام يسمح للفريق الطبي بالتحقق، بالفعل أثناء الخزعة أو الجراحة، من احتمالية انتشار الورم إلى الأعضاء الأخرى وتقييم الأعضاء المعنية. وكما ذكرنا سابقًا، يعد هذا اختبارًا سريعًا للغاية، بحيث يتمكن الأطباء خلال ساعتين إلى ثلاث ساعات من تقييم احتمالية انتشار الورم وضبط العلاج وفقًا لهذه البيانات."
حصلت البروفيسور المشارك دفنا فايس على شهاداتها الثلاث في كلية الهندسة الكيميائية في التخنيون. ثم تابعت دراستها للحصول على درجة ما بعد الدكتوراه في قسم علم الأمراض في كلية الطب بجامعة كاليفورنيا، لوس أنجلوس (UCLA)، الولايات المتحدة الأمريكية. وفي بحث ما بعد الدكتوراه، والذي مولته وكالة ناسا لما له من آثار على مجالات علم الأحياء والطب في ظروف الفضاء، بدأت في الانخراط في الموضوع الذي تنخرط فيه حاليًا: ميكانيكا الخلية، مع التركيز على سلوك الخلايا السرطانية. . وهي مدرجة في قائمة أكثر 50 امرأة تأثيرا في إسرائيل لعام 2015، والتي نشرت في "ليدي جلوبز"، ويعود ذلك إلى اكتشافاتها في مجال تشخيص الأورام النقيلية، والتي تشكل "اختراقا من شأنه إنقاذ الأرواح في العالم". مستقبل."

تعليقات 2
بالمعنى الواسع، تُستخدم كلمة "التطور" في العصر الحديث لوصف أي عملية تغيير وتطوير.
لا أفهم الجملة: "يشرح البروفيسور ميشنا فايس، "لذلك طورت الخلايا السرطانية مرونة أثناء التطور"
كيف يمكن أن تكون الخلايا السرطانية قد تطورت أثناء التطور؟
ففي نهاية المطاف، تقتل الخلية السرطانية مضيفها ولا تتكاثر، ولا تصيب ولا تنتقل إلى مضيف آخر، ولا تعبر عن نفسها لاحقًا في التطور (مثل البكتيريا على سبيل المثال) وبالتالي لا يمكن للخلية السرطانية أن يكون لها أحفاد يخضعون لها. تطور.
لذلك ليس من الواضح بالنسبة لي كيف يمكن أن تتغير الخلايا السرطانية أثناء التطور؟