إن تقوية جهاز المناعة في الجسم يحقق نتائج واعدة في مكافحة الأمراض الخبيثة
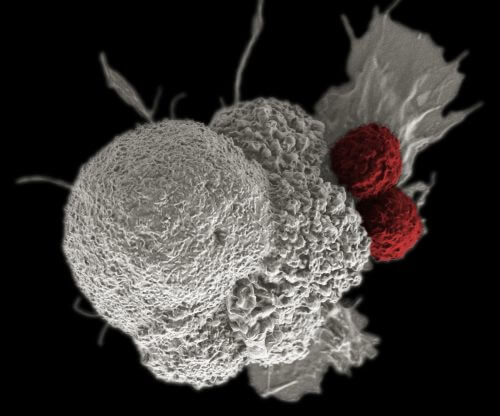
مؤسسة وينتروب, تم نشر المقال بموافقة مجلة Scientific American Israel وشبكة Ort Israel، 07.07.2016
باختصار
- حقق جيل جديد من العلاجات التي تزيد من قدرة الجهاز المناعي على محاربة الخلايا الخبيثة والسيطرة عليها مع مرور الوقت، نتائج مبهرة خلال السنوات الخمس الماضية.
- لقد تم علاج الآلاف من الأشخاص المصابين بسرطان الرئة أو سرطان الجلد العدواني والمتقدم، وكذلك المصابين بأنواع مختلفة من سرطان الدم وسرطان الغدد الليمفاوية، ويبدو أن الكثير منهم قد تم شفاؤهم.
- يقوم الباحثون حاليًا بتطوير أنظمة علاجية جديدة ومجموعات دوائية قد تكون أكثر أمانًا وفعالية من الأساليب المستخدمة اليوم.
في عام 2013، تم تشخيص إصابة ميشيل بوير بسرطان الجلد المتقدم والعدواني. لو كانت قد تلقت هذا التشخيص قبل ثلاث سنوات، في عام 2010، فمن المحتمل أن تكون ميتة الآن. انتشر سرطان الجلد، وهو سرطان الجلد الأكثر فتكًا، إلى رئتيها من شامة على ظهرها، وكانت تعلم أن تشخيصها كان قاتمًا. ولكن ابتداءً من مايو 2013، بدأت هذه المريضة البالغة من العمر 29 عامًا والمقيمة في سياتل في تلقي سلسلة من العلاجات الثورية، بعضها كان متاحًا لأول مرة في عام 2011، مما دفع جهاز المناعة لديها إلى التعرف على الأورام ومهاجمتها وتقليصها. على الرغم من أن بوير لا تزال مصابة بالسرطان، وعلى الرغم من الآثار الجانبية للأدوية التي تعزز جهازها المناعي، إلا أنها سعيدة لبقائها على قيد الحياة، وتأمل أن يوفر لها العلاج الحالي أو العلاج التالي في النهاية النتيجة المعجزة التي يتحدث عنها المرضى الآخرون. على شبكة الانترنت. وتقول: "هذه هي حياتي الآن". "يعتقد الناس أنه من الصعب جدًا الحفاظ على موقف إيجابي، لكن بالنسبة لي يبدو الأمر طبيعيًا، فهو ليس مجهودًا كبيرًا كما قد يظن المرء."
يبدو أن كارين كوهلر، 59 عامًا، وهي معلمة سابقة للتعليم الخاص من بارك ريدج بولاية نيوجيرسي، فازت بالجائزة الكبرى في محاولتها الأولى. ويبدو أنها شفيت من نوع آخر من السرطان، وهو سرطان الدم، بعد حقنها مرة واحدة، في أوائل عام 2015، لخلايا من جهازها المناعي، الذي تم تصميمه وراثيا لمحاربة السرطان بقوة كبيرة. العلاج، الذي استمر عدة ساعات، قادها إلى العناية المركزة لبضعة أيام، لأن جهازها المناعي الملتهب أصبح في حالة فرط نشاط كبير. ثم دخلت المستشفى لعدة أسابيع. ولكن بعد شهر من العلاج، لم تجد الفحوصات أي علامة على وجود سرطان في جسدها.
بوير وكوهلر هما اثنان من آلاف مرضى السرطان الذين خضعوا لأنواع مختلفة من العلاج المناعي - العلاج باستخدام الجهاز المناعي للمريض - خلال السنوات الخمس الماضية. تُظهر تجاربهم الإمكانيات والتحديات التي يواجهها هذا النهج الجديد لعلاج السرطان، وهو نهج لا يغمر الجسم بمواد كيميائية سامة أو إشعاعات خارجية لتدمير الخلايا السرطانية، بل يحفز الترتيب الداخلي المعقد للخلايا والإشارات الجزيئية. من شبكات الدفاع في الجسم. والنتائج حتى الآن مشجعة. سرعان ما أصبح العلاج المناعي هو الدعامة الأساسية، إلى جانب الجراحة والإشعاع والعلاج الكيميائي، في علاج أنواع معينة من السرطان.
وفي التجارب السريرية لطرق العلاج المناعي الجديدة المصممة لمحاربة شكل عنيف بشكل خاص من سرطان الدم، شهد 90% من المرضى شفاءً كاملاً: ولم يجد الأطباء أي دليل على تكرار مرضهم في أي مكان في الجسم. على الرغم من أن السرطان قد يندلع مرة أخرى في بعض الحالات، إلا أن الاستجابة في كثير من الحالات الأخرى ربما تمثل علاجًا كاملاً. وفي تجارب أخرى، أصبح بإمكان أكثر من نصف المرضى الذين يعانون من سرطان الجلد المتقدم والذين تلقوا العلاج المناعي تقدير متوسط العمر المتوقع لهم بالسنوات بدلاً من الأشهر. يقول العلاج المناعي جيري جيليلاند الرئيس والمدير التنفيذي لمركز فريد هاتشينسون لأبحاث السرطان في سياتل، "إنها حقًا نموذج يغير نهجنا في علاج السرطان."
ومع ذلك، لا بد من الاعتراف بأن هذه هي بداية الطريق. إن تمديد العمر المتوقع لبضع سنوات لبعض أنواع السرطان يعني أن المرضى ما زالوا يموتون بسبب المرض. لذلك يواصل العلماء استكشاف طرق جديدة لتحفيز الاستجابة المناعية، بما في ذلك اللقاحات والفيروسات والخلايا المعدلة وراثيا والحبوب.انظر الرسوم التوضيحية]. كما بدأوا أيضًا في الجمع بين أساليب مختلفة لمعرفة ما إذا كان من الممكن مساعدة المزيد من المرضى، وربما مع آثار جانبية أقل. ولكن لم يعد هناك أي شك في قدرة الأطباء على التأثير على جهاز المناعة للتغلب على السرطان، على الأقل في بعض الحالات. ويقول: "[نحن] في نهاية البداية" لقصة العلاج المناعي إريك روبن، نائب رئيس قسم الأورام السريرية العالمية في مختبرات ميرك للأبحاث.
النجاح السائل
بدأ السعي لمكافحة السرطان بمساعدة الجهاز المناعي منذ 125 عامًا على الأقل ويليام كولي من نيويورك، طبيب قام بحقن بعض مرضى السرطان لديه بالبكتيريا، في محاولة لتحفيز عمليات الشفاء الطبيعية في الجسم. تمت تجربة نهج كولي لأول مرة من قبل العديد من الأطباء الآخرين. لكن أهميتها تراجعت بعد وفاته في عام 1936، وحل محلها العلاج الكيميائي، ثم العلاجات بمساعدة الهرمونات أو الأجسام المضادة، والتي أنتجت نتائج أكثر اتساقا في نسبة أعلى من المرضى.
لكن فكرة تحفيز الجهاز المناعي لم تتوقف أبدا عن إثارة الاهتمام، وقد روج لها جزئيا معهد أبحاث السرطان، وهي جمعية في نيويورك أسستها ابنة كولي عام 1953. في العقود الماضية، ساعدت البيولوجيا الجزيئية الباحثين على تحسين وفهم جهاز المناعة، وكيفية عمله ومتى يفشل. يمتلك الباحثون في مجال السرطان الآن أسلحة مناعية أكثر قوة.
ومن أكثر الأهداف إغراء لهذه الأسلحة هي أنواع السرطان التي تصيب الدم والجهاز الليمفاوي، مثل سرطان الدم וسرطان الغدد الليمفاوية. تحدث هذه الأمراض عندما تتراكم الطفرات على أنواع مختلفة من الخلايا السلفية تسمى الخلايا الجذعية، والتي تنتج عادة الخلايا الحمراء والبيضاء في الدم (والأنسجة الأخرى)، وتنمو بشكل لا يمكن السيطرة عليه، وتزاحم الخلايا السليمة وتلحق الضرر بوظائف الجسم الحيوية. وتتكون العديد من هذه الأورام، والتي تسمى الأورام السائلة، عندما يحدث خطأ ما في خلايا الجهاز المناعي التي تسمى خلايا ب. عادةً ما تنتج الخلايا البائية أجسامًا مضادة ضد البكتيريا والفيروسات. (تساعد الخلايا البائية أيضًا في تنسيق الاستجابات المناعية الأخرى، مع الخلايا الأخرى التي تسمى الخلايا التائية.) ولكن عندما تصبح الخلايا البائية خلايا سرطانية، فإنها تدمر الجسم من الداخل.
في نهاية القرن العشرين، طور الباحثون المعادل البيولوجي للصاروخ الموجه، الذي يرتبط بالبروتين (CD20) وجدت على سطح الخلايا البائية في مرحلة معينة ومتأخرة من وجودها. يسمى هذا الجسم المضاد وحيد النسيلة ريتوكسيماب، يشير إلى الخلايا التائية للقيام بشيء تتجنبه عادة: مهاجمة وقتل الخلايا البائية القديمة، التي تعبر عن CD20.
وكانت المشكلة أن CD20 ليس علامة محددة للخلايا السرطانية. يظهر على الخلايا البائية الطبيعية وعلى الخلايا الخطرة. لذلك دمر الدواء كلاً من الخلايا البائية السليمة والخلايا السرطانية. ولكن تبين أن أغلب الناس قادرون على العيش بدون الخلايا البائية. (وهذا لا ينطبق على الخلايا التائية، كما يتبين من الوفيات المأساوية للملايين من المصابين بفيروس الإيدز، الذي يهاجم الخلايا التائية). بعد زوال الدواء، يبدأ معظم المرضى في نهاية المطاف في إنتاج الخلايا B مرة أخرى من مجمع الخلايا الجذعية في نخاع العظام. أشارت التجارب السريرية في التسعينيات إلى أن الجمع بين العلاج الكيميائي وريتوكسيماب كان فعالاً بشكل خاص ضد السرطانات التي تهاجم الخلايا البائية.
بدأ سرطان الدم لدى كوهلر مع الخلايا البائية المتحورة، لكن ريتوكسيماب سبب لها آثارًا جانبية شديدة وبدا أن الدواء فعال جزئيًا فقط، لذلك توقفت عن تناوله. بالإضافة إلى ذلك، أظهرت الاختبارات أن سرطانها كان مقاومًا للعلاج الكيميائي التقليدي. ومع تدهور حالتها بسرعة، قدم لها الأطباء علاجًا مناعيًا تجريبيًا مصممًا لمحاربة نوع سرطان الدم الذي تعاني منه. وافقت.
كان الهدف من العلاج الجديد هو تدمير جميع خلايا كوهلر البائية، كما هو الحال مع ريتوكسيماب، ولكن مع وجود اختلافين أساسيين. كان هدف الهجوم بروتينًا آخر على الخلايا البائية (يسمى CD19). وبدلاً من استخدام دواء آخر لتحديد البروتين المستهدف للخلايا التائية الموجودة بالفعل في جسم كوهلر، اتخذ الأطباء نهجًا أكثر مباشرة. لقد أخذوا بعضًا من خلاياها التائية، وقاموا بتعديلها وراثيًا لمهاجمة CD19 تلقائيًا، دون مزيد من التحفيز.
يطلق الباحثون على هذه الخلايا التائية المُهندسة اسم خلايا CAR-T (الخلايا ذات مستقبل المستضد الخيميري). وتتميز هذه الخلايا بخصائص كل من الخلايا التائية والخلايا البائية المشابهة لما يسمى بالمخلوقات الأسطورية القديمة الوهم وهم مزيج من الحيوانات المختلفة. ولا تزال علاجات CAR-T تجريبية، ولكن من المتوقع أن تنظر إدارة الغذاء والدواء الأمريكية (FDA) في الموافقة على استخدامها العام في العام المقبل.
تضاعفت خلايا CAR-T المبرمجة للتعرف على CD19 بسرعة كبيرة في جسم كوهلر، لدرجة أن كيسًا واحدًا من الخلايا المهندسة تلقتها في 10 فبراير 2015، قضى على جميع خلاياها البائية. ولكن على عكس المرضى الآخرين، بدا أن جسدها قد نسي كيفية تكوين خلايا بائية سليمة. ولحسن الحظ، يمكن حل المشكلة: فهي تتلقى كل شهر حقنة تستمر لعدة ساعات من الأجسام المضادة الاصطناعية التي تسمى جاما جلوبيولين للمساعدة في حمايتها من الأمراض المعدية. وتقول إن عمليات نقل الدم تستغرق وقتًا طويلاً، لكنها "ليست علاجًا كيميائيًا، لذا أفضلها".
لكن علاج CAR-T تسبب لكوهلر في ظاهرة يمكن أن تكون أسوأ من الغثيان الذي يسببه العلاج الكيميائي: ما يسمى بالعاصفة متلازمة إطلاق السيتوكين. يحدث هذا التفاعل عندما يتم تنشيط عدد أكبر من الخلايا التائية في وقت واحد، مما يتسبب في حدوث طوفان من الإشارات الكيميائية، تسمى السيتوكيناتوالتي يستخدمها الجهاز المناعي لأغراض التواصل. قد تكون النتيجة نشاطًا متزايدًا ومهددًا للحياة حيث تقوم خلايا الجهاز المناعي بتدمير الأنسجة السليمة وتسبب فشل الأنظمة المتعددة.
بالنسبة لكوهلر، كانت العاصفة سريعة وقوية. لقد شعرت بالفزع بعد ساعة من تلقي الخلايا التائية المهندسة. في تلك الليلة كانت بالفعل في العناية المركزة، وبقيت هناك لمدة ثمانية أيام، نصف الوقت كانت فاقدة للوعي. إنها لا تتذكر ما حدث ولكن يمكنها أن تتذكر الهلوسة التي جاءت بعد بضعة أيام عندما طلبت من الممرضات مساعدتها في إعداد وجبة الغداء لاثنين من لاعبي الغولف المشهورين. وكانت كوهلر مدمنة على لعبة الجولف منذ عام 1999، عندما بدأت اللعب لمقابلة شركاء، بما في ذلك الرجل الذي تزوجته في النهاية.
عندما خرجت كوهلر من المستشفى في أوائل مارس 2015، كانت ضعيفة للغاية لكنها تعافت بسرعة. ولم يكشف فحص نخاع العظم عن أي أثر للسرطان، وبعد ثلاثة أسابيع عادت إلى ملعب الجولف مع زوجها. كانت عاصفة السيتوكين فظيعة، ولكن على عكس العلاج الكيميائي، تراجعت آثارها في غضون أسابيع قليلة ولم تسبب تساقط الشعر. ولحسن الحظ، ونظرًا لأن عواصف السيتوكين شائعة نسبيًا في علاجات CAR-T، فقد بدأ الأطباء في معرفة المدى الذي يمكن أن يذهبوا إليه مع مرضى مثل كوهلر للحصول على أقصى استفادة دون تعريض حياتهم للخطر.
يتم تصنيع علاجات CAR-T خصيصًا لكل مريض. يعد إنتاج مثل هذه العلاجات لجميع مرضى سرطان الدم والأورام اللمفاوية الذين قد يرغبون في ذلك تحديًا كبيرًا ومكلفًا للغاية أيضًا. في الوقت الحالي، من السابق لأوانه معرفة سعر علاجات CAR-T بالضبط، لأنه حتى الآن تم استخدامها فقط للبحث الأكاديمي. روبرت بيريتي، مؤسس PCT، الشركة المصنعة لـ CAR-T، تحاول تحسين عملية التصنيع. وهو يعتقد أن هذه هي في الأساس مشاكل هندسية سيتم حلها في غضون سنوات قليلة من العمل الشاق.
التحدي الكبير الآخر الذي يواجه علاجات CAR-T هو ترجمة النجاح من أورام السرطان السائلة إلى الأورام الصلبة، من النوع الذي يشكل كتل في الثدي أو البروستاتا أو الرئتين أو الجلد أو الأنسجة الأخرى. أحد العوائق هو أن خلايا CAR-T تجد صعوبة في الخروج من مجرى الدم إلى موقع الورم الصلب، كما يوضح إيرا ميلمان، نائب الرئيس لعلم مناعة السرطان. في جينينتيك. من السهل نسبيًا اكتشاف الخلايا السرطانية السائلة في الدم. والأهم من ذلك، أنه في حين أن CAR-T يمكنه القضاء على جميع الخلايا البائية في سرطانات الدم والليمفاوية، إلا أنه لا توجد خلايا مماثلة في الأورام الصلبة التي يمكن للمرضى العيش بدونها.
الحالة الصلبة
تشكل الأورام الصلبة صعوبات أخرى في العلاج المناعي. غالبًا ما تكون الأورام محاطة بمجموعة من الأنسجة الضامة والأنسجة الأخرى، مما يمنع وصول الخلايا إلى الكتلة الخبيثة. بالإضافة إلى ذلك، غالبًا ما يكون الضغط الداخلي للورم الصلب أعلى من ضغط بيئته، وبسبب اختلافات الضغط، يتم غسل الإشارات الكيميائية التي يستخدمها الجهاز المناعي لتحديد الخلايا التالفة، وغني عن القول العديد من الأدوية.
ومع ذلك، فإن هذه المحاصيل معرضة للخطر أيضًا. في عام 2011، وافقت إدارة الغذاء والدواء الأمريكية (FDA) على الجسم المضاد وحيد النسيلة، إبيليمومابلعلاج الحالات المتقدمة من سرطان الجلد. على عكس العلاجات التقليدية، ليس من المفترض أن يقوم عقار إبيليموماب بتدمير الخلايا السرطانية بشكل مباشر، ولكن من المفترض أن يطلق الحواجز البيولوجية التي تستخدمها بعض الأورام السرطانية لتثبيط جهاز المناعة. والنتيجة هي أن نظام الدفاع في الجسم يمكنه الآن العمل بكفاءة أكبر.
للورم الميلانيني عادة سيئة: فهو يخدع خلايا الجهاز المناعي. تحتوي كتل الخلايا السرطانية على مجموعة متنوعة من البروتينات المعيبة على سطحها، والتي من المفترض أن تتعرف عليها الخلايا التائية وتدمرها قبل أن ينمو السرطان. لكن بين الحين والآخر تطور خلية سرطانية جديدة طريقة لإرسال إشارات كيميائية تخبر الخلايا التائية أن كل شيء على ما يرام ولا داعي للهجوم.
في الواقع، اختطفت الخلايا السرطانية مكونًا طبيعيًا في الجهاز المناعي: آلية الأمان التي تهدئ خلايا الجسم الدفاعية الهائجة قبل أن تبدأ في تدمير الأنسجة السليمة. وبشكل أكثر دقة، تتكون آلية الدفاع هذه من سلسلة من نقاط التحكم التي تعمل على تنشيط أو إرخاء الخلايا الدفاعية، اعتمادًا على الإشارات الكيميائية الموجودة. (إذا علقت بروتينات التحكم في الجهاز المناعي في الحالة "المفتوحة"، فمن المفترض أن تقتلنا الاستجابة المناعية بشكل أسرع من أي سرطان.) ومن خلال إنتاج البروتينات التي تعوق نظام التحكم، تمنع الخلايا السرطانية الجهاز المناعي من مهاجمة السرطان. إن حجب هذه الإشارة الكاذبة باستخدام إيبيليموماب أو مثبطات بروتينات نقطة التفتيش الأخرى يعيد إيقاظ خلايا الجهاز المناعي ويسمح لها بإعادة التركيز على الهدف.
وسرعان ما أصبح من الواضح أن عقار إبيليموماب كان فعالا ليس فقط في علاج سرطان الجلد ولكن أيضا في سرطان الرئة، وبدأت شركات الأدوية في تطوير أدوية أخرى تستخدم نفس الاستراتيجية. وكان الرئيس الأمريكي الأسبق جيمي كارتر، البالغ من العمر 91 عاما، والذي انتشر سرطان الجلد في دماغه، قد تلقى أحد هذه الأدوية، بيمبروليزومابوأعلن نهاية عام 2015 أن الدواء قضى على كافة أورامه.
ولم يحصل بوير، الذي تلقى علاجا مماثلا لمرض مماثل، على مثل هذه النتيجة الجيدة. وهذا هو اللغز. ويتكهن بعض الباحثين بأن تقدم كارتر في السن ساعده. تتراكم المزيد من الطفرات في الخلايا السرطانية القديمة، لذلك ربما يحتاج جهازه المناعي إلى دفعة صغيرة فقط لإطلاق العنان للخلايا التائية الموجودة بالفعل. من ناحية أخرى، من المحتمل أن الخلايا التائية لدى بعض المرضى لم تصل إلى الورم على الإطلاق، ولم يكن هناك انسداد يتطلب إطلاقه على أي حال. وفي حالة مرضى آخرين، يبدو أن الخلايا التائية موجودة بالفعل في المكان المناسب، لكن الدواء لا يزال لا يعمل، ربما لأنه من الضروري تحرير عدة قيود مختلفة. أظهرت دراسة نشرت عام 2015 في مجلة نيو إنجلاند الطبية أن نسبة أعلى من مرضى سرطان الجلد استجابوا عندما تلقوا مثبطين لبروتينات التحكم المناعي، بدلاً من واحد.
ومع ذلك، يواجه الأطباء صعوبة في التنبؤ بمن سيستجيب لأي مثبط أو مجموعة من العلاجات، لذلك يتعين على بوير والمرضى مثلها الاستمرار في تجربة أدوية مختلفة. واليوم، يحصل ما يزيد قليلاً عن 20% من المرضى الذين يعانون من سرطان الجلد المتقدم والذين يشاركون في التجارب السريرية على استجابة كاملة من العلاج بمثبطات بروتينات التحكم المناعي، ويحصل ما يزيد قليلاً عن نصف المرضى على بعض الاستجابة. ومما يزيد الوضع تعقيدًا أن بعض الأورام السرطانية التي يبدو أنها تنجذب إلى عدد قليل فقط من الخلايا التائية لا تزال تستجيب لمثبطات بروتينات التحكم، بينما في بعض الأحيان، في الأورام الأخرى التي تحتوي بالفعل على الكثير من الخلايا التائية، تعمل الأدوية لا تأثير على الإطلاق. أعني أن السرطان قد يكون لديه حيل أخرى في جعبته.
ولهذا السبب، فإن اختيار علاج فعال للورم الصلب لدى شخص معين هو مسألة تجربة وخطأ، كما تعلمنا تجربة بوير. وبعد مرور عامين على إجراء عملية جراحية لإزالة الشامة السرطانية من ظهرها، تلقت الأخبار المريرة بعودة الورم الميلانيني وانتشاره إلى رئتيها وصدرها. نظرًا لأن الأورام أصبحت الآن كبيرة جدًا بحيث لا يمكن إجراء عملية جراحية لها، وافقت بوير على المشاركة في تجربة سريرية في أوائل عام 2013 حيث كان من المقرر حقنها بجرعات عالية من إنترلوكين -2 (IL-2)، واحدة من عشرات المواد الكيميائية المختلفة التي تساعد على تعزيز قدرة الجهاز المناعي على مكافحة السرطان. في البداية، بدا أن الدواء يوقف نمو السرطان، لكن بعد ثلاثة أشهر أظهرت الفحوصات أن السرطان لا يزال ينتشر.
انتقل بوير إلى تجربة سريرية ثانية، حيث قاموا بدمج عقار إيبيليموماب، وهو مثبط بروتين التحكم المناعي المعتمد مؤخرًا، مع جزيء آخر يشير إلى الجهاز المناعي، وهو IL-21. ومع ذلك، في غضون أسابيع قليلة، كانت الآثار الجانبية لـ IL-21 (الغثيان والإسهال والألم الذي لا يطاق) شديدة جدًا لدرجة أن بوير اضطر إلى التوقف عن تلقي الحقن، واستمر في تلقي إبيليموماب فقط. وبحلول نهاية عام 2013، بدأت بعض البؤر السرطانية في التوسع، لذلك أوصى أطبائها بالعلاج الإشعاعي لتأخير النمو. وفي خريف العام التالي، تقلصت بعض الأورام، لكن ظهرت أخرى على رأسها وصدرها.
تمت إزالة ورم الثدي بمساعدة الجراحة، وتمكن علاجان إضافيان لتقوية جهاز المناعة من السيطرة على الأورام المتبقية لبعض الوقت. ولكن في يناير 2015، كان من الواضح بالفعل أن هناك حاجة إلى خطة عمل مختلفة، لأن بؤر جديدة بدأت تظهر في الدماغ والصدر والمعدة. وبعد شهر، انضمت إلى تجربة سريرية جمعت بين مثبط آخر لبروتين التحكم في الجهاز المناعي ودواء من المفترض أن يبطئ نمو الورم. في الوقت الذي تم فيه نشر هذا المقال، ظلت البؤر السرطانية لدى بوير مستقرة، وكان بعضها قد تقلص قليلاً.
ليس هناك من ينكر أن العديد من العلاجات أضرت بجسم بوير. تقضي لياليها والعديد من أيامها على أريكة مريحة بسبب آلام الظهر. في معظم الصباح خلال تلك الأسابيع التي لا تتلقى فيها دورة العلاج الحالية، وهي السادسة، تعمل كمهندسة مدنية. وتقضي بقية الوقت في لعب ألعاب الفيديو، وألعابها المفضلة هي Call of Duty. لكنها لا تندم على تجربة ستة علاجات مختلفة للعلاج المناعي حتى الآن. وتقول: "يبدو لي أن بعض هذه العلاجات قد أبطأت النمو إلى حد ما". ويتذكر بوير أن أحد أطبائها "قال إن جزءًا من لعبة سرطان الجلد لا يتمثل بالضرورة في العثور على العلاج المناسب الآن، بل البقاء على قيد الحياة حتى يجدوا العلاج المناسب".
أتطلع قدما
ولأن بوير وغيره من المرضى يعيشون لفترة كافية ليشعروا ببعض الرضا، فإن ميلمان من جينينتيك متحمس. وفيما يتعلق بالعلاج المناعي، فقد بدأت تظهر خيارات تترجم إلى نتائج حقيقية لدى المرضى، كما يقول. لم يعد الباحثون منزعجين من مسألة ما إذا كانت أبحاثهم ستنجح في مساعدة شخص ما في النهاية. وهم يعملون الآن على تحسين العلاجات التي أثبتت فعاليتها. يقول ميلمان: "نحن بحاجة إلى اكتشاف الحدود والقيود ومعرفة كيفية التغلب عليها، ولكن هذه طريقة ملهمة ورائعة للقيام بالعلم".
ويعتقد أن عملية اختيار العلاج المناعي ستصبح في النهاية أكثر منطقية. سيخضع المريض المصاب بورم صلب أولاً لخزعة للبحث عن الخلايا التائية. إذا كان هناك ما يكفي من الخلايا التائية في الورم، فسيتلقى المريض مثبطًا واحدًا لبروتين نقطة التفتيش المناعي، أو ربما حتى عدة مثبطات. (حتى الآن وافقت إدارة الغذاء والدواء الأمريكية على ثلاثة مثبطات لبروتينات نقطة التفتيش، ولكن هناك أكثر من عشرة منها قيد التطوير). إذا لم يجذب الورم العديد من الخلايا التائية، فقد يجرب الأطباء طرقًا أخرى لتحفيز الخلايا المناعية وتحفيزها. يصرفون انتباه جهاز المناعة بلقاح الورم قبل أن يفتحوا نقاط المراقبة.
ويفكر الباحثون أيضًا في كيفية استخدام العلاجات الروتينية، بما في ذلك العلاج الإشعاعي والعلاج الكيميائي، لتحفيز الاستجابة المناعية. إن تدمير بعض الخلايا السرطانية بجرعات أقل من العلاج الكيميائي أو الإشعاعي من شأنه أن يؤدي إلى إطلاق كميات كبيرة من شظايا الخلايا من الورم، وبالتالي تنبيه الجهاز المناعي لإرسال الخلايا التائية إلى بقايا الورم المتبقية. (قد يكون من الصعب تحقيق التوازن الصحيح لأن الكثير من العلاج الكيميائي والإشعاعي يؤدي أيضًا إلى تثبيط أجزاء من الجهاز المناعي). ومن ثم فإن إضافة مثبط بروتين نقطة التفتيش قد يسمح بمحاربة فعالة ضد الورم الضعيف قبل أن تتاح له فرصة التعافي. . لكن العلماء بدأوا للتو في اختبار هذه الفرضيات.
وأخيرًا، مع موافقة إدارة الغذاء والدواء (FDA) على المزيد من أنواع العلاج المناعي، ينشأ تحدي مختلف تمامًا وغير طبي: السعر. يؤدي الجمع بين الأدوية إلى زيادة أسعار العلاجات التي تكون أيضًا باهظة الثمن. تقترب السوق العالمية لأدوية الأورام بالفعل من 100 مليار دولار سنويًا، وفقًا لشركة البيانات الطبية IMS Health، لكن المديرين التنفيذيين لشركات الأدوية يدركون أن شركات التأمين والجمهور لن يكونوا مستعدين أو قادرين على الجمع بين عدد غير محدود من الأدوية بأسعار قد تصل إلى 150,000 ألف دولار. أو أكثر لكل مريض. ويجري الآن دراسة التحسينات في إنتاج الأدوية، والجرعات المنخفضة وفترات العلاج الأقصر، من بين أمور أخرى، من أجل جعل العلاجات أرخص.
ومع ذلك، فإن العلاجات المتاحة اليوم بعيدة كل البعد عن الكمال. ولا يزال كوهلر يشعر بآثار العلاج. إنها تتعب بسهولة أكبر من ذي قبل. عندما تخرج لتناول الغداء مع الأصدقاء، لا تملك دائمًا الطاقة اللازمة للتنزه مع شريكها. وتقول: "الجزء الأصعب هو إلى أي مدى أدفع نفسي". لكن كوهلر قادرة على الاستمتاع بحقيقة تقاعدها بعد العلاج الأول الذي لم يساعدها. تلعب الجولف أو تتنزه سيرًا على الأقدام أو ترتدي أحذية الثلوج عندما يسمح الطقس بذلك. كانت مستوحاة من الكلاب العلاجية التي زارتها أثناء دخولها المستشفى، وأحضرت CJ، كلبها الذهبي المسترد، إلى المدرسة المحلية لمساعدة الطلاب على التخلص من التوتر أثناء الامتحانات. يعتقد أطباء الأورام أن العلاج المناعي سيسمح لهم قريبًا بمنح المزيد من المرضى فرصة للاستمتاع بالحياة مرة أخرى.
لقاح السرطان؟
إن استهداف الخلايا السرطانية باستخدام الحمض النووي الخاص بها يمكن أن يساعد في القضاء على الأورام السرطانية ومنع تكرار المرض.
بقلم بياتريس م. كيرنو وإلين ر. مارديس
لأكثر من عقد من الزمان، حاول الباحثون تسليح نظام الدفاع البشري ضد السرطان بمساعدة اللقاحات. لم تكن هذه الحقن مصممة للوقاية من السرطان في المقام الأول، ولكن لتزويد الجهاز المناعي للمرضى بمعلومات حول شكل العدو، أي الخلايا السرطانية. بشكل عام، لا تبدو الخلايا السرطانية مختلفة جدًا عن الخلايا الطبيعية لتسبب استجابة مناعية، لكننا وجدنا طرقًا لتسليط الضوء على بعض البروتينات التي تنفرد بها الخلايا الخبيثة وتمييزها.
الخلايا البشرية مغلفة بما يسمى بالبروتينات الذاتية التي تعمل كعلامات تعريف لجهاز المناعة. مثل بطاقة الهوية، فهي تسمح للجسم بمعرفة ما إذا كانت أي مادة مملوكة للجسم ولا ينبغي مهاجمتها. ولسوء الحظ، توجد هذه البروتينات أيضًا على سطح الخلايا السرطانية. وربما باءت المحاولات السابقة التي قامت بها مجموعتنا وآخرون لتطوير مركبات بالفشل لأنها شجعت الجهاز المناعي على البحث عن البروتينات الموجودة على سطح كلا النوعين من الخلايا، وإن كان ذلك على مستويات مختلفة.
ومع ذلك، تمكنت مجموعتنا مؤخرًا من التركيز على البروتينات الفريدة للخلايا الخبيثة، وذلك بمساعدة مسح تسلسل الجينوم للخلايا الطبيعية والخلايا الخبيثة لتحديد البروتينات الفريدة للسرطان. نقوم بعد ذلك بالتحقق من البروتينات الفريدة للسرطان التي تسبب رد فعل قويًا للجزيئات المناعية التي يُعتقد أنها توجه استجابة الجسم للمواد الغريبة. تسمى هذه الجزيئات بروتينات معقد التوافق النسيجي (MHC). وبمساعدة هذه المعلومات، يمكننا إنشاء مكونات مخصصة تشمل الخلايا الجذعية من الجهاز المناعي للمريض، وتحتوي على بروتينات MHC التي سترتبط ببروتينات السرطان وتقدمها إلى جهاز المناعة. تساعد هذه الإشارة على إنتاج استجابة مضادة للسرطان للخلايا التائية وتستهدف تدمير الخلايا السرطانية التي تحمل هذه البروتينات المعينة.
وفي عام 2015، جربنا هذا النهج مع ثلاثة مرضى بسرطان الجلد. كما كتبنا في المقال في مجلة Science، اكتشفنا سبعة بروتينات فريدة للسرطان والتي ترتبط بجزيئات MHC لكل مريض. تم التعرف على ثلاثة من البروتينات السبعة بواسطة الخلايا التائية للمرضى، وهاجمت هذه الخلايا التائية الخلايا السرطانية.
وبعد مرور عام، واصل الجهاز المناعي للمرضى إنتاج الخلايا التائية المضادة للسرطان في الدورة الدموية، وهو اكتشاف يشير إلى أن لقاحاتنا قد تمنع تكرار المرض. (في اثنين من المرضى، تقلصت الأورام أو استقرت، لكن بما أنهم تلقوا علاجات إضافية، لا نعرف ما الذي ساعدهم). واليوم، الثلاثة على قيد الحياة ومستقرون وليس لديهم أي آثار جانبية سلبية من اللقاح.
بحثنا لا يزال في المراحل المبكرة. ركزنا في البداية على سرطان الجلد لأنه سرطان يحتوي على العديد من الطفرات والأهداف البروتينية، لكننا نخطط لاختبار هذا النهج مع أنواع أخرى من السرطان أيضًا. قبل أن تصبح طريقتنا جزءًا روتينيًا من علاج السرطان، سيتعين علينا التحقق من مدى تأثيرها على الأورام على المدى الطويل وتقصير وقت تحضير المكونات. الهدف في النهاية هو استخدام هذه المكونات للمساعدة في علاجات السرطان الأخرى. نأمل أن تمنح المكونات المرضى فرصًا أفضل في مكافحة السرطان.
بياتريس م. كارنو هي أستاذة مشاركة في الطب بجامعة واشنطن في سانت لويس. إيلين آر. مارديس هي أستاذة الطب في جامعة روبرت أ. ولويس ك. دان، وأحد مديري معهد ماكدونيل للجينوم في جامعة واشنطن في سانت لويس. يبحث كلاهما في كيفية مساهمة علم المناعة البشرية وعلم جينوم السرطان في تحسين علاج السرطان.
الحرب الجرثومية
يمكن لأنواع معينة من بكتيريا الأمعاء أن تعزز قدرة الجسم على مكافحة الأمراض الخبيثة
بقلم ماريا لويزا أليجرا وتوماس ب. جزيوسكي
لماذا يستجيب بعض المرضى بشكل جيد للأنواع الجديدة من العلاج المناعي للسرطان، بينما لا يستجيب البعض الآخر؟ ومن الممكن أن تلعب المكونات الجينية لأورام المرضى دوراً في ذلك. ومع ذلك، تشير دراساتنا ودراسات العلماء الآخرين الآن إلى أن هناك أيضًا دورًا للاختلافات في الميكروبيوم الخاص بالمرضى، وهي البكتيريا الصديقة التي تتواجد في أجزاء مختلفة من أجسامنا.
يمكن أن تحتوي هذه المجتمعات البكتيرية، وخاصة تلك الموجودة في الأمعاء، على أنواع مختلفة من البكتيريا. وتؤثر هذه الأنواع بدورها على شدة الاستجابة الالتهابية للجهاز المناعي للمضيف في آليات لم يتم فهمها بالكامل بعد. هناك بكتيريا تسبب رد فعل التهابي مبالغ فيه يؤدي إلى تحول الخلايا الطبيعية إلى سرطانية أو تدرب خلايا الجهاز المناعي عن طريق الخطأ على مهاجمة الأنسجة السليمة في المفاصل، كما هو الحال في التهاب المفاصل الروماتويدي.
في بعض الأحيان يمكن للبكتيريا أيضًا أن تؤدي إلى استجابة مناعية علاجية. قامت مجموعتنا البحثية، في جامعة شيكاغو، بدراسة فئران متطابقة وراثيا تمتلك ميكروبيومات مختلفة لأنها نشأت في بيئات مختلفة. وبعد حقن الفئران بخلايا سرطان الجلد الميلانينية، نمت الأورام ببطء في مجموعة واحدة وبشكل أسرع في المجموعة الأخرى. كما أن الفئران التي نمت أورامها ببطء كان لديها أيضًا استجابة مناعية أقوى ضد الورم. ومن المثير للإعجاب أن زرع الميكروبيوم من البكتيريا ذات الأورام البطيئة في المجموعة الثانية من الفئران - والذي يتم عن طريق نقل البراز بين الحيوانات - أدى إلى إبطاء نمو الأورام في المجموعة الثانية أيضًا.
وفي تحليل الحمض النووي لعينات البراز لمجموعتي الفئران، اكتشفت مجموعتنا نوعين من البكتيريا من نوع Bifidobacterium المسؤولة على ما يبدو عن تحسين النشاط المضاد للسرطان. ويكفي تغذية الفئران بسلالة واحدة من البكتيريا إما Bifi dobacterium longum أو Bifi dobacterium breve لتحفيز جهاز المناعة وإبطاء نمو الأورام لدى الفئران. إن وجود هذه البكتيريا المفيدة هو الذي يحدد مدى فعالية العلاج المناعي الجديد (انظر المقال الرئيسي). اختفت الأورام تمامًا في الفئران التي عولجت بمثبط بروتين التحكم المناعي، وشمل الميكروبيوم الخاص بها أنواعًا من البكتيريا Bifidobacterium. في حين أن الفئران التي لا تحتوي على هذه البكتيريا شهدت استجابة جزئية فقط للدواء ولكنها تعافت إذا تم تغذيتها أيضًا بالسلالات الصحيحة من البكتيريا.
وأجرت مجموعة أخرى من الباحثين، خاصة في فرنسا، تجربة مماثلة مع مثبط آخر لبروتينات التحكم. ووجدوا أن نوعًا آخر من البكتيريا، Bacteroides، سمح للفئران بالقضاء على الأورام المحقونة. وعندما أعطيت الحيوانات المضادات الحيوية التي قتلت البكتيريا، فقدت الأدوية المضادة للسرطان فعاليتها، وهي النتيجة التي ينبغي أن تثير اهتمام الأطباء في ضوء العدد الكبير من مرضى السرطان الذين يتلقون المضادات الحيوية. نُشرت نتائج الدراسات التي أجرتها مجموعات البحث في فرنسا وشيكاغو في نوفمبر 2015 في مجلة Science.
من الواضح أنه من الضروري تصنيف البكتيريا الموجودة في الميكروبيوم البشري وتأثيراتها المفترضة المضادة للسرطان بشكل أفضل قبل أن نتمكن من التوصية بأي علاجات للبشر. في حين يبدو أن البكتيريا مثل Bifidobacterium لها تأثير مفيد، فإن سلالات أخرى قد تسمح للأورام بالنمو بشكل أسرع. (قد لا ينجح تناول الزبادي لتعزيز جهاز المناعة أيضًا. غالبًا ما يحتوي الزبادي على بكتيريا Bifidobacteriumlactis أو Bifidobacterium bifidum، وقد لا يكون لها نفس تأثير السلالات في دراسات الفئران.) كما أن الأطباء لن يرغبوا في تعزيز المناعة. النظام أكثر من اللازم لتجنب التسبب في أمراض المناعة الذاتية.
ماريا لويزا أليجرا أستاذة في قسم الطب بجامعة شيكاغو. توماس ب. جزيوسكي هو أستاذ في قسم علم الأمراض وقسم الطب في جامعة شيكاغو.
