لقد أظهر علماء معهد وايزمان للعلوم أن البروتينات المضطربة تتكيف بشكل جيد مع التغيرات البيئية في الخلية وتشكل شبكات مقاومة من البروتينات التي تعمل معًا وبالتالي تغطي نقص التنظيم
إن اسم "البروتينات المختلة" في حد ذاته يشير إلى وجود خطأ ما في البروتينات التي لا يتم طيها بدقة إلى هياكل ثلاثية الأبعاد، ولكنها بدلاً من ذلك تتدلى بحرية مثل المعكرونة. وتشير دراسة جديدة أجراها علماء معهد وايزمان للعلوم، ونشرت مؤخرا في "سجلات الأكاديمية الأمريكية للعلوم" (PNAS)، إلى مزايا هذه البروتينات: فهي تتكيف بشكل جيد مع التغيرات البيئية داخل الخلية، ونقص التنظيم. لا يمنعهم من العمل بشكل جيد.
يقول الدكتور هاجن هوفمان من قسم البيولوجيا الهيكلية: "الكائنات الأكثر تطورًا لديها بروتينات مضطربة أكثر مقارنة بكمية هذه البروتينات في البكتيريا". "إن حقيقة أن هذه البروتينات اكتسبت موطئ قدم في مرحلة متأخرة نسبيًا من التطور ربما تشير إلى التعقيد والتعقيد، ولكن ما الذي تحتاجه الطبيعة بالضبط؟"

عندما تم اكتشاف الأجزاء المضطربة من جزيئات البروتين لأول مرة في أواخر الثمانينيات، اعتاد العلماء على قطعها والتخلص منها، لأنه كان من المستحيل تحويلها إلى بلورات ودراسة بنيتها باستخدام علم البلورات. ومع ذلك، مع مرور الوقت، أصبح من الواضح أن الحالة الفوضوية أكثر شيوعًا مما كان يعتقد في البداية: حوالي ثلث البروتينات الموجودة في الجسم تكون مضطربة بدرجة أو بأخرى؛ في كثير منها، يكون جزء معين فقط من الجزيء مضطربًا، وفي حالات أخرى - في الجزيء بأكمله. تم اكتشاف أيضًا أن البروتينات المضطربة هي على ما يبدو نوع مهم من الجزيئات البيولوجية التي تشارك في تنظيم نشاط الجينات والوظائف الأساسية الأخرى. علاوة على ذلك، من الممكن في ظل ظروف معينة أن تتمتع بميزة على البروتينات المرتبة: فهي أسهل في التغيير أو التفكيك عندما تتغير البيئة، وقد تكون أكثر ملاءمة لأداء مهام مختلفة، لأن بنيتها أكثر انفتاحًا، بالمعنى الحرفي للكلمة، على البروتينات المرتبة. التواصل مع الجزيئات الأخرى مقارنة بالهيكل المطوي الذي يتطلب تعديلًا هيكليًا دقيقًا.
التعبير الجيني
ولكن إذا كانت البروتينات المضطربة مرنة جدًا من حيث البنية والوظيفة، فهل تكون متينة بما يكفي لأداء مهام مهمة؟ قام الدكتور رينيه وينكرانينبروك ويائير هاريل من مجموعة الدكتور هوفمان، بالتعاون مع البروفيسور وينوي تشانغ من جامعة ولاية أريزونا، بالإجابة على هذا السؤال. أولاً، قاموا باختبار مدى حساسية البروتينات المضطربة للتغيرات في البيئة داخل الخلايا. وركز العلماء على شبكة مكونة من أكثر من 100 بروتين تنظم التعبير الجيني في الخلية واختاروا منها خمسة بروتينات مضطربة تعمل معًا وتؤدي أدوارًا رئيسية ضمن شبكة البروتين هذه. وقام الباحثون بربط علامات الفلورسنت الحمراء والخضراء على طرفي كل جزيء بروتين، ووضعوا البروتينات في محلول وشاهدوها عبر المجهر، مع تغيير تركيز الأملاح في المحلول، على غرار التغيرات في تركيز الأملاح التي تحدث في كثير من الأحيان في الخلايا الحية. تشير النسبة بين الضوء المنبعث من العلامات الحمراء والخضراء إلى حدوث تغييرات هيكلية في جزيئات البروتين.
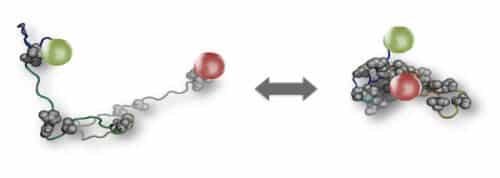
كشفت هذه التجربة أن جميع البروتينات الخمسة المضطربة كانت حساسة للتغيرات البيئية: حيث تغيرت بنيتها ثلاثية الأبعاد وفقًا للتغيرات في تركيز الملح في المحلول. ومع ذلك، من المثير للدهشة أن الحسابات التي أجراها الباحثون بناءً على البيانات التجريبية أظهرت أن التغييرات لم تؤثر على وظيفة شبكة البروتين. وذلك لأن البروتينات الخمسة تغيرت بطريقة منسقة - فقد تضخمت أو تقلصت معًا استجابة لتغير معين - بحيث ظلت الوظيفة العامة للشبكة دون تغيير. يقول الدكتور هوفمان: "لقد أظهرنا أن البروتينات المضطربة حساسة لبيئتها"، ويضيف: "لكننا أظهرنا أيضًا أن الشبكة التي ينشئونها تخفي هذه الحساسية وتظل مستقرة بما يكفي لمواصلة العمل على الرغم من التغييرات".
تشير هذه النتائج إلى أن البروتينات المضطربة تشكل شبكات مقاومة مناسبة للقيام بالمهام الأساسية في الخلية. وقد تسلط النتائج الضوء على العمليات الخلوية التي تشارك فيها هذه البروتينات. على سبيل المثال، تلعب البروتينات المضطربة أدوارًا رئيسية في الإصابة بالسرطان، بما في ذلك مثبط الورم المعروف P53 والجين الورمي المسمى c-Myc.
حوالي 50% من حساسية البروتينات المضطربة للبيئة داخل الخلايا ترجع إلى حقيقة أنها مضطربة.
