منحت الأكاديمية السويدية للعلوم اليوم جائزة نوبل في الكيمياء لعام 2019 لثلاثة باحثين لمساهمتهم في تطوير بطارية أيون الليثيوم: بانيستر جوديناف، ومانلي ستانلي ويتنجهام، وأكيرا يوشينو. ورغم أن هذا اختراع من السبعينيات، إلا أن اليوم هناك تقدم في هذا المجال بفضل الحاجة إلى تمديد المسافة التي تسمح بها البطاريات في السيارات الكهربائية

منحت الأكاديمية السويدية للعلوم اليوم جائزة نوبل في الكيمياء لعام 2019 لثلاثة باحثين لمساهمتهم في تطوير بطارية أيون الليثيوم: بانيستر جوديناف، ومانلي ستانلي ويتنجهام، وأكيرا يوشينو.
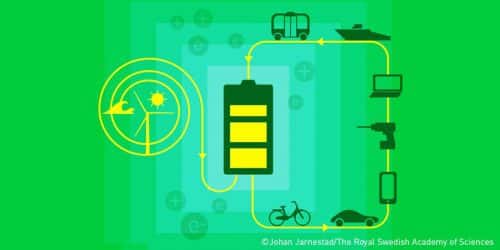
أحدثت بطاريات الليثيوم أيون طفرة في جميع جوانب حياتنا، وتستخدم في العديد من المجالات، من الهواتف المحمولة إلى أجهزة الكمبيوتر المحمولة والمركبات الكهربائية. وبفضل أبحاثهم، وضع الفائزون بجائزة نوبل في الكيمياء لعام 2019 الأساس لمجتمع لاسلكي وخالي من الوقود الأحفوري. وتعمل شركات مختلفة حاليا على تطوير بطاريات ذات قدرة هائلة تسمح بتخزين الطاقة المنتجة من الشمس نهارا لاستخدامها ليلا لتسهيل التحول إلى الطاقة المتجددة. في الواقع، هذه جائزة كلاسيكية وفقًا لروح وصية ألفريد نوبل، وهي أن الجائزة يجب أن تُمنح للاختراعات التي تعمل على تقدم الإنسانية.
في أوائل السبعينيات، استخدم ستانلي ويتنجهام، الحائز على جائزة نوبل في الكيمياء لهذا العام، الطاقة النشطة لذرة الليثيوم لإطلاق إلكترونها الحر الخارجي أثناء تطوير أول بطارية ليثيوم عاملة على الإطلاق.
قام جون بانيستر جوديناف، الحائز على جائزة نوبل في الكيمياء لعام 2019، بمضاعفة إمكانات بطارية الليثيوم أيون، مما خلق الظروف المناسبة للحصول على المزيد من الطاقة من البطارية.
ونجح الحائز على جائزة نوبل في الكيمياء لعام 2019، أكيرا يوشينو، عام 1981 في استبدال الليثيوم النقي والقابل للاشتعال من البطارية واستخدام أيونات الليثيوم بدلا من ذلك، وهي أكثر أمانا من الليثيوم النقي. سمح هذا الاستبدال للباحثين بتوفير منتج نهائي وآمن للصناعة والحياة اليومية.
قام الفائزون بجائزة نوبل في الكيمياء لهذا العام بتطوير أقوى بطارية في العالم
نادرًا ما يحتل عنصر مركز الصدارة في الدراما، لكن قصة جائزة نوبل في الكيمياء لعام 2019 لها شخصية رئيسية: الليثيوم، وهو عنصر قديم تم إنشاؤه خلال الدقائق الأولى من الانفجار الكبير. وقد عرفت البشرية ذلك في عام 1817، عندما عزله الكيميائيان السويديان يوهان أوغست أرفودسون وفينس جاكوب بيرسيليوس من عينة معدنية جاءت من منجم في السويد.
أطلق بيرسيليوس على العنصر الجديد اسم الليثيوم على اسم الكلمة اليونانية التي تعني الحجر، الليثوس. إنه أخف عنصر صلب، وهي حقيقة تفسر لماذا بالكاد نشعر اليوم بثقل الهواتف المحمولة في جيوبنا. ولكي نكون منصفين، فإن الكيميائيين السويديين لم يجدوا في الواقع الليثيوم المعدني النقي، ولكن أيونات الليثيوم في شكل ملح. تسبب الليثيوم النقي في العديد من إنذارات الحرائق، على الرغم من قابليته العالية للاشتعال - فهو عنصر غير مستقر يجب حفظه في الزيت حتى لا يتفاعل مع الهواء ويشتعل.
ضعف الليثيوم - تفاعله العالي - هو أيضًا مصدر قوته. في أوائل السبعينيات، استخدم ستانلي ويتنجهام الطاقة النشطة لذرة الليثيوم لتحرير الإلكترون الحر الخارجي أثناء تطوير أول بطارية ليثيوم تعمل على الإطلاق. في عام 1980، قام جون جودنوف بمضاعفة إمكانات بطارية الليثيوم أيون، مما أدى إلى خلق الظروف المناسبة للحصول على المزيد من الطاقة من البطارية. في عام 1985، تمكن أكيرا يوشينو من استبدال الليثيوم النقي والقابل للاشتعال من البطارية واستخدام أيونات الليثيوم بدلاً من ذلك، وهي أكثر أمانًا من الليثيوم النقي. سمح هذا الاستبدال للباحثين بتوفير منتج نهائي وآمن للصناعة والحياة اليومية. لقد قدمت بطاريات الليثيوم أيون للبشرية أعظم فائدة على الإطلاق، حيث أنها سمحت بتطوير أجهزة الكمبيوتر المحمولة والهواتف المحمولة والمركبات الكهربائية وتمكين تخزين الطاقة المولدة من الطاقة الشمسية وطاقة الرياح.
والآن، لنعد خمسين عامًا إلى بداية قصة بطارية الليثيوم أيون.
تعمل أبخرة البنزين على إحياء أبحاث البطاريات
وفي منتصف القرن العشرين، زاد عدد السيارات التي تعمل بالبنزين بشكل ملحوظ، كما أدت أبخرة العوادم الناتجة عن قيادتها في الشوارع إلى تفاقم حالة الضباب الدخاني الضار الذي يلف المدن الكبيرة. هذا الوضع، بالإضافة إلى الاعتراف المتزايد بين عامة الناس بأن النفط ومنتجاته مصدر مستنزف للطاقة، دق ناقوس الخطر لكل من شركات صناعة السيارات وشركات النفط. وكان مطلوبًا منهم الاستثمار في السيارات الكهربائية ومصادر الطاقة البديلة إذا أرادوا الاستمرار في البقاء.
تتطلب السيارات الكهربائية ومصادر الطاقة البديلة بطاريات قوية يمكنها تخزين كميات كبيرة من الطاقة. في ذلك الوقت لم يكن هناك سوى نوعين فقط من البطاريات القابلة لإعادة الشحن في السوق: بطارية الرصاص الثقيلة التي تم اختراعها عام 1859 (والتي لا تزال تستخدم كبطارية تشغيل في المركبات التي تعمل بالبنزين) وبطارية النيكل والكادميوم التي تم تطويرها في النصف الأول من القرن العشرين.
شركات النفط تستثمر في التكنولوجيا الجديدة
الخوف من النفط الموجود في الأرض دفع شركة النفط العملاقة إكسون إلى اتخاذ قرار بتنويع أنشطتها. وكجزء من استثمارها الكبير في الأبحاث الأساسية، قامت الشركة بتوظيف عدد من الباحثين الذين كانوا روادًا في مجالهم في ذلك الوقت في مجال الطاقة، وأعطتهم حرية البحث بقدر ما يريدون، طالما أن اهتماماتهم كانت عالية. البحث لم يتناول النفط.
كان الباحث ستانلي ويتنجهام أحد هؤلاء الباحثين الذين جاءوا إلى شركة إكسون في عام 1972. لقد جاء من جامعة ستانفورد، حيث درس المواد الصلبة ذات الفراغات ذات الحجم الذري التي يمكن للأيونات أن ترتبط بها. وتسمى هذه الظاهرة الإقحام. تتغير خصائص المادة عندما تحبس الأيونات داخلها. وفي شركة إكسون، بدأ ستانلي ويتنجهام وزملاؤه في البحث عن مواد فائقة التوصيل، بما في ذلك ثاني كبريتيد التنتالوم، الذي يمكنه حبس الأيونات داخلها. أضافوا الأيونات إلى المادة ودرسوا كيف يؤثر ذلك على التوصيل الكهربائي للمادة.
يكتشف ويتنغهام مادة ذات طاقة عالية بشكل خاص
وكما يحدث في العلم، أدت هذه التجربة إلى اكتشاف قيم وغير متوقع. اتضح أن أيونات البوتاسيوم تؤثر على توصيل ثاني كبريتيد التنتالوم، وعندما بدأ ستانلي ويتنجهام بدراسة المادة بالتفصيل لاحظ أنها تتمتع بكثافة طاقة عالية جدًا. ومن المثير للدهشة أن التفاعلات بين أيونات البوتاسيوم وثاني كبريتيد التنتالوم كانت عالية الطاقة، وعندما قام بقياس جهد المادة، كانت القيمة عدة فولت. وكانت هذه النتيجة أفضل من العديد من البطاريات المتوفرة في ذلك الوقت. وسرعان ما أدرك ستانلي أن الوقت قد حان لتغيير المسار وبدأ في تطوير تكنولوجيا جديدة يمكنها تخزين الطاقة للسيارات الكهربائية في المستقبل. إلا أن التنتالوم يعد من العناصر الأثقل ولم يكن السوق التجاري بحاجة إلى بطاريات ثقيلة إضافية - لذلك استبدل التنتالوم بالتيتانيوم، وهو عنصر مشابه في خصائصه ولكنه أخف وزنا.
الليثيوم في القطب السالب
لم يكن اختيار الليثيوم اختيارًا عشوائيًا؛ في البطارية، من المفترض أن تتدفق الإلكترونات من القطب السالب - الأنود - إلى القطب الموجب - الكاثود. ولذلك يجب أن يحتوي الأنود على مادة تتخلى عن إلكتروناتها بسهولة، ومن بين جميع العناصر المعروفة لدينا، يعتبر الليثيوم هو العنصر الذي يتخلى عن إلكتروناته بسهولة أكبر.
وكانت النتيجة بطارية ليثيوم قابلة لإعادة الشحن تعمل في درجة حرارة الغرفة مع إمكانات هائلة. سافر ستانلي ويتنجهام إلى المقر الرئيسي لشركة إكسون في نيويورك لعرض مشروعه. استمر الاجتماع لمدة خمسة عشر دقيقة واتخذ عضو مجلس الإدارة قرارًا سريعًا: سيقومون بتطوير بطارية تجارية بناءً على اكتشاف ويتنجهام.
احتوت البطاريات الأولى القابلة لإعادة الشحن على مواد صلبة في الأقطاب الكهربائية، والتي تتحلل في تفاعل كيميائي مع المنحل بالكهرباء. هذا الوضع دمر البطارية. تكمن ميزة بطارية الليثيوم التي ابتكرها ويتنغهام في حقيقة أن أيونات الليثيوم تم تخزينها في الفراغات داخل ثاني كبريتيد التيتانيوم الذي يتكون من الكاثود. عند استخدام البطارية، تنتقل أيونات الليثيوم من الليثيوم الموجود في الأنود إلى ثاني كبريتيد التيتانيوم في الكاثود. عندما يتم شحن البطارية، تتحرك أيونات الليثيوم في الاتجاه المعاكس.
تنفجر البطارية وينخفض سعر النفط
ولسوء الحظ، تعرضت المجموعة البحثية التي تستعد لتصنيع البطارية لعدد من المطبات. عندما خضعت بطارية الليثيوم للشحن المتكرر، تشكلت طبقة رواسب من الليثيوم على قطب الليثيوم. عندما وصلت جزيئات هذه الطبقة إلى القطب المضاد، تعرضت البطارية لدائرة كهربائية قصيرة يمكن أن تؤدي إلى انفجار. اضطر قسم الإطفاء إلى إطفاء العديد من الحرائق، وفي النهاية هددوا بإلزام المختبر بدفع ثمن المواد الكيميائية الخاصة المستخدمة لإطفاء حرائق الليثيوم.
ومن أجل جعل البطارية أكثر أمانًا، أضاف الباحثون الألومنيوم إلى قطب الليثيوم المعدني واستبدلوا المنحل بالكهرباء بين الأقطاب الكهربائية. أعلن ستانلي ويتنجهام عن اكتشافه عام 1976 وبدأت الشركة بإنتاج هذه البطارية على نطاق صغير لصالح صانع ساعات سويسري أراد استخدامها في الساعات التي تعمل بالطاقة الشمسية.
وكان الهدف التالي هو زيادة حجم إنتاج بطارية الليثيوم القابلة لإعادة الشحن حتى تتمكن من تشغيل السيارة. ومع ذلك، انخفض سعر النفط بشكل كبير في أوائل الثمانينات، واضطرت شركة إكسون إلى إجراء تخفيضات. تم تجميد أعمال التطوير وتم نقل براءة اختراع تكنولوجيا البطاريات الخاصة بـ Whittingham إلى ملكية ثلاث شركات تقع في ثلاثة أجزاء مختلفة من العالم. إلا أن هذا الوضع لم يؤد إلى توقف التنمية. وعندما استسلمت شركة إكسون، واصل الباحث جوديناف أعمال التطوير.
أزمة النفط جعلت Goodenough مهتمًا بالبطاريات
عندما كان طفلا، واجه جون جودنوف مشاكل خطيرة في تعلم القراءة، وهي حقيقة قادته إلى دراسة الرياضيات وفي نهاية المطاف - بعد الحرب العالمية الثانية - إلى دراسة الفيزياء أيضا. عمل لسنوات عديدة في مختبر لينكولن في معهد ماساتشوستس للتكنولوجيا (MIT). وأثناء عمله هناك، ساهم في تطوير تقنية ذاكرة الوصول العشوائي (RAM) التي لا تزال مكونًا أساسيًا لأجهزة الكمبيوتر حتى اليوم.
جون جوديناف، مثل الكثير من الأشخاص في السبعينيات، تأثر بأزمة النفط وأراد المساهمة في تطوير مصادر الطاقة البديلة. ومع ذلك، تم تمويل مختبر لينكولن من قبل القوات الجوية الأمريكية التي لم تسمح بأي نوع من البحث، ولذلك عندما عُرض عليه منصب أستاذ الكيمياء غير العضوية في جامعة أكسفورد في بريطانيا العظمى، استغل الفرصة و دخلت المجال المهم لأبحاث الطاقة.
يتم الحصول على جهد عالي عندما يتم إخفاء أيونات الليثيوم داخل أكسيد الكوبالت
كان جون جوديناف على دراية ببطارية ويتنغهام الثورية، لكن معرفته المتعمقة بالمادة الداخلية للأقطاب الكهربائية قادته إلى استنتاج أنه يمكنه تحقيق إمكانات أعلى إذا استبدل كبريتيد المعدن بأكسيد فلز. بعد ذلك، تم تكليف العديد من الباحثين في مجموعته البحثية بإيجاد أكسيد فلز من شأنه أن يولد جهدًا عاليًا عندما يتفاعل مع أيونات الليثيوم، ولكنه لن ينهار عند طرح الأيونات منه.
كانت هذه الدراسة المنهجية أكثر نجاحًا بكثير مما حلم به جون جودنوف. أنتجت بطارية ويتنجهام أكثر من 2 فولت، لكن جودنوف وجد أن البطارية التي تحتوي على أكسيد الليثيوم والكوبالت عند الكاثود كانت أقوى بمرتين تقريبًا، مما أدى إلى إنتاج ما قيمته أربعة فولت.
أحد أسباب هذا النجاح هو فهم جون جوديناف أنه ليس من الضروري تصنيع البطاريات في حالتها المشحونة، كما كان معتادًا في الماضي. وبدلاً من ذلك، يمكن إعادة شحنها بعد ذلك. وفي عام 1980، نشر اكتشاف مادة الكاثود الجديدة عالية الطاقة، والتي كانت أيضًا خفيفة الوزن، مما أدى إلى تطوير بطاريات قوية ذات سعة طاقة عالية. لقد كانت خطوة واضحة نحو الثورة اللاسلكية.
تقوم الشركات اليابانية بتطوير بطاريات خفيفة الوزن للمكونات الإلكترونية الجديدة
ومع ذلك، في الغرب، مع انخفاض أسعار النفط، زاد الاهتمام بالاستثمار في تكنولوجيا الطاقة البديلة وتطوير السيارات الكهربائية. كانت الأمور مختلفة في اليابان، حيث كانت شركات الإلكترونيات هناك يائسة بالفعل في بحثها عن بطاريات خفيفة الوزن قابلة لإعادة الشحن يمكنها تشغيل المكونات الإلكترونية المبتكرة، مثل كاميرات الفيديو والهواتف اللاسلكية وأجهزة الكمبيوتر. أحد الأشخاص الذين أدركوا هذه الحاجة كان أكيرا يوشينو من أساهي كاسي. أو كما قال: "لقد استنشقت ببساطة الاتجاه الذي تتجه إليه الاتجاهات. يمكنك القول أن لدي حاسة شم جيدة."
قام يوشينو بتجميع أول بطارية ليثيوم أيون تجارية
عندما قرر أكيرا يوشينو تطوير بطارية وظيفية قابلة لإعادة الشحن، كان على دراية بكاثود جوديناف المكون من أكسيد الليثيوم والكوبالت، وبالتالي حاول استخدام العديد من المواد المعتمدة على الكربون كالأنود. كان الباحثون يعرفون بالفعل أنه يمكن دمج أيونات الليثيوم بين الطبقات الجزيئية للجرافيت، لكن الجرافيت تفكك عند ملامسته للإلكتروليت الموجود في البطارية. جاءت فكرة أكيرا يوشينو الثورية عندما حاول بدلاً من ذلك استخدام فحم الكوك، وهو منتج ثانوي لصناعة النفط. عندما قام بشحن فحم الكوك بالإلكترونات، تم سحب أيونات الليثيوم إلى المادة. بعد ذلك، عندما قام بتشغيل البطارية، تدفقت الإلكترونات وأيونات الليثيوم نحو أكسيد الكوبالت في الكاثود، الذي كان له إمكانات أعلى.
تتميز البطارية التي طورها أكيرا يوشينو بأنها مستقرة وخفيفة الوزن وعالية السعة وتنتج جهدًا عاليًا يبلغ أربعة فولت. أكبر ميزة لبطارية الليثيوم أيون هي أن الأيونات مدمجة داخل الأقطاب الكهربائية. تعتمد معظم البطاريات الأخرى على تفاعلات كيميائية، تتغير بعدها الأقطاب الكهربائية بشكل مؤكد، حتى لو بمعدل بطيء. عند شحن أو استخدام بطارية ليثيوم أيون، تتدفق الأيونات بين الأقطاب الكهربائية دون التفاعل مع بيئتها. وهذا يعني أن البطارية تتمتع بعمر طويل ويمكن شحنها مئات المرات قبل أن يصبح أداؤها سيئًا.
ميزة كبيرة أخرى تكمن في حقيقة أن البطارية لا تحتوي على الليثيوم النقي. في عام 1986، عندما اختبر أكيرا يوشينو سلامة البطارية، اتخذ الاحتياطات اللازمة باستخدام جهاز خاص مصمم لاختبار الأجهزة التي لديها القدرة على الانفجار. لقد أسقط قطعة كبيرة من الحديد فوق البطارية، ولكن لم يحدث شيء. لكن تكرار التجربة مع بطارية تحتوي على الليثيوم النقي أدى إلى انفجار خطير.
كان نجاح البطارية في اجتياز اختبار السلامة أمرًا بالغ الأهمية لمستقبل البطارية. يقول أكيرا يوشينو إن هذه كانت "اللحظة التي ولدت فيها بطارية الليثيوم أيون".
تعد بطارية الليثيوم أيون ضرورية لمجتمع خالٍ من الوقود الأحفوري
في عام 1991، بدأت شركة إلكترونيات يابانية كبيرة في بيع أول بطاريات ليثيوم أيون، مما أحدث ثورة في عالم الإلكترونيات. وتقلص حجم الهواتف المحمولة، وأصبحت أجهزة الكمبيوتر محمولة، وتم تطوير مشغلات الموسيقى وأجهزة الكمبيوتر اللوحية لأول مرة.
وعلى إثر ذلك، قام الباحثون في جميع أنحاء العالم بمسح الجدول الدوري للعناصر من أجل تطوير بطاريات أكثر كفاءة، لكن لم ينجح أي منهم حتى الآن في اختراع نظام أكثر كفاءة من بطارية الليثيوم أيون من حيث السعة والجهد الذي تنتجه . ومع ذلك، فقد تم تعديل وتحسين بطارية الليثيوم أيون: ومن بين التحسينات الأخرى، قام الباحث جون جودنوف باستبدال أكسيد الكوبالت بفوسفور الحديد، وهو بديل يجعل البطارية أكثر صداقة للبيئة.
مثل كل شيء آخر، فإن إنتاج بطاريات الليثيوم أيون له أيضًا تأثير ضار على البيئة، ولكن لهذه البطاريات أيضًا العديد من الفوائد البيئية. مكنت البطاريات من تطوير تقنيات الطاقة النظيفة وتطوير السيارات الكهربائية، وبالتالي ساهمت في تقليل انبعاث الغازات الدفيئة والجسيمات الضارة.
بفضل عملهم، قام الباحثون جون جوديناف وستانلي ويتنجهام وأكيرا يوشينو بتهيئة الظروف المناسبة لمجتمع لاسلكي وخالي من الوقود الأحفوري، وبالتالي قدموا أكبر مساهمة للبشرية.
المزيد عن الموضوع على موقع العلوم:
بطاريات الليثيوم من الجيل التالي: مدة نشاط أطول، ووقت شحن أقل
مادة مبتكرة يمكن أن تحدث طفرة في مركبات الهيدروجين
بناء بطاريات أفضل
تقوم إسرائيل باختبار الشحن اللاسلكي للسيارات الكهربائية
