يتم إنتاج الهيدروجين عن طريق تعريض مجموعات من ذرات الألومنيوم للماء
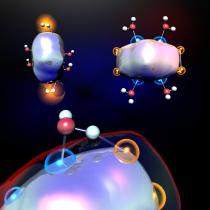
اكتشف علماء من جامعة ولاية بنسلفانيا وجامعة فرجينيا طريقة لإنتاج الهيدروجين عن طريق تعريض مجموعات من ذرات الألومنيوم للماء. هذه النتائج مهمة لأنها تثبت أن هندسة هذه العناقيد بالتحديد، وليس خصائصها الإلكترونية وحدها، هي التي تؤثر على وظيفة المواقع النشطة المكشوفة في العناقيد. ولهذه المواقع أهمية كبيرة في تحديد النشاط مع الماء. ونشرت النتائج التي توصل إليها فريق البحث في عدد يناير من مجلة ساينس العلمية.
"في بحثنا السابق، اقترحنا أن الخصائص الإلكترونية تتحكم في سلوك هذه العناقيد، لكن هذه الدراسة الجديدة تظهر أن الترتيب المكاني للذرات داخل هذه العناقيد هو بالضبط ما يسمح لها بكسر حاجز الماء"، قال أ. ويلفورد كاسلمان أستاذ الكيمياء والفيزياء بالجامعة. "من حيث المبدأ، قد تسمح لنا هذه المعرفة بتصميم محفزات نانومترية مبتكرة عن طريق تغيير الترتيب المكاني للذرات داخل الركام. يمكن أن توفر النتائج طرقًا جديدة للبحث، ليس فقط لتقسيم الماء، ولكن أيضًا لتقسيم روابط المركبات الأخرى، بالإضافة إلى ذلك."
قام فريق البحث بفحص تفاعلات الماء مع مجاميع كيمران الفردية من خلال دمجها معًا تحت ظروف خاضعة للرقابة في مفاعل تدفق مصمم خصيصًا لهذا الغرض. لقد وجدوا أن جزيء الماء سوف يرتبط بين موقعين من كيمران في مجاميع فقط حيث يعمل أحد هذه المواقع كحمض لويس (مركز مشحون إيجابيًا "يفضل" استقبال الإلكترون) والآخر كقاعدة لويس (مركز سالب). مركز مشحون "يفضل" التخلي عن إلكترون منه). ترتبط ذرة الحمض التي تعمل كحمض لويس بذرة الأكسجين في جزيء الماء بينما يفصل النوع الآخر من ذرة الحمض، وهو قاعدة لويس، ذرة هيدروجين واحدة عنها. وإذا حدثت هذه العملية مرة ثانية مع نظام آخر مكون من ذرتي هيدروجين نشطتين وذرة ماء، فسيتم الحصول على ذرتي هيدروجين يمكن أن تتحدا معًا لتكوين ذرة غاز الهيدروجين - H2.
ووجد الفريق أن سيوف حمران تتفاعل بشكل مختلف عند تعرضها للماء، اعتمادًا على حجم السيوف وبنيتها المكانية الخاصة. ثلاثة أنواع من البطاريات ستنتج الهيدروجين من الماء في درجة حرارة الغرفة. وقال الباحث: "إن القدرة على إنتاج الهيدروجين في درجة حرارة الغرفة أمر مهم لأنه يعني أنه لا يلزم استثمار الطاقة أو الحرارة لإثارة التفاعل".
"إن الطرق الشائعة لتقسيم الماء لإنتاج الهيدروجين تتطلب كمية كبيرة من الطاقة. ومع ذلك، من خلال طريقتنا، من الممكن إنتاج الهيدروجين دون استثمار الحرارة، أو توصيله ببطارية أو مصدر آخر للكهرباء. ومنذ لحظة تجهيز صهاريج التخمير، أصبحت قادرة على إنتاج الهيدروجين حسب الطلب دون الحاجة إلى تخزينه".
ويأمل الباحث أن توفر النتائج التي توصلت إليها المجموعة طريقة لفحص القدرة على إعادة تدوير هذه الركام والقدرة على التحكم في الظروف الدقيقة لإطلاق الهيدروجين. ويوضح قائلاً: "يبدو أننا قادرون على تطوير طرق لإزالة مجموعة الهيدروكسيل التي تظل مرتبطة بمجموعات الخميرة بعد استخلاص الهيدروجين بحيث يمكن استخدامها مراراً وتكراراً". يخطط الفريق لمواصلة أبحاثهم بهدف تحسين طريقتهم المبتكرة قدر الإمكان.

تعليقات 8
لا تتشوش. الترجمة ليست دقيقة. تحتوي مجموعات الهيدروجين على طاقة وبعد إطلاق الهيدروجين تكون إمكانات الطاقة الخاصة بها -0- وبالتالي فإن الخطوة برمتها مكلفة وغير اقتصادية. بشكل عام، كفاءة العملية منخفضة. تتطلب الاستعدادات الكثير من الطاقة، لذلك تحصل في نهاية العملية على الهيدروجين ولكن بكفاءة منخفضة.
من الواضح أنه لا يوجد هنا محيط محيطي رائد، ولا حتى أي شيء قريب منه. مصطلح التحليل الكهربائي يعني التفريغ الكهربائي (أو التوصيل) نظرًا لحقيقة أن الطاقة الكهربائية تستثمر باستمرار وبالتالي فهي ليست آلة تعمل "هناك أيون"
باختصار، أفهم أيضًا أنه لا يوجد دليل رئيسي هنا، لذا فإن المقالة غير موجودة
مساء الخير
سابدارمش يهودا
يهودا:
وهذا ليس استمرارًا رائدًا لأن العملية تحول الطاقة الكيميائية.
في النهاية، لكي يعمل العمل، يجب إحضار الأكسجين والألومنيوم من مكان ما، ويحملان معهم الطاقة الكيميائية المفقودة.
إذا قمت بالربط بين التعليقين، فستتمكن من إنشاء العلاقة بينهما.
على ما يبدو - سيتطلب فصل الهيدروكسيل عن الخميرة بالفعل جزءًا كبيرًا من الطاقة المولدة (وبالتأكيد أكثر من الطاقة المتاحة المولدة).
بالمناسبة، حتى التفاعلات التي تحدث في درجة حرارة الغرفة يمكن أن تتلقى الطاقة (على الأقل للعمل) من البيئة (درجة حرارة الغرفة ليست صفرًا مطلقًا)، لكنني لا أعتقد أنه تم اختراع طريقة تبريد جديدة هنا.
نسيت المقالة أن تخبرنا أن الطاقة تستثمر في إنتاج الألمنيوم.
يهودا على حق، لا يوجد شيء.
والسؤال هو هل الطريقة جاهزة للتطبيق الصناعي لإنتاج الهيدروجين بكميات تجارية؟
عند يهوذا، لا شيء يخلق من العدم، إذ تتحلل جزيئات الماء إلى الذرات التي تتكون منها.
ببساطة، بهذه الطريقة لا تحتاج إلى طاقة إلا للألمنيوم...
"إن ذرة الحمض التي تتصرف كحمض لويس ترتبط بذرة الأكسجين في جزيء الماء بينما يفصل النوع الآخر من ذرة الحمض، وهو قاعدة لويس، ذرة هيدروجين واحدة عنها. وإذا حدثت هذه العملية مرة ثانية مع نظام آخر من ذرتين ذرات حمض نشطة وجزيء ماء، ثم يتم الحصول على ذرتين هيدروجين يمكن أن تتحدا معًا لتكوين خليط من غاز الهيدروجين - H2."
الجملة الأساسية في هذا الرد هي:-
"يبدو أنه يمكننا تطوير طرق لإزالة مجموعة الهيدروكسيل التي تظل مرتبطة بمجموعات الخميرة بعد استخلاص الهيدروجين بحيث يمكن استخدامها مرارًا وتكرارًا،" انتهى الاقتباس.
بمعنى آخر، ليس لديهم طرق في الوقت الحالي، وفي الوقت نفسه يتطلب إنتاج الهيدروجين الكثير من الألومنيوم!
وبالإضافة إلى ذلك، أنا لا أفهم الجملة:-
"إن القدرة على إنتاج الهيدروجين في درجة حرارة الغرفة أمر مهم لأنه يعني أنه لا يلزم استثمار الطاقة أو الحرارة لإثارة التفاعل". نهاية الاقتباس.
فكيف لا تكون هناك حاجة إلى طاقة لإنتاج الهيدروجين، إذا كان الأمر كذلك، فيمكننا حرق الهيدروجين الناتج "مجانًا" والحصول على الطاقة من لا شيء، بالإضافة إلى ذلك، الحصول على مياه عذبة مجانية.
هناك خطأ ما في المزود الرائد المعروض هنا.
يطلب تفسيرا
مساء الخير
سابدارمش يهودا