يؤدي التصلب المتعدد إلى إتلاف الأعصاب، وخاصة غمدها - المايلين. المقالة الثانية في السلسلة
بالنسبة للحلقة السابقة: الكهرباء والأعصاب وعلم الأحياء العرقي للزومبي
"لقد كان سعيدًا بمشاركة الحزن في العالم. لا يمكننا شفاء الحزن في العالم، لكن يمكننا أن نختار أن نعيش بسعادة." جوزيف كامبل، 1904-1987
"لماذا يجب أن توضع روح الإنسان في مثل هذه العلاقة الوثيقة والحزينة المليئة بالمشاعر وغير المفهومة، مع عظمة ضعيفة مثل جسده؟" سأل توماس هاردي في بداية القرن العشرين، وهو ما يعكس الإحباط الأبدي الذي يشعر به الناس عندما تخونهم أجسادهم بينما كانت أرواحهم في ذروتها. ولد هاردي في أربعينيات القرن التاسع عشر، ولكن عندما بلغ الثامنة من عمره، انتهت حياة شخص آخر، عانى طوال حياته من العلاقة المؤلمة بين الجسد والروح. كان هذا الرجل هو أوغسطس داستا، الذي لو كانت ثروته مختلفة بعض الشيء، لكان من الممكن أن يُتوج ملكًا على إنجلترا.
وُلد أغسطس عام 1794، وهو الحفيد غير الشرعي للملك جورج الثالث. تزوج والده الأمير الملكي دون الحصول على إذن رسمي من الملك، ولذلك قرر جورج أن الزواج باطل ولاغ وأن النسل لن يكون له الحق في المطالبة بالملكية. تم نقل الرضيع أوغسطس إلى حضانة والدته في إنجلترا، ونشأ ليصبح شابًا وسيمًا وخائب الأمل. كان يتوق إلى أن يكون جزءًا من العائلة المالكة التي رفضته، وسعى دون جدوى إلى الاعتراف بأبيه وجده. للحصول على نفس الاعتراف، قدم أغسطس التماسات عدة مرات إلى أعضاء البيت الملكي والبرلمان، ولكن دون جدوى. كان هذا هو الوضع خلال الثمانية والعشرين عامًا الأولى من حياة أغسطس.
بين الالتماسات، قرر أغسطس قضاء بضعة أيام مع قريب محبوب في اسكتلندا. استغرقت الرحلة عدة أيام، كما كانت طريقة الرحلات في ذلك الوقت، وعندما وصل أغسطس إلى اسكتلندا اكتشف لأسفه أن قريبه قد توفي بشكل غير متوقع، وأنه وصل في الوقت المناسب لحضور الجنازة. أثناء وقوفه، محاطًا بعاصفة من العواطف، فوق القبر الطازج، لم يتمكن أغسطس من خنق دموعه. وحجبت الدموع بصره، لكنه مسح عينيه وعاد إلى منزله المؤقت. وهناك فقط اكتشف أنه على الرغم من جفاف الدموع، إلا أن بصره لم يعد إلى قوته. من جميع النواحي العملية، فقد أغسطس بصره. [1]
لو كان الشاب أغسطس على قيد الحياة اليوم، فمن المؤكد أنه كان سيذهب على الفور لرؤية الطبيب. سيعطيه سلسلة من الاختبارات، بما في ذلك اختبار التصوير بالرنين المغناطيسي (MRI) [2]، حيث تم رسم دماغه باستخدام مجال مغناطيسي قوي، وتصويره شريحة تلو الأخرى. وبما أن النبيل لم يصب جسديًا، فمن المرجح أن الطبيب كان يبحث عن ورم في المخ يمكن أن يعطل نشاط مركز الإبصار، أو نشاط الأعصاب التي تنقل المعلومات من العين إلى الدماغ. ذلك الطبيب الافتراضي، لو فحص أوغسطس، لم يكن ليجد دليلاً على وجود ورم، لكنه كان سيكتشف علامة غريبة أخرى: ندبة في وسط الدماغ، تحدد المنطقة التي تضررت فيها الأعصاب. لكن كيف تظهر تلك الندبة في الدماغ، وكأن سكيناً غير مرئية اخترقت الجمجمة وخرجت دون أن تترك أثراً في الخارج؟
استمر أغسطس في عيش حياته، غير مدرك للغموض المختبئ داخل عقله. قرأ له خدمه وأصدقاؤه الرسائل، وبدأ في كتابة مذكراته بالإملاء. وعلى الرغم من أنه حاول علاج ضعف البصر على أنه مؤقت فقط، إلا أنه كان يخشى أن تظل عينيه متضررتين إلى الأبد. يقال أن الطفل يصبح بالغاً عندما يدرك أنه لن يعيش إلى الأبد. هنا، في سن 28، انتهت طفولة أغسطس.
ولراحة الشاب المعذب، عاد بصره بعد عدة أسابيع إلى طبيعته، دون أي علاج طبي. لو قام الطبيب بفحص دماغ أغسطس مرة أخرى، لوجد أن الندبة قد اختفت تقريبًا، وحل محلها نسيج عصبي طبيعي. لكن في القرن التاسع عشر، لم يكن جهاز التصوير بالرنين المغناطيسي يحلم به بعد، وعلى أي حال، على الرغم من التعافي اللحظي، لم يكن من المتوقع أن يعيش وريث العرش المحروم حياة عسل.
لم تكن السكين هي التي أصابت دماغ أغسطس، ولم تكن البكتيريا أو الفيروس مسؤولاً عن تدمير الأنسجة. وفي الواقع، لم يكن هناك أي جهة أجنبية تقف وراء الهجوم على الإطلاق. الخلايا العصبية، مصدر الروح، تتعرض للهجوم في هذه الحالة من قبل الجسم.
عزل الأعصاب
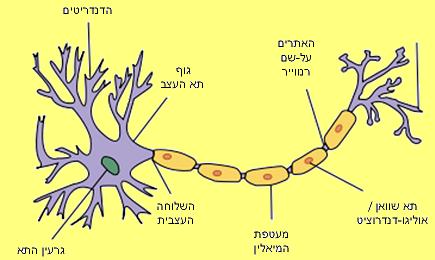
في الفصل السابق (الكهرباء والأعصاب وعلم الأحياء العرقي للزومبي)، رأينا كيف تنقل الأعصاب إشارة كهربائية على طول فروعها الطويلة. يبدأ إرسال الإشارة عندما يغير غشاء الخلية في منطقة "نعم" توتره السطحي، مما يؤدي إلى فتح قنوات الصوديوم التي تسمح بتدفق الأيونات الموجبة إلى داخل الخلية وتحويل توتر الغشاء إلى موجب. ونتيجة للتغير في الجهد الكهربائي، تنفتح أيضًا قنوات الصوديوم المجاورة، وبالتالي يمكن للمعلومات أن تتقدم بسرعة فائقة على طول امتداد العصب الطويل، حيث تؤدي كل قناة جديدة تفتح إلى فتح قناة أخرى أسفل امتداد العصب. .
ورغم أن كل قناة تفتح في أقل من جزء من الألف من الثانية، إلا أن سرعة نقل الإشارة ليست كبيرة وتصل سرعتها إلى 25 مترًا في الثانية على الأكثر. وهذه السرعة كافية للمخلوقات الصغيرة، مثل معظم اللافقاريات، التي لا تمتد العمليات العصبية فيها إلى مسافة كبيرة. لكن في الحيوانات التي تنتمي إلى مجموعة الفقاريات، تمتد العديد من العمليات العصبية إلى طول ملليمترات وسنتيمترات، وفي الإنسان يمكن العثور على عمليات يصل طولها إلى متر أو أكثر. ولهذا السبب، خضعت الفقاريات لتطور أدى إلى تحسين نظامها العصبي وإضافة مكون جديد إليه، مما سمح لها بالوصول إلى سرعة نقل الإشارة تصل إلى 100 متر في الثانية.
فإذا قطعنا عصباً بشرياً عبره نرى أن فرع العصب محاط بقشرة كثيرة مشدودة حوله مثل قشرة البصلة. تتكون طبقات الغلاف من خلايا فريدة، وظيفتها بأكملها هي الالتفاف حول الامتدادات العصبية مرارًا وتكرارًا وإبقائها معزولة عن البيئة. ويمكن مقارنة دورها بدور المطاط الأسود الذي يغلف خطوط الهاتف في أعماق البحر. تعمل طبقات الأغشية العديدة المحيطة بالامتداد على عزل الغشاء العصبي عن البيئة، وبالتالي تسمح لتغير الجهد "بالقفز" لمسافة عدة ملليمترات على طول الامتداد، بسرعة موجة كهرومغناطيسية، ودون تأخير فتح كل منها. قناة الصوديوم بدورها.
يُطلق على الغلاف العازل حول الأعصاب اسم "الميالين"، وتسمى الخلايا التي تضحي بأجسامها لإنتاجه بخلايا شوان في الجهاز العصبي المحيطي، أو الخلايا قليلة التغصن في الجهاز العصبي المركزي. وعلى الرغم من فعاليته الكبيرة، فمن الواضح أنه لا يكفي للأعصاب التي يتجاوز طولها ملليمترًا أو اثنين. إنه يوفر ظروف عزل ممتازة، ولكن حتى هذه الظروف لا تسمح لتغير الجهد بالبقاء على قيد الحياة لأكثر من بضعة ملليمترات على طول العصب. ولهذا السبب، هناك حاجة إلى آلية لإعادة إنشاء الإشارة الكهربائية على طول العصب، قبل أن يتوقف تغير الجهد في النهاية.
إذا مشينا على طول فرع العصب، مثل مسح خط هاتف تحت الماء، فسوف نكتشف ظاهرة غريبة. على الرغم من أن الامتداد بأكمله مغطى بطبقة عازلة، إلا أنه لا تزال هناك مناطق صلعاء، حيث يتم قطع الغمد وتعريض العصب للبيئة خارج الخلية. إذا قام أحد المهندسين بتصميم خط هاتف بهذه الطريقة، فمن المؤكد أننا سنرغب في إدخاله إلى المستشفى. لكن في الأعصاب، تكون تلك المناطق المعرضة للبيئة ضرورية لتضخيم الإشارة الكهربائية.
وتنتقل الإشارة الكهربائية - وهي التغير في جهد غشاء الخلية - من جليد إلى آخر، إذ تسير بسرعة قريبة من سرعة الضوء في المواد الشفافة. يوجد في كل واحدة من مناطق الصلع الآلاف من قنوات الصوديوم المعتمدة على الجهد، والتي تفتح عندما تشعر بتغير الجهد، وتسمح لأيونات الصوديوم الموجبة بالتدفق إلى الخلية في منطقة الصلع. ويؤدي التدفق إلى تغير قوي في جهد الغشاء في تلك المنطقة، وإلى تجدد إنشاء الإشارة الكهربائية. تنتقل الإشارة الجديدة إلى نقطة الصلع التالية، حيث يتم تضخيمها مرارًا وتكرارًا، حتى تصل إلى نهاية العصب وتنقل الرسالة بنجاح. تم اكتشاف تلك المناطق الصلعاء بالفعل في نهاية القرن التاسع عشر من قبل الباحث الفرنسي الشهير لويس أنطوان رانفييه، وحتى يومنا هذا يتم تسميتها باسمه - عقد رانفييه.
على الرغم من أن اللافقاريات قادرة على العمل بشكل جيد بدون غمد المايلين العازل، إلا أننا نحن الفقاريات تكيفنا منذ فترة طويلة مع وجوده. وبدون وجوده، ستتباطأ سرعة نقل الإشارة إلى معدل مستحيل، ويمكن للأعصاب أن تطلق إشارات كهربائية عن غير قصد، ويمكن للأعصاب المجاورة أن تسرب المعلومات لبعضها البعض.
الندبة التي ظهرت في دماغ أغسطس المؤسف معروفة الآن للأطباء المعاصرين، وهي تشير عمليا إلى منطقة معركة مليئة بالتجاويف. هذا هو المكان الذي أعلن فيه الجهاز المناعي الحرب على غمد المايلين، وحاول تآكله حتى آخر حمض دهني فيه. ومثل الطرق الأكثر شيوعًا للوصول إلى الجحيم، يتم كل شيء بأفضل النوايا: حماية الجسد.
دور الجهاز المناعي هو حماية الجسم من العوامل الأجنبية. إن العملية التي يقرر من خلالها الجهاز المناعي أن أحد البروتينات الموجودة في الجسم يمثل تهديدًا ليست مفهومة تمامًا بعد، ولكن من الواضح أنها شائعة جدًا. يكون جهاز المناعة دائمًا في حالة توازن دقيق بين الجسم والبيئة. يجب أن يكون حساسًا بدرجة كافية لاكتشاف العوامل الأجنبية وإبعادها عن الجسم، لكن لا يكون شديد الحساسية، لأنك عندها ستبدأ بمهاجمة الجسم نفسه. عندما يصبح الجهاز المناعي حساسًا جدًا لعوامل الجسم، يندلع مرض مناعي ذاتي، يقوم خلاله الجهاز المناعي بتعبئة خلاياه العديدة، وكل قواه في محاولة لتدمير الخلايا والأنسجة الذاتية، التي وصفها عن غير قصد بأنها غريبة. عوامل.
الندبة الموجودة في الدماغ هي علامة على المكان الذي هاجمت فيه الخلايا البلعمية - الخلايا العملاقة البلعمية، التي تخدم الجهاز المناعي - غمد المايلين. تستقر البلاعم على الغلاف، وتتفتت وتهضمه، تاركة امتداد العصب مكشوفًا وغير قادر على العمل بشكل صحيح. في هذه المنطقة، حيث تم تآكل الميالين بالكامل تقريبًا، ظهرت الندبة في دماغ أغسطس.
فكيف استعاد بصر أغسطس إذن؟ ويكمن السبب في قدرة الخلايا التغصنية القليلة على تجديد غمد المايلين في الدماغ. وعندما تعرض الغمد للتلف، أعادت الخلايا الدبقية قليلة التغصن تغليف نفسها حول العصب واستعادت قدرة الفرع على نقل الإشارات. هذا المرض، الذي يعاني فيه المصاب من نوبات عصبية متكررة، ويتعافى كليًا أو جزئيًا بين النوبات، هو النوع الأكثر شيوعًا لمرض التصلب المتعدد. في العبرية، يصف اسم "التصلب" انحطاط الدماغ. ويشير الاسم باللغة الإنجليزية إلى الندبات الكثيرة التي تظهر في أدمغة المرضى المصابين بالمرض.
لم تكن السنوات التالية لأغسطس سعيدة بالنسبة له. إن التجربة التي مر بها، والتي اضطرته إلى الاعتماد على خدمه وأصدقائه، أنضجته بين عشية وضحاها. لقد ركز بشكل أقل على جهوده للوصول إلى البيت الملكي، وأولى اهتمامًا أكبر لعائلته وأصدقائه وركز على أفراح الحياة الصغيرة بدلاً من الحزن. لكن أمراض المناعة الذاتية لا تختفي من تلقاء نفسها، ولم تستقر البلاعم على أمجادها واستمرت في نخر دماغه بلا هوادة. في السنوات الأربع التي تلت الهجوم الأول، عانى أغسطس من هجمات إضافية أضرت ببصره. تعافى الجميع بدورهم، لكن كل منهم زاد من قلقه.
في عمر 33 عامًا، زار أغسطس والدته في لوزان، سويسرا، خلال فترة الصيف الأكثر حرارة. ونجد في مذكراته أدلة على أن الحرارة الشديدة أدت إلى تفاقم مشاكل الرؤية لديه وشعوره العام. وتتوافق هذه الحقيقة مع "أعراض أوتوف" التي تصف ظهور نوبات عصبية جديدة تحت الضغط الحراري وارتفاع درجة الحرارة، بسبب تآكل سمك غلاف المايلين وعدم قدرته على توفير العزل اللازم للأعصاب. غادر أغسطس ووالدته لوزان لصالح رحلة إلى إيطاليا، لكن النوبات العصبية لم تتوقف عن الظهور. وفي فلورنسا، بدأ أغسطس يعاني من ازدواج الرؤية، حيث انقطعت القدرة على التنسيق بين الأعصاب البصرية وكان كل منها ينقل صورة على حدة إلى الدماغ. كما هو الحال مع الأعراض الأخرى حتى ذلك الوقت، عاد بصره هذه المرة أيضًا إلى طبيعته، ولكن لم يعد قويًا أبدًا.
خلال مرض التصلب المتعدد، تشير كل نوبة إلى تآكل غمد المايلين في أعصاب مختلفة. ينتهي كل هجوم منفصل عندما تصل الخلايا السلفية إلى منطقة التآكل، وتنقسم وتتمايز إلى خلايا قليلة التغصن ناضجة تعمل على إصلاح الوشاح. في عام 2007، تمت دراسة أدمغة اثنين من مرضى التصلب المتعدد، الذين عانوا من المرض لمدة 21 و 22 عامًا، وتبين أن ما يقرب من 47٪ من سطح الندبة يتم إعادة تغليفه بالميالين [3]. وتشير هذه الحقيقة إلى أن ترميم المايلين يحدث بشكل مستمر، حتى في سن الشيخوخة، ولكننا نعلم أن عملية الترميم يمكن أن تتدهور كفاءتها مع التقدم في السن. والسبب في ذلك لا يزال غير واضح. يعتقد البعض أن تجمع الخلايا السلفية قليلة التغصن آخذ في النضوب، لكن هذا لا يبدو مرجحًا، لأن مثل هذه الخلايا السلفية يمكن العثور عليها أيضًا في مناطق الندبات المزمنة القديمة، والتي لا تلتئم. الفرضية الأكثر ترجيحًا اليوم هي أن التندب المتكرر يتسبب في فقدان الفرع العصبي للإشارات التي تجذب الخلايا الدبقية قليلة التغصن والخلايا السلفية إليه، وبالتالي منع عملية الشفاء. كلما تراكمت الندبات التي لا تشفى بشكل كامل، كلما تدهورت سيطرة المريض على جسده.
استمرت أعصاب أغسطس في الندوب، لكن عملية الشفاء كانت بطيئة. بدأت الأعراض العصبية تظهر بطرق جديدة: فقد السيطرة على ساقيه، ووصل إلى النقطة التي لم يتمكن فيها من النهوض من السرير لمدة ثلاثة أسابيع. في هذا الوقت قام أغسطس بتغيير مستشاره الطبي وطلب المساعدة من دكتور كينت. أوصى كينت بتناول أحشاء اللحم البقري مرتين يوميًا وشرب النبيذ عالي الجودة، وفي غضون أسابيع قليلة عادت ساقي أغسطس إلى كامل وظائفهما. وعلى الرغم من إغراءات تمويل شرائح اللحم والنبيذ على حساب صندوق التأمين الصحي، فمن الصعب تصديق أن العلاج الباهظ الثمن ساعد في حد ذاته. من الأرجح أن الأعصاب قد تمت إعادة تغطيتها ببساطة بغمد المايلين الذي تحتاجه. ومع ذلك، لم يتمكن أغسطس من الرقص مرة أخرى، أو الركض بسرعة.
مصدر وعلاج مرض التصلب المتعدد
عاش أغسطس في النصف الأول من القرن التاسع عشر، عندما لم يكن الأطباء على علم بوجود مرض التصلب المتعدد. تم وصف المرض بشكل منهجي لأول مرة في عام 19 من قبل عملاق علم الأعصاب الفرنسي جان مارتن شاركو، الذي حصل على لقب مشكوك فيه "نابليون العصاب"، وكان أحد طلابه سيغموند فرويد. على الرغم من أن شاركو وصف الندبات التي وجدها في أدمغة مرضاه، إلا أن العلوم الطبية كان عليها أن تتقدم مائة عام أخرى للوصول إلى فهم أساسي لتطور المرض.
ولم يتم تحديد مصدر المرض بشكل نهائي بعد، ولكن من الواضح أنه مزيج من العوامل الوراثية والبيئية. ومن المعروف أن المرضى الذين يعانون من مرض التصلب المتعدد يميلون إلى الإصابة بفيروس الحصبة والنكاف والحصبة الألمانية وفيروس إبشتاين بار في سن متأخرة عن المعتاد. قد تشير هذه الظاهرة إلى أن مرض التصلب العصبي المتعدد مرتبط بـ "فرضية النظافة"، والتي بموجبها لا يطور الأطفال الذين يتم الاحتفاظ بهم في بيئة صحية أثناء طفولتهم نظام مناعة مستقر. قد ينفجر الجهاز المناعي المزعزع في العمل ضد الجسم ويؤدي إلى تلف المايلين.
ولم يتم تحديد الأسباب الوراثية للمرض بعد، ولكن من المعروف أنه إذا كان أحد أطفال الأسرة مريضًا بمرض التصلب المتعدد، فإن احتمال إصابة كل من إخوته بالمرض أيضًا هو 5%. أما إذا كان توأماً متماثلاً فإن الفرصة تزيد إلى 25%. تظل الفرص كما هي حتى لو تم فصل الأطفال عن بعضهم البعض وتبنيهم مباشرة بعد ولادتهم. تشير هذه البيانات بوضوح إلى أن المرض له أساس وراثي، ولكن البيئة لها أيضًا تأثير حاسم على تطور المرض.
لو عاش أغسطس في عصرنا، لكان من الممكن بالتأكيد وصف مرضه حتى في وقت الهجمات الأولى. ولكن كما حدث في القرن التاسع عشر، وعلى الرغم من الفهم الأساسي الذي اكتسبناه حول علاج المرض، فإن خيارات العلاج المتاحة لنا اليوم لا تزال محدودة للغاية، ولا تشكل علاجًا حقيقيًا.
في السبعينيات، تم تقديم العلاج بالإنترفيرون لأول مرة - وهي جزيئات تفرزها بعض الخلايا وتنقل التعليمات إلى خلايا أخرى.
يبدو أن إنترفيرون بيتا، الذي لا يزال يستخدم لعلاج التصلب المتعدد، قادر على تثبيط جزء من الاستجابة الالتهابية في دماغ المريض. وقد أظهرت الدراسات التي أجريت على مدى سنتين إلى ثلاث سنوات أن تكرار النوبات ينخفض بنحو 30% نتيجة تناول الدواء. الجانب السلبي للإنترفيرون هو آثاره الجانبية الشبيهة بالأنفلونزا، والتي تستمر حوالي نصف يوم من وقت الحقن، وحقيقة أن ما بين خمسة وثلاثين بالمائة من المرضى يطورون أجسامًا مضادة ضد الإنترفيرون في السنة الأولى من العلاج، مما يوقف نشاطهم. تأثير.
أما الدواء الثاني المستخدم اليوم فقد جاء من مصدر غير متوقع، مما يدل على أهمية البحوث الحيوانية الأساسية. تركز العديد من المختبرات حول العالم على تطوير الأدوية، من خلال علاج الحيوانات التي تعاني من أمراض محددة مختلفة. من أجل دراسة مرض التصلب المتعدد لدى الحيوانات، من الضروري جعلهم يصابون بالمرض ولهذا يستخدمون بروتينات خاصة تحفز جهاز المناعة وتجعله يخرج عن نطاق السيطرة ويهاجم المايلين. في التسعينيات، حاول باحثون من معهد وايزمان إنتاج بوليمر صناعي يشبه البروتينات المسببة للمرض في خصائصه الفيزيائية والمناعية، وكانوا يأملون في الحصول على أداة بحثية من شأنها علاج المرض في حيوانات التجارب بتكلفة رخيصة وبكفاءة. مما يزيد من القدرة على البحث عن المرض. لكن البروتين الاصطناعي الذي أنتجوه كذب بشكل سيئ.
"لقد حاولنا لمدة عام كامل، لكننا فشلنا في إحداث المرض بمساعدة البروتين الاصطناعي الذي صنعناه". بحسب البروفيسور روث أرنون من معهد وايزمان [4]. وجاء التحول المفاجئ عندما حاول الباحثون حقن حيوانات التجارب بكل من البوليمر الاصطناعي الجديد والبروتينات المسببة للمرض. ولكن بدلاً من إصابة الحيوانات المحقونة بمرض التصلب المتعدد، اكتشف الباحثون أن البوليمر يمكن استخدامه بالفعل كلقاح ضد المرض. "لقد أجرينا التجارب الأولى على خنازير غينيا وحصلنا على نتائج مذهلة. وفي المجموعة الضابطة أصيب ما يقرب من 80% بالمرض، مقارنة بالمجموعة التي تم حقنها بالبوليمر، حيث أصيب 20% فقط بالمرض. كما كانت شدة المرض في الحيوانات الخاضعة للمراقبة أكثر خطورة بكثير من المرض الذي تفشى في المجموعات "الملقحة".
وبعد أربع سنوات أخرى من الاختبارات الناجحة على حيوانات تجريبية أخرى مثل الأرانب والفئران والقردة الريصية والقنادس، تم نقل المادة الاصطناعية إلى الاختبارات السريرية على البشر، والتي اجتازتها أيضًا بنجاح. الكوباكسون، نتاج اختراع البروفيسور مايكل سيلا والبروفيسور روث أرنون والدكتورة ديبورا تيتلبوم من معهد وايزمان، تم تسويقه في الولايات المتحدة في عام 1996 نيابة عن شركة تيفا، ويعد حاليا أحد أشهر الأدوية. والعلاجات الفعالة للمرض. وقد تم إثبات مستوى فعاليته في الدراسات السريرية، التي أظهرت أنه قادر على تقليل تكرار الهجمات أربعة أضعاف، خلال فترة عامين. كميزة أخرى، لا يسبب كوباكسون أي آثار جانبية تقريبًا، والأثر الجانبي الأكثر شيوعًا هو الاحمرار والتورم الطفيف في منطقة الحقن.
طريقة عمل كوباكسون لا تزال غير معروفة. تشير الدراسات التي أجريت على الحيوانات وفي الأنظمة المختبرية (تجارب خارج الجسم، في أنابيب الاختبار وألواح الخلايا النامية) إلى أن الكوباكسون يحفز خلايا T معينة في الجهاز المناعي، والتي تكون قادرة على قمع الاستجابة المناعية [5]. هناك اقتراح آخر، والذي لا يزال غير مدعوم بالنتائج الفعلية، وهو أن الكوباكسون يشبه أحد البروتينات التي تظهر في غمد المايلين، وبالتالي يعمل على "تشتيت" الجهاز المناعي، الذي يركز عليه بدلاً من المايلين الحقيقي.
يوفر العقاران - إنترفيرون بيتا وكوباكسون - تخفيفًا لتكرار النوبات، لكن لا يمكنهما إيقاف المرض تمامًا. تستمر حالة مريض التصلب المتعدد في التدهور على مر السنين، وإن كان بمعدل أبطأ نتيجة للأدوية المثبطة. يحاول العديد من الباحثين العثور على أدوية يمكن أن تساعد المرضى المصابين بالمرض على استعادة أدمغتهم. يركز أحد الاتجاهات الواعدة اليوم على وجه التحديد على الخلايا قليلة التغصن في الدماغ. إذا تم العثور على طريقة لزيادة نشاط الخلايا قليلة التغصنات، فمن الممكن أن تتم استعادة أغلفة المايلين بسرعة كبيرة حسب الحاجة، إلى الحد الذي لن تحدث فيه هجمات عصبية.
توفي أوغسطس داستا نفسه عن عمر يناهز 54 عامًا، وكان جهازه العصبي المركزي مليئًا بالبقع والندوب القديمة والجديدة. حتى وفاته عام 1848، كان يعاني من العديد من النوبات العصبية، ومن بين أمور أخرى، فقد قوته تمامًا وعانى من الإمساك المتكرر. فشلت ساقاه تمامًا، وكان يعاني من تشنجات لا يمكن السيطرة عليها تمنعه من النوم بشكل مريح أثناء الليل. ورغم كل ذلك، لم يفقد تفاؤله حتى يومه الأخير. علمت الحياة أغسطس أنه يجب على المرء أن يبحث عن الخير في كل شر. الفقرة الأخيرة في مذكراته، قبل عامين من وفاته، تتوافق مع العقلية التي اكتسبها منذ ظهور المرض في شبابه، حيث يصف فيها سعادته بالنعمة الصغيرة التي وجدها في ذلك اليوم: استعادة قدرته على العمل. يعرج عبر الغرفة على ساق واحدة.
"...جاءني حذاء موكاسين هندي هدية، أرتديه:- وأمشي به دون قدمي اليسرى، التي كانت منذ فترة ملتوية عند الكاحل وغير قابلة للتقويم إلا إذا كانت مدعومة بحديد . ومن المؤكد أن هذا تحسن واضح. الحمد لله!"
מקורות
1. قضية أغسطس ديستي (1794-1848): أول رواية عن مرض التصلب المنتشر
2. التصلب المتعدد، لانسيت 2008؛ 372: 1502–17
3. يمكن أن تكون إعادة الميالين واسعة النطاق في مرض التصلب المتعدد على الرغم من مسار المرض الطويل، (2007) علم الأمراض العصبية وعلم الأحياء العصبي التطبيقي 33، 277-287
ادارة الاغذية والعقاقير:
4. مؤتمر إيلانيت 2008 http://www.fda.gov/cder/foi/label/2001/20622s15lbl.pdf
المزيد عن هذا الموضوع على موقع العلوم
- تجارب على الحيوانات - قصة كوباكسون، الدواء المهم لمرض التصلب المتعدد الذي تم تطويره في إسرائيل
- تمنع الخلايا الجذعية الجنينية تطور مرض التصلب المتعدد

تعليقات 13
وأخيرا شيء أكثر إثارة للاهتمام من المعلومات البسيطة!
ربما لا علاقة لها ولكن سأحاول حظي..
أنا أدرس في جامعة بار إيلان في مجال أبحاث الدماغ وأقوم بعمل يتعلق بمرض التصلب المتعدد. ربما لديك أفكار لمواقع إلكترونية أو كتب أو مقالات يمكن أن تساعدني، كل ما يتعلق بالمايلين، والتصلب المتعدد، والجهاز العصبي، وما إلى ذلك.
شكرا واتمنى لك اسبوع جيد
ممتاز 🙂 متعة القراءة.
مثيرة للاهتمام للغاية وممتعة للقراءة، شكرًا على التوصية روي 🙂
مرحبًا روي
هل هناك أي شيء يجب أن أعرفه؟
رومي,
شكرا للمراجعة البناءة. لقد أضفت أحد الروابط التي اقترحتها إلى المقالة نفسها، لأنها تشرح مرض التصلب العصبي المتعدد بطريقة بسيطة وواضحة.
نص جميل، قراءة ممتعة :)، واضح وغني بالمعلومات.
شكرا.
روي شالوم
أولا وقبل كل شيء، تهانينا
ثانيا، العيب الرئيسي للمقالات التي كتبها الحرفي هو عدم وجود الصور والرسوم البيانية وربما حتى العروض التقديمية فلاش.
إذا كانت هناك قيود على حقوق الطبع والنشر، فربما يمكنك إضافة روابط لهذا المحتوى في نص المقالة، على سبيل المثال:
http://www.youtube.com/watch?v=qgySDmRRzxY
http://www.uic.edu/depts/accc/seminars/flashintro/virus.swf
ومرة أخرى، أشكركم من أعماق قلبي
رامي
وتحتل فرضية النظافة مكانا أوسع فأوسع في خطاب الباحثين. وعرضت الأسبوع الماضي حلقة تشرح المشكلة على قناة الصحة.
وبينما أصبحت حياتنا أكثر انفصالاً عن الطبيعة، ومحاطة بفقاعة نظيفة على نحو متزايد، أصبحت أمراض المناعة الذاتية أكثر شيوعاً.
دع أطفالك يلعبون في الفناء وفي الحقل، دعهم يعودون إلى المنزل متسخين في الوحل، وقل لنفسك بسعادة: اليوم قام طفلي بتدريب جهازه المناعي جيدًا.... احتمال إصابة مثل هذا الطفل بمرض التصلب العصبي المتعدد يميل إلى الصفر.
وفي أماكن مثل السويد، حيث من الشائع جدًا تنقية الهواء في المنزل بمساعدة مرشحات خاصة، تصل نسبة الأطفال المصابين بالربو إلى 30%.
لقد تم بالفعل إجراء عدد من الدراسات في العالم التي تناولت إعادة تدريب الجهاز المناعي لدى البالغين، عن طريق الإدخال المتحكم فيه لجميع أنواع الكائنات الحية الموجودة في الخارج، وأنه في يوم من الأيام كان كل شخص يعرف كيفية التعامل معها. . يؤدي هذا التدريب إلى نتائج مذهلة عندما تضعف أمراض المناعة الذاتية أو تختفي.
شكرا. لكن من سيتزوج؟؟
أداء مبهر ورائع على القناة الأولى يا رعاة علمكم خبز لنا جميعا. حظا سعيدا مع روعة الخاص بك! مبروك على العرس...
لم أقرأها كلها بعد، لكنها تبدو رائعة!
مقال جميل! دقيقة وحكيمة ومسلية.