ربما كان الجين الذي يسبب المرض التنكسي الشديد للجهاز العصبي ضروريًا في تطورنا

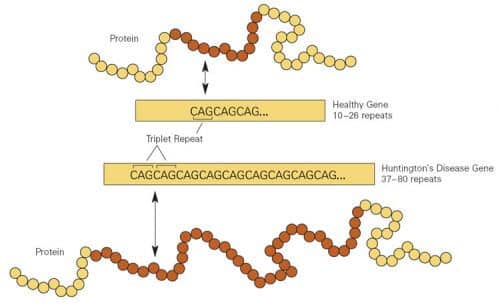
- مرض هنتنغتون، وهو مرض وراثي خطير يؤثر على الدماغ، ناجم عن طفرة حيث تكرر ثلاثة أحرف من الحمض النووي في الشفرة الوراثية للمرضى نفسها مرات عديدة.
- وقد أعادت الدراسات الآن بناء تطور الجين التالف. ظهر الجين نفسه لأول مرة منذ أكثر من مليار سنة وما زال موجودًا في معظم الأنواع.
- قد يكون المرض نتيجة ثانوية مؤسفة لعملية تطورية. وربما ساعدت زيادة عدد الحروف المشفرة في الجين في تطور الجهاز العصبي.
- قد يزيد عدد تكرارات أحرف الكود مع مرور الأجيال. الشخص الذي لديه عدد كبير جدًا من التكرارات سوف يصاب بأعراض مرض هنتنغتون.
فبدءاً من خمسة عشر عاماً، وافقت شركات التأمين البريطانية على عدم استخدام المعلومات الجينية لحاملي وثائق التأمين لتحديد أهلية التأمين على الحياة. إن رفض المطالبات له استثناء واحد. يمكن لشركات التأمين أن تأخذ في الاعتبار، في بعض السياسات، حقيقة أن المؤمن عليه يحمل الجين لمرض كان يُسمى في السابق بالرقص المزمن الوراثي والآن ببساطة مرض هنتنغتون.
عندما تكون شركات التأمين على علم بالنتيجة الإيجابية للاختبار الجيني، فإنها تعلم أنه بما أنه لا يوجد حتى الآن علاج طبي لمرض هنتنغتون، فمن المرجح أن يكون سبب وفاة المؤمن عليه. وهذه المعرفة أكيدة من عوامل الخطر الأخرى التي تأخذها شركات التأمين بعين الاعتبار، مثل التدخين أو تناول المشروبات الكحولية أو ركوب الدراجة النارية. قد يعاني الشخص المصاب بالجينة المعيبة من تقلبات مزاجية واضطرابات في الذاكرة في سن مبكرة، عادة بين سن 30 و50 عامًا، على الرغم من أن هذه التغييرات يمكن أن تحدث لاحقًا. ثم تتفاقم الأعراض، وتشمل حركات لا إرادية وتشنجات ومشية غير مستقرة، وغالبًا ما توصف بأنها نوع من "الرقص" المجزأ. وشيئًا فشيئًا سيفقد الجسم كل قدراته ويتباطأ حتى يحدث انعدام كامل للحركة، وعندها يستسلم المريض أخيرًا للمرض.
بالفعل منذ سنوات عديدة، أدرك الباحثون أن التغييرات في ما يسمى الجين هنتنغتون أنها تسبب المرض. كلنا نحمل جين هنتنغتين لأنه مهم لتطور الجهاز العصبي قبل الولادة. ولكن هناك تغيرات طفيفة في الجين من شخص لآخر، وتفسر هذه التغييرات سبب إصابة بعض الأشخاص بمرض هنتنغتون بينما تظل الغالبية العظمى من الآخرين بصحة جيدة.
يحتوي جزء واحد من الجين على ثلاثة توائم النيوكليوتيداتأو "أحرف رمز الحمض النووي" في هذه الحالة المساعدة النقدية (Cysteine-Adenine-Guanine) الذي يكرر نفسه مراراً وتكراراً عدداً كبيراً من المرات. في الأشخاص الأصحاء، يتراوح عدد ثلاثيات CAG من 8 إلى 35. إذا كان الرقم أعلى، فسيصاب الشخص في النهاية بالمرض المسمى باسمه جورج هنتنغتون (1916-1850) أول طبيب وصفها. إن نسخة واحدة معيبة من الجين (من نسختي هنتنغتين التي يرثها كل منا من كلا الوالدين) تكفي للتسبب في المرض. وكل طفل لأبوين مريضين لديه فرصة كبيرة لحمل الجين المعيب بنسبة 50%. ونتيجة لهذا النمط الوراثي، يصاب واحد من كل 10,000 شخص في أوروبا والولايات المتحدة بالمرض.
كما عرف الباحثون أن أعراض مرض هنتنغتون تنتج عن موت الخلايا العصبية في منطقتين من الدماغ، الجسم المخطط والقشرة الدماغية التي تتحكم في حركات الجسم والقدرات المعرفية العالية. ولهذا السبب، فإن جزءًا كبيرًا من الأبحاث حول المرض يحاول فهم كيف تسبب الإصدارات المتكررة للغاية من الجين مثل هذا الضرر، بالإضافة إلى تطوير أدوية من شأنها إيقاف التقدم غير المقيد للأعراض.
مختبرنا، مثل العديد من المختبرات في مختلف البلدان، تكرس الكثير من الطاقة لهذه الأهداف. قبل بضع سنوات، أثناء هذا البحث، أصبح بعضنا أيضًا مهتمًا بالسؤال الأوسع حول سبب بقاء النسخ الضارة من الجينات جيلًا بعد جيل وعدم التخلص منها عن طريق الانتقاء الطبيعي. تساءلنا عما إذا كان هذا نوعًا من لعبة "المشي على الحافة" البيولوجية. هل هناك ميزة في بقاء الإنسان أو تكاثره عندما يكون هناك عدد كبير، وإن لم يكن كبيرًا جدًا، من التكرارات؟ الأشخاص الذين يعانون من المرض يطرحون هذا السؤال أيضًا. إنهم يدركون أن الإجابة ربما لن تعالج أي شخص، لكنهم ما زالوا يريدون أن يعرفوا.
في الآونة الأخيرة، أدت الدراسات التي تناولت هذا السؤال إلى رؤى مثيرة للاهتمام حول دور الجين في تطور الجهاز العصبي لدى البشر والحيوانات الأخرى. اتضح أن العدد المتزايد من تكرارات CAG يساهم، على ما يبدو، في تعزيز وظيفة الخلايا العصبية، طالما أن الزيادة في عدد التكرارات لا تتجاوز عتبة المرض. وبهذا المعنى، فإن مرض هنتنغتون ليس مرضًا وراثيًا تمامًا، ولكنه قد يكون نتيجة ثانوية مؤسفة لفشل تطور تصميم الدماغ. يبدو أن التغيير الجيني الذي قد يجعلنا "أكثر ذكاء" يؤدي إلى نتائج مأساوية إذا كان متطرفا للغاية. وهنا تكمن مفارقة مرض هنتنغتون.
سفر التكوين
إن العمل البوليسي الذي أدى إلى فهم الدور الذي يلعبه الجين في تطور الجهاز العصبي، تطلب من الباحثين العودة بالزمن إلى أكثر من مليار سنة، إلى أسلاف البشر والأميبا متعددة الخلايا. ديكتيوستيليوم ديسكويدوم. عاشت هذه الأشكال القديمة من الحياة بين العصورحقب الحياة القديمة للدورMesoproterozoicوكانوا أول حاملي الجين، على الرغم من أنه كان مختلفًا قليلاً عن النسخة البشرية.
أحفاد الأميبا د. لا يزال الديسكويدوم يعيش في التربة وتعفن الأوراق على أرضية الغابة، ويتغذى على البكتيريا. سمحوا في عام 2009 لميغيل أندرادي نافاروثم في مركز ماكس ديلبروك للطب الجزيئي في برلين، ومجموعته، للبحث في قواعد البيانات المعقدة والعثور على الجين في الأميبا. اكتشف أندرادي نافارو وزملاؤه أن أحد الاختلافات بين جين هنتنغتون (اسم أقل رسمية لهنتنغتين) في الأميبا وذلك لدى البشر هو أن الجين الموجود في الأميبا لا يحتوي على ثلاثة توائم CAG. ومع ذلك، يبدو أن الجين يلعب دورًا مهمًا في إحدى الخطوات الحيوية في حياة الكائن الحي من خلال السماح للأميبات وحيدة الخلية بالانضمام معًا لتكوين كيان متعدد الخلايا يسمى البلازموديوم الكاذب.
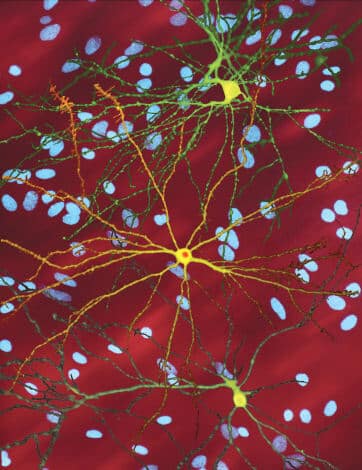
وعندما يكون هناك نقص في الغذاء أو عندما تكون الظروف البيئية قاسية، فإن هذه المجموعة من الأميبا تحمي نفسها بشكل أفضل من أميبا واحدة. في عام 2011، أفادوا مايكل ماير וجيمس جوسيلا من مستشفى ماساتشوستس العام أن الجين ينظم العديد من العمليات الخلوية الأساسية، بما في ذلك انتقال Dictyostelium إلى المرحلة متعددة الخلايا. تواجه الخلايا الفردية التي تفتقر إلى جين هنتنغتون صعوبة في التحرك في الفضاء ولا تتمكن من الانضمام إلى الخلايا الأخرى بطريقة طبيعية. لذلك يبدو أن الجين ضروري للخلايا التي تحتاج إلى "الارتباط" مع بعضها البعض من أجل البقاء.
في الواقع، لدى الجين العديد من الوظائف. واكتشف فريق من جامعة جونز هوبكنز أنه المسؤول عن التحكم في تكاثر الأميبا واستجابتها للمحفزات البيئية التي تدفعها نحو الغذاء. اكتشفنا في مختبرنا أن نسخة الجين الموجودة في Dictyostelium تحمي خلايا الثدييات من المحفزات البيئية التي تعزز موت الخلايا.
منذ أكثر من 550 مليون سنة، انقسمت شجرة الحياة إلى فرعين:أوليات الفموالتي تشمل الحشرات والقشريات والرخويات والفرعثانوي الفممما أدى إلى ظهور الفقاريات والأسماك والطيور والبرمائيات والزواحف والثدييات والرئيسيات والإنسان الحديث. الأميبا، التي لا يوجد فيها تكرار للمجموعات CAGs الثلاثة، تسبق الانقسام. بعده، فقط في فرع ثنائي الفم، تراكم ثلاثة توائم CAG في نفس النقطة في الجين حيث تحدث الطفرات المسببة للمرض لدى البشر.
في عام 2008، وجدنا أنه أثناء التطور، بدأ ثلاثة توائم CAG في التراكم في جين هنتنغتون في الحيوانات التي تنتمي إلى النظام وخز الجلد الذي ينتمي إلى قاعدة فرع ثنائي الفم، والذي ينتمي إليه، على سبيل المثال، قنفذ البحر الأرجواني، بربوراتوس سترونجيلوسنتروتس. بالتعاون مع مجموعة من العلماء من جامعتنا في ميلانو، المتخصصين في أساليب الحوسبة في علم الأحياء، قمنا بفك تشفير تسلسل الحمض النووي للنسخة الجينية الموجودة في قنفذ البحر هذا، وحددنا اثنين من توائم CAG الثلاثية في الجزء الأول من الجين.
لا يزال تسلسل الحمض النووي في قنفذ البحر مختلفًا عن نظيره لدى البشر. على الرغم من أن قنافذ البحر لديها نظام عصبي بدائي، إلا أن الجين موجود بشكل رئيسي في الأنسجة غير العصبية. يشير غيابه إلى أنه في المراحل المبكرة من التطور، لم يلعب الجين والتوائم الثلاثية CAG دورًا مهمًا في الجهاز العصبي. البحث عن ثلاثة توائم في فرع أوليات الفم لا يزال في بداياته، ولكن من الواضح أنها نادرة (على سبيل المثال، النحل لديه CAG واحد). في معظم الحالات، لا تحمل هذه الأنظمة الحيوانية CAG في جين هنتنغتون الخاص بها على الإطلاق.
في أواخر العقد الأول من القرن الحادي والعشرين، قمنا بتحليل تسلسل الحمض النووي لجين هنتنغتون في ثنائيات الصبغيات الأخرى في مختبرنا، وكانت النتيجة الأكثر إثارة للدهشة فيالمخرز ينتمي إلىخيوط الرأس (والتي قمنا بفك شفرتها مع مجموعة ماريو باسترينو من جامعة جنوة في إيطاليا). تمثل بيولوجيا ثعبان البحر، وهو مخلوق صغير يشبه السمكة، تطورًا مهمًا في تطور الجهاز العصبي: اكتساب بنية عصبية مستقطبة تمتد من النهاية إلى النهاية في الحيوان. لقد تمايز الطرف الأمامي للحبل العصبي في إزميلون قليلاً ليشكل نوعًا من الكيس أو الحويصلة، والذي قد يشبه الدماغ البدائي.
أظهر تسلسل الحمض النووي أنه، كما هو الحال في قنافذ البحر، يوجد هنا أيضًا توائم CAG ثلاثية متجاورة. لكن في هذه الحالة، كان تسلسل الحروف الجينية حول زوج التوائم الثلاثة مشابهًا لتسلسل الفقاريات، بما في ذلك البشر، والبروتين المشفر بواسطة الجين موجود بشكل رئيسي في الأنسجة العصبية. ولذلك، فإننا نفترض أن هذا الاختلاف ساعد في خلق الدماغ البدائي، بتركيبته الرأسية والذيلية.
عندما فحص الباحثون جينومات الفقاريات، وجدوا أن ثلاثة توائم CAG تبدأ في الإطالة بشكل كبير في الكائنات الحية ذات الأجهزة العصبية الأكثر تطورًا، وتصل إلى الحد الأقصى لطولها عند البشر. ويمكن استنتاج ذلك عند النظر إلى الأنواع التي تبتعد بشكل متزايد عن البشر، مثل الماشية (15 تكرارًا لـ CAG)، والخنازير (18)، والكلاب (10)، والفئران (7)، والأبوسوم (6). الأفراد من نفس النوع في العديد من الكائنات الحية، بما في ذلك الرئيسيات، لديهم شرائح CAG تختلف في الطول من فرد لآخر.
تمثل الفقاريات فصلاً جديدًا في تطور الجهاز العصبي. يتطور دماغهم من بنية مجوفة تسمى القناة العصبيةوالتي تتكون في الجنين ثم تتطور إلى الدماغ. في عام 1997، مجموعة بحثية من مارسي ماكدونالد من مستشفى ماساتشوستس العام أن جين هنتنغتون يشارك في تكوين القناة العصبية، وفي عام 20122 أكدت مجموعتنا هذه النتيجة وتوسعت فيها بعد أن أظهرنا أن الجين يساهم في تطوير بنية تشبه القناة العصبية في زراعة الأنسجة .
ثلاثة توائم بشرية
وفي الوقت نفسه، بدأت خطوط بحث أخرى في رسم دور آخر لتكرارات CAG: تعزيز الدماغ. هذه الاكتشافات هي، جزئيا، نتيجة لجهودنا التي بدأت في السبعينيات للعثور على الجين الذي يسبب مرض هنتنغتون. في نهاية المطاف، في عام 70، عالم الوراثةنانسي ويكسلر و57 باحثًا آخرمجموعة الدراسة التعاونية لمرض هنتنغتونتم عزل وتحديد تسلسل الجين البشري الموجود على الكروموسوم 4، وبالتالي مهد الطريق لاكتشاف أنه في الأشخاص المصابين بمرض هنتنغتون، يكرر ثلاثة توائم CAG أنفسهم 36 مرة أو أكثر.
وبعد عام نشر ديفيد س. روبنشتاين، وهو عالم وراثة يعمل الآن في جامعة كامبريدج، في ورقة بحثية اقترح فيها أن الجزء من جين هنتنغتون الذي يحتوي على ثلاثة توائم CAG في الأشخاص الأصحاء يميل إلى التوسع مع انتقاله إلى النسل. وفي عام 1994 اكتشف ماكس مفلس، الحائز على جائزة نوبل من كامبريدج، أن الأحماض الأمينية الجلوتامين، أحد اللبنات الأساسية للبروتينات، المشفرة في الحمض النووي في ثلاثة أحرف وراثية CAG، والتي تكرر نفسها في جين هنتنغتون، وتسهل الارتباط بالبروتينات الأخرى. ومع ذلك، بعد هذه النتائج، كانت هناك فجوة طويلة في الأبحاث حول الأدوار غير المرضية لتكرارات CAG. في ذلك الوقت، كانت تكرارات CAG وغيرها من تسلسلات الحمض النووي المتكررة تعتبر "غير هامة" وراثية، ولا تخدم أي غرض.
في 2008، جون ف.فوندون الحفيد، والآن في جامعة تكساس في أرلينغتون، وديفيد كينغ من جامعة جنوب إلينوي كاربونديل، أثاروا مسألة جديدة حول الموضوع بعد أن طرحوا فرضيتين: الأولى، أن ثلاثيات النوكليوتيدات تشارك في تطور وتطور الجهاز العصبي، والثانية، أن زيادة عدد الثلاثيات في قد تعمل خلايا الدماغ على تحسين الإدراك والقدرة على تكوين العلاقات الجنسية والاجتماعية.
ومنذ ذلك الحين، تراكمت الأدلة لدعم هذه الفرضيات. دراسة أجراها فريق من مايكل هايدن في جامعة كولومبيا البريطانية في فانكوفر، اقترح أن شخصًا واحدًا من بين كل 17 شخصًا يحمل "أليل متوسط"، أي جين هنتنغتون السليم مع 27 إلى 35 تكرارًا، وهو رقم مرتفع ولكن ليس مرضيًا. في الأشخاص الأصحاء الذين لديهم عدد كبير من تكرارات CAG، تم العثور على ميل إلى كمية أكبر من المادة الرمادية (الخلايا العصبية) فيالكرة الشاحبةوهي منطقة من الدماغ تتحكم في التخطيط والتحكم في الحركة وتشارك في العمليات المعرفية العليا. وفي الدراسات التي أجريت على مزارع خلايا الدماغ، أظهر مختبرنا أن عددًا أكبر من التكرارات يؤدي إلى هياكل أكثر تعقيدًا تشبه الجهاز العصبي [انظر أدناه].
حتى حاملي الجين الذين من المتوقع أن يمرضوا يظهرون مستويات أعلى من الوظيفة الإدراكية. في عام 2012، أفادوا كارستن صفطוكريستيان بيست، وكلاهما في جامعة الرور في بوخوم بألمانيا، أن الأشخاص الذين لديهم متغيرات من الجين المسبب للمرض، والذين لم تظهر عليهم الأعراض بعد، يسجلون نتائج أفضل في الاختبارات البصرية والإدراكية الأخرى من الأشخاص الذين لديهم نسخ طبيعية.
مساعد الدماغ
تدرس الدراسات الجديدة حول جين هنتنغتون أيضًا المهام الفريدة التي يؤديها الجين في الدماغ. وفي بحثنا الذي أجري على زراعة خلايا الدماغ في أطباق بتري، اكتشفنا أن النسخة الصحية من الجين تجعل الخلايا العصبية أكثر مقاومة للظروف القاسية. وعلى العكس من ذلك، اكتشف باحثونا أن إسكات الجين في أدمغة الفئران يسبب موت الخلايا وظهور أعراض مشابهة لتلك التي لدى الفئران التي تحمل النسخة الضارة من الجين. لقد أظهرنا أيضًا أن الجين يزيد من إنتاج بروتين يسمى عامل التغذية العصبية للدماغ (BDNF) مما يشجع على إنشاء دوائر عصبية في الدماغ ونقل الإشارات العصبية.
ولكن ربما الأهم من ذلك كله هو أن جين هنتنغتون يكون في أكثر حالات نشاطه في المراحل المبكرة من التطور الجنيني. ببساطة، بدونه لم نكن لنولد. يعمل الجين خلالالمعدة، مرحلة التطور الجنيني التي تبدأ بتطور أنسجة الجسم الرئيسية. وفي وقت لاحق، يصبح الجين مسؤولاً عن التحكم في إنشاء خلايا عصبية جديدة ويساعد على ربطها.
على الرغم من التقدم، فإن مفارقة هنتنغتون لا تزال موجودة. قد يكون الحصول على تسلسل CAG الذي يستمر في التوسع هو الإنجاز التطوري الرئيسي لجين هنتنغتون، ولكن ميله إلى الإطالة يشكل أيضًا خطرًا شديدًا للإصابة بمرض مميت. إن الأسئلة المتعلقة بالأجزاء المتكررة في تسلسل الجينات سوف تشغل العلماء لسنوات عديدة قادمة. ما زلنا بحاجة إلى فهم أفضل لسبب وجود مثل هذا التباين الكبير في عدد ثلاثة توائم CAG في الجين. ما هي التغيرات التي تحدث في الدماغ عندما يقترب عدد التوائم الثلاثة من العتبة التي تسبب مرض هنتنغتون؟ لماذا يصبح الجين ضارًا فجأة عندما يكون هناك 36 تكرارًا؟ إن فهم أن جين هنتنغتون يمنح ميزة وعيوبًا يمكن أن يساعد في إزالة القليل من وصمة العار المرتبطة بالمرض، والنظر إليه ليس كعيب وراثي ولكن كمنتج لعملية بيولوجية شكلت في نهاية المطاف كبشر.

تعليقات 2
مجرد قراءة كتاب عن ذلك من تأليف ج. روبرت سوير، نظام تغيير الإطارات
المؤلف بشكل عام يحب أن يصيب أبطاله بهذا المرض في جزء كبير من كتبه 🙁
تصحيح خطأ إملائي: الحد الأقصى لعدد التكرارات التي لا تسبب المرض هو 36-35 وليس 355 كما هو مذكور.