لا يوجد ما يمكن الجدال حوله حول الطعم والرائحة. ولكن هل يجب أن تعرف كيف يستشعرها الجسم؟ الجواب: المستقبلات المقترنة بالبروتين G، موضوع جائزة نوبل في الكيمياء لعام 2012

جائزة نوبل في الكيمياء لعام 2012
مُنحت جائزة نوبل في الكيمياء لعام 2012 بشكل مشترك إلى روبرت ج. ليفكويتز وبريان ك. كوبيلكا، وهما عالمان من الولايات المتحدة الأمريكية، لأبحاثهما حول المستقبلات المقترنة بالبروتين G.
المستقبلات المقترنة بالبروتين G هي مستقبلات تنتمي إلى عائلة كبيرة من بروتينات الغشاء (بروتينات الغشاء)، والتي يتم تحفيزها بواسطة جزيئات خارج الخلية. يسبب التحفيز سلسلة من التفاعلات الكيميائية داخل الخلية والتي يتم تنشيطها بواسطة المستقبل. في نهاية المطاف، تؤدي العملية إلى استجابة خلوية تسمى مسار نقل الإشارة. تم العثور على مستقبلات البروتين G المقترنة حصريًا في الخلايا حقيقية النواة، والتي تشمل الخميرة والنباتات والحيوانات. يمكن أن تكون الروابط التي ترتبط بالمستقبلات وتنشطها عبارة عن مركبات حساسة للضوء، وروائح، وفيرومونات، وهرمونات، وناقلات عصبية، وما إلى ذلك. يمكن أن تكون الروابط مختلفة في الحجم - من جزيئات صغيرة جدًا إلى عديدات الببتيد الكبيرة. تعد المستقبلات المقترنة بالبروتين G هدفًا للعديد من الأدوية الحديثة نظرًا لتورطها في العديد من الأمراض.
الخلايا والاستشعار
في أعيننا، في أنوفنا، هناك أجهزة استشعار للضوء والروائح والأذواق. داخل الجسم، تحتوي الخلايا على أجهزة استشعار مماثلة للهرمونات ومواد الإشارة الأخرى، مثل الأدرينالين والسيروتونين والهستامين والدوبامين. مع تطور الحياة، استخدمت الخلايا بشكل متكرر نفس الآلية الأساسية لاستشعار بيئتها: المستقبلات المقترنة بالبروتين G. ومع ذلك، ظلت هذه المعلومات مخفية عن الباحثين لفترة طويلة.
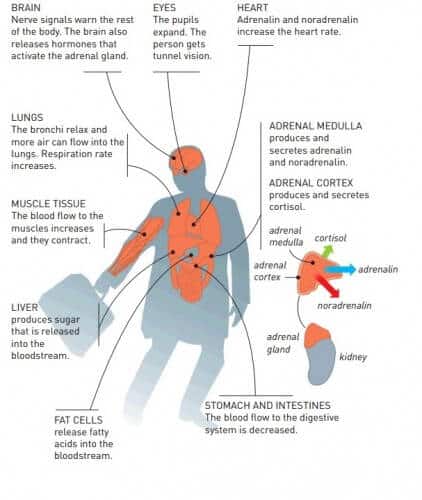
في طبلة جسم الإنسان تتواصل آلاف المليارات من الخلايا مع بعضها البعض. لقد طور العديد منهم أدوارًا مميزة لأنفسهم. بعض تخزين الدهون. ويشعر آخرون بإشارات بصرية، أو ينتجون هرمونات، أو يبنون أنسجة عضلية. لكي نعمل بشكل صحيح، من الضروري أن تعمل خلايانا معًا، بالتنسيق، حتى تتمكن من استشعار محيطها وفهم ما يحدث هناك. لهذا يحتاجون إلى أجهزة استشعار.
تسمى أجهزة الاستشعار الموجودة على سطح سطح الخلية بالمستقبلات. حصل روبرت ج. ليفكويتز وبريان ك. كوبيلكا على جائزة نوبل في الكيمياء لعام 2012 لرسم خرائط لكيفية عمل عائلة المستقبلات المعروفة باسم المستقبلات المقترنة بالبروتين G (GPCRs). في هذه العائلة يمكنك أن تجد مستقبلات للأدرينالين (الإبينفرين)، الدوبامين، السيروتونين، الضوء، الطعم والرائحة. تعتمد معظم العمليات الفسيولوجية التي تحدث في الجسم على هذه المستقبلات. ويعمل حوالي نصف الأدوية اليوم على هذه المستقبلات، بما في ذلك حاصرات بيتا ومضادات الهيستامين والعديد من أنواع الأدوية النفسية. ولذلك، فإن اكتساب المعرفة حول عائلة المستقبلات هذه يجب أن يعود بالنفع على الجنس البشري. وفي الوقت نفسه، غابت هذه المستقبلات عن انتباه العلماء لفترة طويلة.
المستقبل - لغز بعيد المنال
وفي نهاية القرن التاسع عشر، وبينما بدأ العلماء في إجراء تجارب حول تأثيرات الأدرينالين على الجسم، اكتشفوا أن هذه المادة تسبب زيادة في معدل ضربات القلب وضغط الدم وتبطئ نشاط بؤبؤ العين. وبما أن الباحثين اشتبهوا في أن الأدرينالين ينتقل عبر الأعصاب في الجسم، فقد بدأوا في شل الجهاز العصبي لحيوانات المختبر. وعلى الرغم من ذلك، استمر نشاط الأدرينالين. وكان استنتاجهم هو أن الخلايا يجب أن تحتوي على نوع معين من المستقبلات التي تسمح لها باستشعار المواد الكيميائية - الهرمونات والسموم والأدوية - في بيئتها.
ومع ذلك، عندما بدأ الباحثون في البحث عن هذه المستقبلات، اصطدموا بجدار في الشكل. لقد أرادوا أن يفهموا كيف تبدو هذه المستقبلات وكيف تنقل الإشارات إلى الخلية. تم حقن الأدرينالين خارج الخلية مما أدى إلى استقلابه والذي يمكن قياسه داخل الخلية. لكل خلية جدار: غشاء من جزيئات الدهون يفصلها عن بيئتها. كيف تمر الإشارة عبر هذا الحاجز؟ كيف يعرف داخل الخلية ما يحدث خارج الخلية؟
ظلت المستقبلات غير مفككة لعقود من الزمن. وعلى الرغم من ذلك، فقد تمكن العلماء من تطوير أدوية تؤثر على هذه المستقبلات بطريقة محددة. في الأربعينيات من القرن العشرين، درس العالم الأمريكي ريموند أهلكويست كيفية تفاعل الأعضاء المختلفة مع مجموعة متنوعة من المواد الشبيهة بالأدرينالين. وقاده بحثه إلى استنتاج مفاده أنه لا بد من وجود نوعين من مستقبلات الأدرينالين: نوع يتسبب في انقباض الخلايا العضلية في الأوعية الدموية، ونوع آخر مسؤول بشكل رئيسي عن إثارة القلب. وقام بتسمية المستقبلين ألفا وبيتا. وبعد فترة وجيزة، طور العلماء أول حاصرات بيتا، والتي تعد اليوم من أكثر الأدوية فعالية لأمراض القلب.
ومما لا شك فيه أن هذه الأدوية تؤثر على الخلايا، ولكن الآلية الدقيقة لنشاطها لا تزال مجهولة. الآن أصبحنا نعرف سبب صعوبة العثور على المستقبلات: عددها قليل نسبيًا ومعظمها مخفي داخل جدار الخلية. وبعد عدة عقود، حتى ريموند أهلكويست بدأ يتخلى عن نظريته فيما يتعلق بنوعين من المستقبلات، قائلا: "بالنسبة لي، هما فكرة مجردة صيغت لتفسير الاستجابة الملحوظة للأنسجة بعد ملامستها للمواد الكيميائية ذات الهياكل المختلفة".
في هذه المرحلة، في أواخر الستينيات، دخل روبرت ليبكوفيتش، أحد الحائزين على جائزة نوبل في الكيمياء لعام 2012، في تاريخ هذه المستقبلات.
إغراء المستقبلات للخروج من الاختباء
قرر الطالب الشاب المتميز أن يصبح طبيب قلب. ومع ذلك، فقد أكمل شهادته الجامعية خلال حرب فيتنام وأدى خدمته العسكرية في خدمة الصحة العامة الأمريكية في معهد الأبحاث الفيدرالي التابع للمعاهد الوطنية للصحة. وهناك واجه التحدي الكبير المتمثل في العثور على المستقبلات.
كان لدى مشرف ليفكوفيتش خطة جاهزة بالفعل. واقترح إضافة ذرة اليود المشعة إلى الهرمون. وبعد ذلك، بمجرد ارتباط الهرمون بسطح الخلية، سيكون من الممكن متابعة الإشعاع المنبعث من اليود وتحديد موقع المستقبل. بالإضافة إلى ذلك، ومن أجل تعزيز النتائج بشكل أكبر، كان على ليبكوفيتش أن يثبت أن ارتباط الهرمون من خارج الخلية هو المسؤول عن بدء العملية التي تحدث داخل الخلية. وإذا نجح في ذلك، فلن يتمكن أحد من الشك في أنه اكتشف بالفعل المستقبل ذو الدور البيولوجي.
بدأ ليفكوفيتش العمل مع هرمون يحفز إنتاج الأدرينالين في الغدة الكظرية. ولكن يبدو أن لا شيء يعمل لصالحه. مرت السنوات وهو لا يزال غير قادر على إحراز تقدم في بحثه، وبدأ ليفكوفيتش، الذي لم يكن متحمسًا للقيام بهذا البحث في المقام الأول، يشعر باليأس. وعلى الرغم من أنه واصل أبحاثه، إلا أنه لا يزال يطمح إلى أن يصبح طبيباً.
وفي عامه الثاني من البحث، بدأ ليفكوفيتش أخيرًا في إحراز بعض التقدم. في عام 1970 نشر مقالات في مجلتين مرموقتين (PNAS، Science) وصف فيها اكتشاف المستقبل النشط. بعد هذا النشر، جاء إلى جامعة ديوك في ولاية كارولينا الشمالية. وهناك، في مختبراته الجديدة، نظم ليفكوفيتش فريقه الخاص من الباحثين. وعلى الرغم من أنه أدرك أنه لن يصبح طبيب قلب بعد الآن، إلا أنه لا يزال يرغب في دراسة أمراض القلب. وهكذا بدأ بالتركيز على مستقبلات الأدرينالين والنورادرينالين، وهي مواد تسمى المستقبلات الأدرينالية. باستخدام المواد المشعة، بما في ذلك حاصرات بيتا، قام فريقه البحثي بفحص كيفية عمل هذه المستقبلات. وبعد شحذ أدواتهم، نجحوا أخيرًا، بفضل مهاراتهم العالية، في استخراج عدة مستقبلات من الأنسجة البيولوجية.
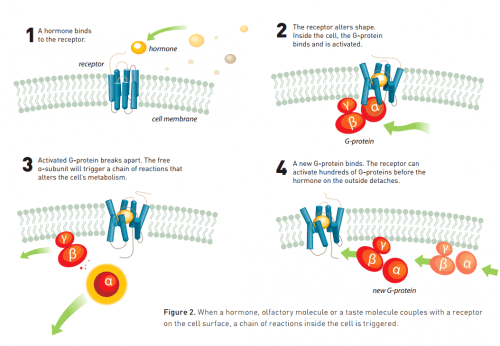
وفي الوقت نفسه، توسعت المعرفة حول آلية العمل داخل الخلايا. اكتشف الباحثون المستقبلات التي تسمى بروتينات G (والتي مُنحت لها جائزة نوبل في علم وظائف الأعضاء والطب عام 1994) والتي يتم تنشيطها بواسطة إشارة صادرة من المستقبل. وهذا البروتين بدوره ينشط سلسلة من التفاعلات التي تؤثر على عملية التمثيل الغذائي في الخلية. ابتداءً من الثمانينات، بدأ العلماء في الحصول على نظرة ثاقبة للعملية التي يتم من خلالها نقل الإشارات من خارج الخلية إلى الداخل.
الحديقة - مفتاح رؤى جديدة
في الثمانينيات، قرر ليبكوفيتش أن مجموعته البحثية بحاجة إلى العثور على الجين الذي يرمز لمستقبل بيتا. تبين أن هذا القرار كان حاسماً لنجاح ليفكوفيتش. يشبه الجين بصمة الإصبع - فهو يحتوي على رمز تقرأه الخلية أثناء توصيل الأحماض الأمينية لتكوين بروتين، على سبيل المثال - مستقبل. وكانت الفكرة أنه إذا نجح فريق البحث في عزل الجين وفك رموز بصمة الإصبع لبناء مستقبل بيتا، فسيتمكن الباحثون من الحصول على نظرة ثاقبة حول كيفية عمل المستقبل.
في نفس الوقت تقريبًا، عين ليفكوفيتش طبيبًا شابًا، بريان كوفيلكا. نشأ فضوله بشأن المستقبلات الأدرينالية من خبرته في وحدة العناية المركزة بالمستشفى. جرعة من الأدرينالين يمكن أن تكون الخط الرفيع بين الحياة والموت. يفتح هذا الهرمون الجهاز التنفسي المسدود ويسرع معدل ضربات القلب. كان كوبيلكا مهتمًا باختبار طبيعة الإبينفرين على المستوى الجزيئي الأكثر تفصيلاً، لذلك لجأ إلى مختبر ليفكوفيتش.
بدأ Kobilka البحث عن الحديقة. ومع ذلك، في الثمانينيات، كانت محاولة العثور على جين واحد من بحر الجينات الهائل في الجسم بمثابة العثور على إبرة في كومة قش؛ أدى التحدي الفني إلى تباطؤ تقدم البحث. ومع ذلك، كان لدى كوفيلكا فكرة بارعة من شأنها أن تسمح بعزل الجين. وبترقب شديد، بدأ الباحثون بفحص التشفير؛ واكتشفوا أن المستقبل يتكون من سبعة خيوط حلزونية طويلة دهنية (كارهة للماء) - ما يعرف بالحلزون. يشير هذا الهيكل للباحثين إلى أن المستقبل من المحتمل أن يتحرك داخل وخارج جدار الخلية سبع مرات.
سبع مرات. كان نفس العدد من الخيوط ذات الشكل الحلزوني نفسه لمستقبل آخر تم اكتشافه بالفعل في مكان آخر من الجسم: مستقبل الضوء رودوبسين الموجود في شبكية العين. عند هذه النقطة وُلدت فكرة: هل هذين المستقبلين مرتبطان، على الرغم من أن لهما أنشطة مختلفة تمامًا؟
وصف روبرت ليبكوفيتش هذه اللحظة بأنها "لحظة اكتشاف حقيقية". كان يعلم أن كلا من المستقبلات الأدرينالية ومستقبلات الرودوبسين تتلامس مع بروتينات G الموجودة داخل الخلية. كان يعلم أيضًا أن ما يقرب من 30 مستقبلًا آخر يعمل من خلال بروتينات G. الاستنتاج الواضح: يجب أن تكون هناك عائلة كاملة من المستقبلات التي تبدو متشابهة وتعمل بطريقة مماثلة!
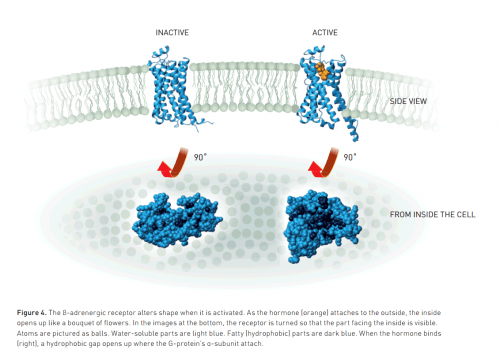
منذ هذا الاكتشاف المذهل، أخذ المركب شكله ببطء وأصبح لدى العلماء الآن المعرفة التفصيلية للمستقبلات المقترنة بالبروتين G - كيف تعمل وكيف تنظم النشاط الجزيئي. كان ليفكوفيتش وكوفيلكا في طليعة هذه الرحلة العلمية، وفي العام الماضي، 2011، أعلن كوفيلكا وفريقه من الباحثين عن اكتشاف كان أبرز ما في عملهم.
محاكاة تأثيرات الأدرينالين
وبعد نجاح عزل الجين المذكور، انتقل بريان كوفيلكا إلى كلية الطب بجامعة ستانفورد في كاليفورنيا. وهناك استعد لإنشاء صورة المستقبل - وهو هدف مستحيل في نظر معظم العلماء - وبالنسبة لكوبيلكا، أصبح الأمر رحلة طويلة.
تصوير البروتين هو عملية تنطوي على خطوات معقدة للغاية. البروتينات صغيرة جدًا بحيث لا يمكن تمييزها بالمجهر العادي. ولذلك، يستخدم العلماء طريقة تعرف باسم علم البلورات بالأشعة السينية. بهذه الطريقة، يبدأ المرء بتكوين بلورة من البروتين، وهي بنية تكون فيها البروتينات معبأة بكثافة بطريقة متناظرة ومنظمة، على غرار جزيئات الماء المعبأة في بلورة ثلجية أو ذرات الكربون في الماس. بعد ذلك، يرسل العلماء الأشعة السينية عبر البروتين البلوري. عندما تضرب الأشعة البروتينات فإنها تتناثر. ومن خلال صورة التشابك هذه، أصبح العلماء قادرين على استنتاج التركيب الذري التفصيلي للبروتين.
تم الحصول على الصورة الأولى للبنية البلورية للبروتين في الخمسينيات من القرن العشرين. ومنذ ذلك الحين، استخدم العلماء هذه الطريقة لإنشاء آلاف الصور للبروتينات. إلا أن معظمها كان قابلاً للذوبان في الماء، مما يسهل عملية تكوينها. تمكن عدد أقل من الباحثين من محاكاة البروتينات الموجودة في الغشاء الدهني للخلية. وفي الماء، تذوب هذه البروتينات بشكل سيئ، على غرار قطرة الزيت على الماء، وتشكل كتلًا دهنية. علاوة على ذلك، فإن المستقبلات المقترنة بالبروتين G هي بطبيعتها متحركة جدًا (فهي تنقل الإشارات عن طريق الحركة)، ولكن داخل البنية البلورية يجب أن تظل ثابتة تقريبًا. ولذلك فإن تشكيلها يشكل تحديا خطيرا.
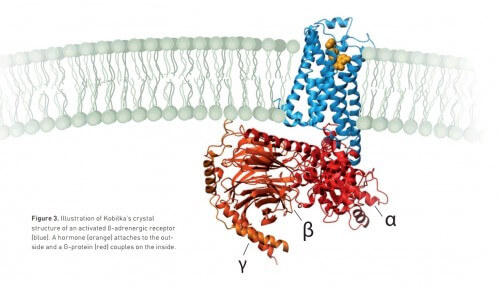
وبعد عقدين فقط، تمكن كوبيلكا من إيجاد الحلول لجميع هذه المشاكل. وبفضل التصميم والإبداع وأساليب البيولوجيا الجزيئية، حقق كوبيلكا وفريقه البحثي هدفهم أخيرًا في عام 2011: فقد حصلوا على صورة للمستقبل في نفس اللحظة التي ينقل فيها الإشارة من الهرمون خارج الخلية إلى بروتين G. داخل الخلية.
وتكشف الصورة المنشورة في مجلة Nature العلمية المرموقة تفاصيل جديدة حول المستقبلات المقترنة ببروتين G، على سبيل المثال، كيف يبدو المستقبل المنشط بمجرد فتح فجوة يرتبط بها بروتين G. ستكون هذه المعرفة مفيدة جدًا في المستقبل لتطوير أدوية جديدة.
الحياة تحتاج إلى المرونة
كشف رسم خريطة الجينوم البشري عن ما يقرب من ألف من الجينات التي تشفر المستقبلات المقترنة بالبروتين G. يستجيب حوالي نصف هذه المستقبلات للروائح وتشكل جزءًا من الجهاز الشمي. حوالي ثلثها عبارة عن مستقبلات للهرمونات ومواد الإشارة، مثل الدوبامين والسيروتونين والبروستاجلاندين والجلوكاجون والهستامين. تلتقط عدة مستقبلات أشعة الضوء التي تصل إلى العين، بينما يوجد بعضها الآخر في أعلى اللسان ويمنحنا حاسة التذوق. ومع ذلك، فإن أكثر من مائة مستقبل يشكل تحديًا للعلماء، لأن أدوارهم لم يتم توضيحها بعد.
وبعيدًا عن اكتشاف الإصدارات المختلفة للمستقبل، اكتشف العديد من الباحثين، بقيادة ليفكوفيتش وكوفيلكا، أنها متعددة الوظائف؛ يمكن لمستقبل واحد التعرف على العديد من الهرمونات المختلفة الموجودة خارج الخلية. علاوة على ذلك، فهي لا تتفاعل في داخل الخلية مع بروتينات G فحسب، بل تتفاعل أيضًا، على سبيل المثال، مع بروتينات تسمى الأرسنتينات. إن إدراك أن هذه المستقبلات لا تقترن دائمًا ببروتينات G دفع الباحثين إلى الإشارة إليها باسم مستقبلات الغشاء 7 (7TM)، بعد الخيوط الحلزونية السبعة الموجودة فيها.
يسمح عدد المستقبلات ومرونتها بالتنظيم الدقيق الذي يعد ضروريًا جدًا لعمل الحياة. عندما نواجه موقفًا مخيفًا، يمتلئ دمنا بالأدرينالين وتتفاعل الأنسجة المختلفة بطرق مختلفة. يتناقص تدفق الدم إلى أعضاء الجهاز الهضمي. وفي الوقت نفسه، يزداد التدفق إلى العضلات. وتعتمد هذه النتائج المختلفة للأدرينالين على وجود تسعة مستقبلات مختلفة تتفاعل مع نفس الهرمون. تبدأ بعض المستقبلات نشاط الخلية، بينما يكون للبعض الآخر تأثيرات مهدئة.
