في المستقبل، سيتيح هذا الاكتشاف فهمًا أفضل لطريقة عمل أدوية العلاج الكيميائي التي ترتبط بـ hCTR1 وتخترق الخلية بطريقة مماثلة، وتحسين العلاج الكيميائي للسرطان. وقد نشرت الدراسة اليوم في المجلة العلمية PNAS.

قام البروفيسور نير بن تال، وطالبة الدكتوراه مايا شوشان، وطالب الماجستير ياريف باركان في قسم الكيمياء الحيوية والبيولوجيا الجزيئية في جامعة تل أبيب بالتعاون مع البروفيسور توركن هاليلوغلو من اسطنبول، بحساب البنية التفصيلية وطريقة عمل البروتين المسمى hCTR1 (ناقل النحاس البشري 1)، أحد البروتينات الموجودة في غشاء الخلية (الغلاف الدهني الذي يحيط بكل خلية من خلايا جسمنا ويفصلها عن البيئة). hCTR1 مسؤول عن نقل أيونات النحاس إلى الخلية. وبالإضافة إلى هذا الدور الذي منحه إياه التطور، فقد تبين أنه ينقل أيضًا مادة العلاج الكيميائي النشطة سيسبلاتين إلى داخل الخلية.
ووفقا للبروفيسور بن تال، فإن البحث الحالي هو خطوة أولى على طريق فهم كيفية اختراق دواء العلاج الكيميائي للخلية، وقد يساعد في المستقبل على تصميم أدوية أفضل. ونشرت نتائج الدراسة اليوم في المجلة العلمية PNAS (وقائع الأكاديمية الوطنية الأمريكية للعلوم).
حوالي 30% من البروتينات الموجودة في جسمنا تشكل غشاء الخلية (وتساعد في الحفاظ على توازن المواد المناسب داخل الخلية)، ومقارنة بالبروتينات الموجودة داخل الخلية، فإنه من الصعب للغاية تحديد الشكل ثلاثي الأبعاد والحركة قدرة بروتينات غشاء الخلية، حتى الدراسة الحالية، كانت التفاصيل حول hCTR1 معروفة بدقة منخفضة للغاية، ولم يكن معروفًا على الإطلاق كيف يتحرك، وبالتالي بأي طريقة يدخل أيونات النحاس إلى الخلية.

تعتبر أيونات النحاس بتراكيز منخفضة ضرورية للخلية وهي ضرورية لعمل الإنزيمات المختلفة التي تشارك في العمليات الحيوية مثل تخثر الدم والحماية من الأكسدة والتنفس الخلوي. وبالتالي فإن تلف نشاط الإنزيمات المرتبطة بالنحاس قد يسبب أمراضًا خطيرة مثل الهيموفيليا وفقر الدم والسكري وأمراض القلب. ومع ذلك، فإن أيون النحاس في حد ذاته شديد التفاعل، ويميل إلى توليد الجذور الحرة بسرعة. ونتيجة لذلك، أثناء التطور، تم تطوير آليات معقدة لنقل الأيون من "يد إلى يد" في السلسلة، حيث تكون الأيدي المختلفة بروتينات من أنواع مختلفة. يعد hCTR1 أحد البروتينات الموجودة في السلسلة.
"كان الهدف من بحثنا هو الكشف عن تفاصيل جديدة حول بنية وحركة hCTR1 من خلال النماذج الحسابية، لتحديد بعض الأحماض الأمينية المسؤولة عن نشاط البروتين واقتراح آلية لعمله." يشرح البروفيسور بن طال.
خلال الدراسة، قارن الباحثون البروتين بين الحيوانات المختلفة واكتشفوا العناصر التي تم الحفاظ عليها طوال التطور بين الأنواع المختلفة وأيها لم يتم الحفاظ عليها. ومن بين العناصر المحفوظة، حدد الباحثون العناصر المسؤولة عن نقل أيونات النحاس إلى الخلية لدى جميع الحيوانات وبالتالي عند البشر أيضًا.
"في الخطوة الأولى، استخدمنا البنية الحالية منخفضة الدقة للبروتين والمعلومات التطورية من أجل التنبؤ بالبنية عالية الدقة."

"يمكن وصف كل حركة معقدة بأنها مجموع حركات متأرجحة بسيطة تسمى "الدراجات المتذبذبة". وفي خطوة ثانية، بعد التنبؤ ببنية البروتين، قمنا بدراسة أنماط تذبذبه بطريقة حسابية. لقد اكتشفنا العديد من أنماط التذبذب الرئيسية التي تشكل الحركة الشاملة للبروتين. (الوضع الرئيسي للتذبذب موضح في مقطع الفيديو - الصورة 1).
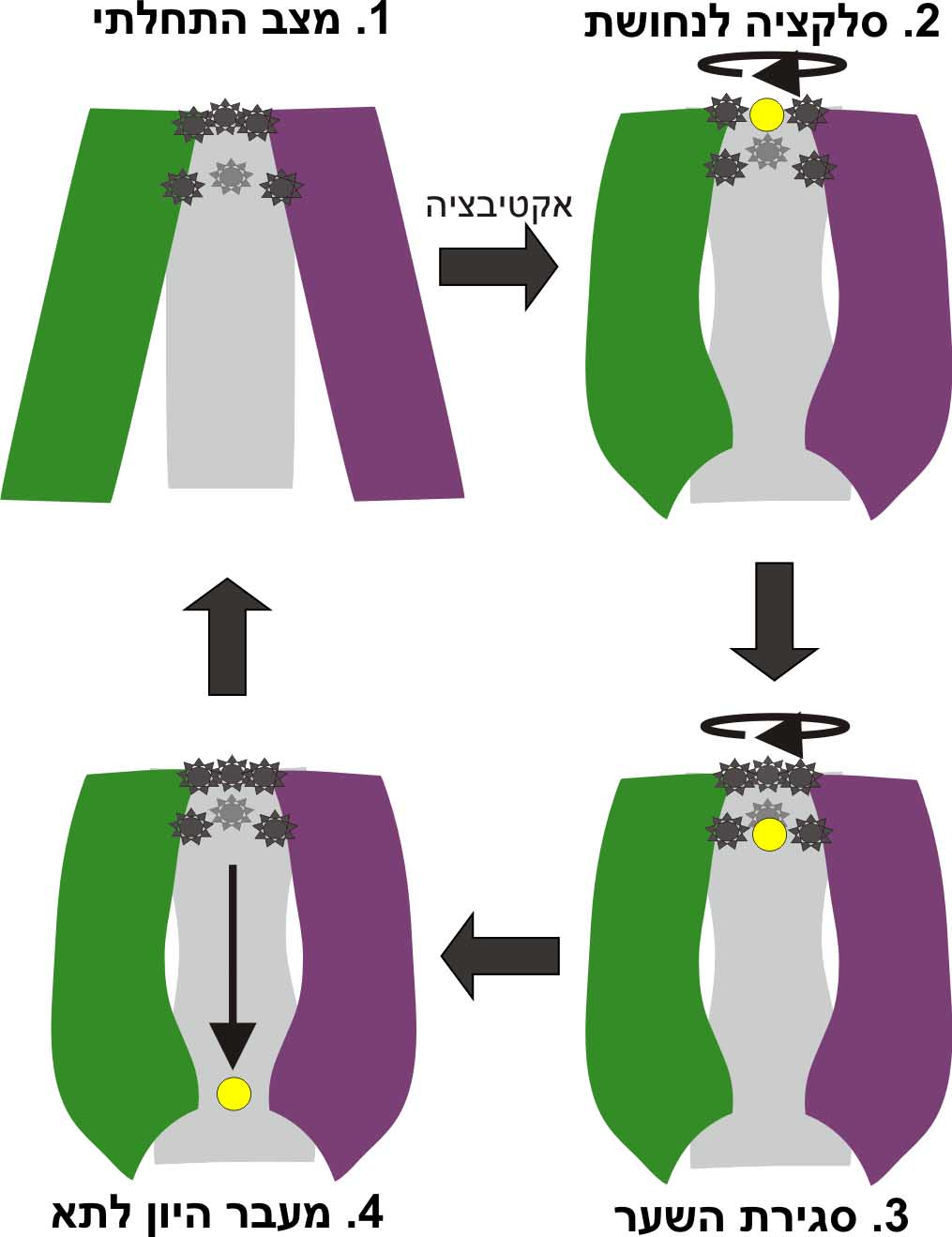
المرحلة الأخيرة من البحث هي الأهم: ما الذي يمكن تعلمه من التنبؤ بالتركيب الجزيئي وحركة hCTR1 حول نشاطه؟ في هذه الحالة، ساعدتنا الحسابات على اقتراح كيفية قيام hCTR1 بنقل أيونات النحاس إلى الخلية مع الحماية من النشاط الجذري الضار للأيون، أي ما هي آلية العمل على المستوى الجزيئي (الصورة 2).
"وتتم العملية بالطريقة التالية: بعد خضوع أيون واحد للاختيار، تتغير بنية البروتين بحيث يتم سد مدخل القناة، ولا يمكن لأيونات إضافية الدخول. الأيون الذي مر يدخل الخلية والعياذ بالله يعود. يتيح إدخال الأيونات واحدًا تلو الآخر عبر القناة تحكمًا محكمًا في دخولها إلى الخلية. توضح الآلية كيف تمكنت الخلية من امتصاص الأيونات الضرورية لعمليات مختلفة مع التحكم في إمكاناتها التدميرية." يشرح شوشان.
"يعد البحث خطوة أخرى على طريق فهم الآلية الخلوية لنقل أيون النحاس." ويوضح البروفيسور بن تال: "كما أنه يكشف عن تفرد hCTR1، سواء من حيث البنية العامة أو من حيث آلية النقل، مقارنة بالبروتينات الغشائية التي تنقل الأيونات الأخرى. نظرًا لأنه، كما ذكرنا سابقًا، ينقل hCTR1 أيضًا مادة السيسبلاتين، وهي مادة تستخدم في علاجات العلاج الكيميائي، فإن هذا الفهم له أيضًا آثار على دراسة آلية انتقال السيسبلاتين؛ المعرفة المكتسبة قد تؤدي إلى تحسن في العلاج الكيميائي.

תגובה אחת
لدينا باحثون ممتازون في البلاد