الشريحة الجينية هي تقنية مبتكرة لإجراء اختبارات تفصيلية للكشف عن أوجه القصور أو التجاوزات الصغيرة في الجينوم وتحسين القدرة على التشخيص بشكل كبير
عيديت مايا ومردخاي شوتشات جاليليو
ينقسم علم الوراثة الكلاسيكي إلى فرعين رئيسيين: علم الوراثة الخلوية، وهو علم الوراثة "الخلوي"، الذي يشير إلى جميع المعلومات الوراثية في عبوتها الأساسية - الكروموسومات؛ وعلم الوراثة الجزيئي، علم الوراثة "الرمزي"، حيث يتم فك تشفير تسلسل الحمض النووي للحمض النووي، وهو "الحروف" التي تشفر الوحدة الأساسية للمعلومات، وهي الجين.
يوجد في كل خلية منوية في جسمنا 23 زوجًا من الكروموسومات (إجمالي 46)، منها 22 زوجًا متطابقًا للذكور والإناث، وزوج واحد من الكروموسومات الجنسية: كروموسومان X للإناث وواحد X وواحد Y كروموسوم للذكور. إن حلزون الحمض النووي، وهو تسلسل الحروف التي تشكل المعلومات الوراثية التي يتم ترميزها لبناء البروتينات، يتم طيه وتعبئته داخل الكروموسومات بطريقة منظمة ودقيقة، مما يتيح عمل كل خلية من خلايا الجسم. ويمكنك مقارنة كافة المعلومات الوراثية الموجودة في كل خلية من خلايا جسمنا بموسوعة كبيرة تضم 46 مجلدا تحتوي على العديد من الفصول والمداخل العديدة. كل مجلد من هذا القبيل عبارة عن كروموسوم وبداخله عدد كبير جدًا من أحرف المعلومات.
سنركز في هذه المقالة على علم الوراثة الخلوية والطرق المختلفة لتشخيص أوجه القصور أو التجاوزات في "أحجام" مختلفة أو "فصول" مختلفة فيها. وسنذكر الطرق القديمة والمعروفة من جهة، ومن جهة أخرى سنركز على طريقة وراثية خلوية حديثة تسمى الشريحة الجينية.
طريقة النمط النووي: العد والتلطيخ
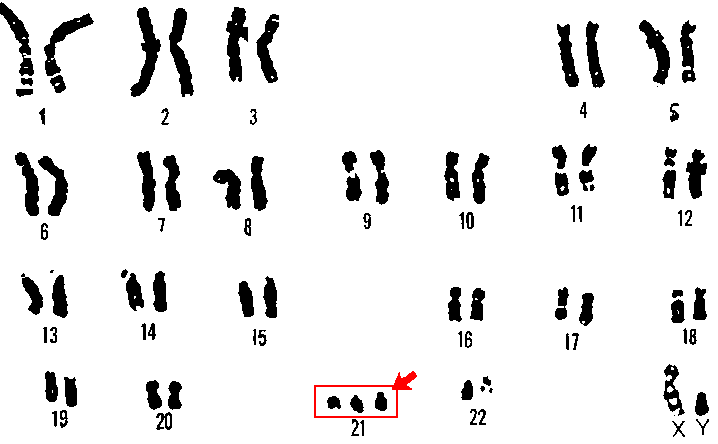
في الطريقة الكلاسيكية والتي تسمى "النمط النووي" والمعروفة في علم الوراثة منذ حوالي 50 عاما، تنظر إلى خلية في مراحل الانقسام ويمكنك رؤية الكروموسومات فيها تحت المجهر الضوئي. باستخدام هذه الطريقة، يتم عد الكروموسومات ومن خلال صبغة خاصة تسمى صبغة جيمزا، ننظر أيضًا إلى بنيتها الداخلية، والتي يُنظر إليها على أنها نوع من التمويه بالأبيض والأسود. باستخدام هذه الطريقة، يتم فحص كمية الكروموسومات وبنيتها، على سبيل المثال في خلايا الدم البيضاء المأخوذة في اختبار الدم العادي، أو من الخلايا الجنينية المستخرجة عن طريق ثقب السائل الأمنيوسي أو اختبار كيسة المشيمة (CVS). كلا الاختبارين عبارة عن اختبارات غازية: في اختبار كيسة المشيمة، يتم الوصول إلى منطقة المشيمة عبر المهبل ويتم أخذ عينة من الخلايا من هناك. في الوخز بالإبر للسائل الأمنيوسي، يتم ثقب الكيس الغشائي (الكيس السلوي) الذي يسبح فيه الجنين (عن طريق جدار البطن وجدار رحم الأم) من أجل سحب عينة من السائل الأمنيوسي. ومن هذه العينات يتم تصفية الخلايا الجنينية وزراعتها في المختبر واختبارها بطريقة النمط النووي باستخدام المجهر الضوئي بحثاً عن الخلايا التي تكون في مراحل الانقسام (الانقسام الفتيلي)، إذ يمكن رؤية الكروموسومات في هذه الخلايا . يجب أن نتذكر أن هذا الإجراء لا يخلو من المخاطر ومن المعروف أن إتباعه يؤدي إلى خطر الإجهاض بنسبة 1:300-1:500 في اختبار السائل الأمنيوسي وحوالي 1:100 في كيس المشيمة امتحان.
يتيح اختبار النمط النووي إمكانية تشخيص المتلازمات الوراثية الناتجة عن نقص أو زيادة في الكروموسومات الكاملة، أو في أجزاء كبيرة داخل الكروموسومات (عدة ملايين من النيوكليوتيدات على الأقل). ومن الأمثلة على المتلازمة التي يتم تشخيصها بهذه الطريقة متلازمة داون، التثلث الصبغي 21 (ثلاثي الكروموسومات عدد 21 بدلا من زوج من الكروموسومات). من الممكن تشخيص متلازمة داون ومشاكل الكروموسومات الأخرى بعد الولادة وعن طريق فحص كيسات المشيمة أو السائل الأمنيوسي أثناء الحمل. ومن الممكن أيضًا إجراء اختبار النمط النووي على الخلايا السرطانية الناشئة من نخاع العظم أو الأعضاء المختلفة، بحثًا عن التغيرات الهيكلية أو الكمية في الكروموسومات التي تشير إلى اختلاف الخصائص السريرية للأورام. على سبيل المثال، في السرطان الذي ينشأ في النخاع العظمي والذي يسمى "سرطان الدم النقوي المزمن" (CML)، يكون التغيير الهيكلي (الانتقال - نسخ جزء الكروموسوم إلى موقع آخر) شائعًا في الخلايا السرطانية، وفي هذه الحالة - وجود اتصال بين الكروموسوم 9 والكروموسوم 22. يؤدي هذا التغيير الهيكلي إلى نمو خلايا نخاع العظم المتحكم فيها وظهور الورم الخبيث. وفقا لهذه التغيرات وغيرها التي يتم ملاحظتها في الخلايا السرطانية، يمكننا في بعض الأحيان تحديد نوع الورم وأحيانا اختيار العلاج الكيميائي الأنسب.
الشريحة الجينية: الكشف عن التغيرات واسعة النطاق
الرقائق الجينية هي تقنية حديثة تسمح بفحص العديد من المناطق (مئات الآلاف من المواقع) في المادة الوراثية للموضوع في وقت واحد. هناك أنواع مختلفة من الرقائق الجينية؛ من بين تلك التي تختبر تغيرات القواعد المفردة (SNP: تعدد أشكال النوكليوتيدات المفردة)، أي التغيير من "حرف" إلى آخر (بين نيوكليوتيد إلى آخر) داخل الشفرة الوراثية، وتلك التي تختبر اختلافات الأجزاء الصغيرة بين عينة المريض وعينة السيطرة. تسمى الشريحة الجينية باللغة العلمية CMA (تحليل المصفوفة الكروموسومية الدقيقة) أو باسمها الآخر Array Comparative Genomic Hybridization، وبالاختصار Array CGH. هذه طريقة وراثية خلوية جديدة، تسمح باكتشاف التغيرات الهيكلية أو الكمية الأصغر من اختبار النمط النووي الكلاسيكي. باستخدام هذه الطريقة، يتم فصل جميع الكروموسومات إلى عدة آلاف من الأجزاء الصغيرة ومقارنتها بأجزاء التحكم. إذا وجدنا نقصًا أو زيادة في مثل هذه القطعة الصغيرة، فيمكننا معرفة محتوى الجينات الموجودة فيها وبالتالي معرفة ما إذا كان من الممكن ربط هذه النتيجة المخبرية بمجموعة الأعراض لدى المريض. لقد تم إجراء هذا الاختبار بالفعل على آلاف الأشخاص الأصحاء، حتى نتمكن من معرفة أي من هذه التغيرات الكمية (النقص أو الزيادة) شائعة بين السكان وموجودة لدى الأفراد الأصحاء، وأي التغيرات نادرة ويمكن أن تسبب نقاط ضعف مثل التخلف العقلي أو العيوب الخلقية. عادةً ما يتم التعامل مع النتيجة الموجودة في واحد من كل مائة فرد سليم (أي في حوالي 1٪ من مجموعة سكانية معينة) على أنها نتيجة شائعة والنتيجة الموجودة بتكرار أقل على أنها نادرة.
باستخدام طريقة الشريحة الجينية، من الممكن اكتشاف مئات المتلازمات الجينية المعروفة، مثل متلازمة الحنك القلبي الوجهي، والمعروفة أيضًا باسم متلازمة فيلو القلبية الوجهية أو متلازمة دي جورج (الناتجة عن نقص جزء صغير من الكروموسوم 22). ) أو متلازمة ويليامز (الناتجة عن نقص جزء صغير من الكروموسوم 7؛ وانظر: "تشققات في"، جاليليو 43 يناير – فبراير 2001). بالمقارنة مع طريقة النمط النووي الكلاسيكية، فإن دقة هذا الاختبار أعلى بما يصل إلى مائة مرة، ومن الممكن اكتشاف أوجه القصور الصغيرة أو التجاوزات في عدة عشرات الآلاف أو مئات الآلاف من النيوكليوتيدات. علاوة على ذلك، باستخدام الطريقة القديمة، من المستحيل تشخيص المتلازمات الناتجة عن نقص مثل هذا الجزء الصغير. ومن ناحية أخرى، فإن التغيرات الهيكلية المتوازنة (مثل النقل المتوازن) لن يتم اكتشافها بواسطة طريقة الشريحة الجينية، لأنه لا يوجد نقص في تسلسل جيني معين، ولكن فقط تغيير في موقعه على سطح الجينوم.
"الصيد" ضرر كروموسوم صغير
توجد تقنية وراثية خلوية أخرى تُعرف باسم FISH (تهجين الفلورسنت في الموقع) منذ سنوات عديدة. في هذه الطريقة، يتم استخدام كاشفات الفلورسنت للبحث بطريقة مستهدفة عن نقص أو زيادة في جزء صغير في مكان معين على الكروموسوم. على سبيل المثال، في متلازمة الحنك المشقوق (متلازمة دي جورج) يتم استخدام كاشف محدد للذراع الطويلة للكروموسوم 22، في القطعة رقم 11، والتي من المعروف أنها مفقودة لدى المرضى الذين يعانون من هذه المتلازمة. يتم إجراء اختبار FISH هذا بسبب الاشتباه في وجود المتلازمة، وذلك بسبب الخصائص السريرية لدى الطفل أو الجنين مثل عيوب القلب والحنك المشقوق والشفة أو نقص المناعة. ومقارنة بهذا الاختبار، فإن الميزة الكبيرة لاختبار الرقائق الجينية تكمن في أنه يكشف المئات من هذه المتلازمات في نفس الوقت، دون الحاجة إلى كاشف مستهدف، وفي الواقع دون اشتباه سريري محدد. يمكن أيضًا إجراء اختبار الرقاقة على المرضى الذين لا نعرف تشخيصهم السريري، مثل المرضى الذين يعانون من التخلف العقلي دون ظهور خصائص سريرية مصاحبة (مثل تلف خلقي في الكلى أو القلب) أو مرضى التوحد. ومن الممكن أيضًا استخدام هذه الطريقة كجزء من التشخيص قبل الولادة من خلال فحص إفرازات المشيمة أو السائل الأمنيوسي حتى بدون وجود أي نتائج لدى الجنين.
هناك شرائح مختلفة من شركات منافسة تستخدم هذه التقنية، على سبيل المثال من Blugnome وSignature Genomics. وتستند جميعها إلى نفس المبدأ، ولكنها تقسم جميع المواد الوراثية قيد الاختبار إلى عدد مختلف من شرائح الحمض النووي. ستكون الدقة في هذا الاختبار أكبر إذا كانت شرائح الحمض النووي أصغر وأكثر عددًا. عندما نأتي للبحث عن تفسير للصورة السريرية لدى المرضى الذين يشتبه في إصابتهم بمتلازمات وراثية، سنستخدم شريحة ذات دقة أعلى. من ناحية أخرى، في فحص الأجنة (إذا كان من عينة من الخلايا الجنينية المستخرجة عن طريق الوخز بالإبر للسائل الأمنيوسي وإذا كان ذلك مناسبا مأخوذة من المشيمة) فإن الرقائق ذات الدقة الأقل تفصيلا تميل إلى استخدامها لتقليل فرصة حدوث للتعامل مع إجابة ذات أهمية سريرية غير معروفة في هذه المرحلة. كلما زاد عدد هذه الاختبارات في إسرائيل وفي العالم، على الأفراد ذوي التخلف العقلي وكذلك على الأفراد الأصحاء من مختلف السكان الأصليين، كلما تراكمت معلومات أكثر ومن ثم سنكون قادرين على معرفة معنى أوجه القصور الصغيرة أو تجاوزات، لبضع عشرات الآلاف أو مئات الآلاف من النيوكليوتيدات (مثل هذه النواقص والتجاوزات شائعة) على صحة الشخص. وفي المستقبل، إذا أصبحت هذه التكنولوجيا مستخدمة على نطاق واسع، فيمكننا أيضًا استخدام الرقائق عالية الدقة في اختبارات الأجنة.
تحليل نتائج الاختبار
هناك ثلاثة خيارات لنتائج هذا الاختبار، وهي:
و. النتيجة الطبيعية: لم يتم العثور على نقص أو زيادة في جزء صغير من الكروموسومات، أو تم العثور على نقص أو زيادة في جزء صغير، وهو ما يُعرف بأنه "اختلاف طبيعي" لدى الأشخاص الأصحاء، لذلك لا يتوقع حدوث مشكلة طبية.
ب. نتيجة غير صحيحة: سنوضح أدناه ما هي الخيارات التي تطرحها هذه النتيجة.
ثالث. نتيجة ليست أهميتها السريرية واضحة تماما: تم العثور على نقص أو زيادة في شريحة كروموسومية صغيرة، مما يعني أنها طبيعية ظاهريا، ولكن قد يكون هناك شك بسيط لا يمكن إثباته في هذه المرحلة بسبب قلة المعلومات في الأدب الطبي.
إذا كانت النتيجة غير طبيعية، أي - تم العثور على زيادة أو نقص في جزء صغير من الكروموسومات، وهو أمر ذو أهمية طبية واضحة - فقد تم العثور على دليل على وجود مؤشر سريري معين. في هذه الحالة هناك عدة خيارات:
و. تم العثور على نقص أو زيادة في جزء صغير من الكروموسومات مما يعني وجود متلازمة وراثية شديدة و/أو تخلف عقلي أو توحد شديد. ومن الممكن التأكد من وجود النقص أو الزيادة في معظم الحالات باستخدام اختبار FISH المحدد. وهذه نتيجة ذات أهمية سريرية واضحة، سواء إذا كانت العينة من مريض أو إذا كانت من خلايا جنينية. أما إذا كانت عينة من الخلايا الجنينية، فيمكن مناقشة الزوجين حول إنهاء الحمل أو الاستمرار فيه. إن وجود التغير الجيني في اختبار الرقاقة لدى المريض أو الجنين يجعل من الممكن اختبار والديه لحاملي هذا التغيير، وذلك لمعرفة كيفية تعريفه: هل هو حدث جديد (de novo) أم أنه حدث بالفعل؟ هل يوجد لدى أحد الوالدين؟وتتم هذه الخطوة من خلال بحث مستهدف عن النقص أو الزيادة لدى الوالدين في اختبار FISH. وفقًا لحاملي الوالدين، من الممكن تقديم استشارات وراثية دقيقة فيما يتعلق باحتمال تكرار المتلازمة في حالات الحمل المستقبلية للوالدين وأفراد الأسرة الآخرين، وحتى تقديم اختبارات تشخيصية لهم للكشف عن النقص أو الزيادة.
ب. تم العثور على نقص أو زيادة في جزء الكروموسومات، وهو ما يعني على الأرجح متلازمة وراثية حادة، واليقين بها مرتفع (أكثر من 30٪) ولكنه ليس مطلقًا. هناك العديد من المعايير التي نأخذها في الاعتبار عندما نقوم بتحليل الأهمية السريرية لنقص أو زيادة هذا الجزء من الكروموسومات. المعيار الأول والأهم هو المعلومات عن الحالات السابقة في الأدبيات الطبية: هل توجد لدى المرضى الذين لديهم صورة سريرية معينة، ومن ثم هناك ميل لتفسير التغير الجيني على أنه مرضي وذو أهمية سريرية، أم أنه موجود في السكان الأصحاء ثم هناك ميل لتفسير التغيير الجيني على أنه غير مهم؟ السبب وراء عدم وجود يقين مطلق في هذه الحالات هو أنه فيما يتعلق بالحالات السريرية مع بعض التغييرات الصغيرة، ما زلنا لا نملك معلومات كافية. في هذه الحالات نقوم بتحليل البيانات وفقًا لحجم الجزء الجيني المفقود أو الزائد ومحتوى الجين الموجود فيه. إذا كانت القطعة كبيرة جدًا، وتحتوي على العديد من الجينات المعروفة بأهميتها في تطور ووظيفة الأعضاء والمسارات الحيوية، أو إذا كانت هناك متلازمات وراثية مندلية معروفة ناجمة عن طفرة نقطية في تسلسل هذه الجينات، فإننا نفترض أن نقصهم الكامل سوف يسبب بعض الصورة السريرية. السمة الرابعة التي تؤخذ في الاعتبار في تحليل نتائج الشريحة الوراثية هي وجود النقص أو الزيادة لدى الوالدين. ورغم أنه تم وصف العديد من حالات التباين في التعبير السريري، إلا أنه عندما يعاني الوالد المصاب بالقصور فقط من صعوبات التعلم، وقد يتسبب نسله في ضعف إدراكي شديد لدرجة التخلف العقلي، لكن يظل وجود النقص أو الزائدة في سيرشدنا أحد الآباء الأصحاء إلى تحليل نتائج الشريحة كالمعتاد.
ومن المهم أن نفهم أنه أمام إجابة غير طبيعية من هذا النوع إذا كانت عينة من الخلايا الجنينية، فمن الممكن المناقشة مع الزوجين حول إنهاء الحمل أو الاستمرار فيه. وحتى في مواجهة مثل هذه النتيجة، وفقًا لنتائج اختبار FISH للوالدين، يمكننا تقييم خطر التكرار في حالات الحمل المستقبلية.
ثالث. تم العثور على نقص أو زيادة في جزء صغير من الكروموسومات، والمعنى السريري له هو التغيرات الصحية المعترف بها والتي يمكن علاجها، على سبيل المثال الميل إلى الإصابة بمرض السكري في سن الشيخوخة. في كثير من الأحيان توجد هذه التغيرات الصحية بين العديد من أفراد الأسرة، وتفسر النتائج ببساطة وجود هذه الظواهر أو السمات فيهم. وإذا تم اكتشافه في الجنين، فلا يشترط إنهاء الحمل.
نتائج غير صحيحة
ما هي فرصة العثور على نتيجة غير طبيعية في عينة دم أحد الأشخاص باستخدام طريقة الشريحة الجينية؟ ومن المهم أن نفهم أن فرصة العثور على نتيجة غير طبيعية، تشير إلى إحدى المتلازمات الجينية التي يمكن اكتشافها بهذه التقنية، تعتمد على مصدر العينة التي تم إرسالها لاختبار الشريحة الجينية.
إذا كانت عينة دم من مريض (طفل أو بالغ) يعاني من تأخر في النمو أو تخلف عقلي، في شكل معزول (يسمى التخلف العقلي غير المتلازمي)، أو بالاشتراك مع نتائج جسدية أخرى (تسمى التخلف العقلي المتلازمي)، فإن العينة فرصة العثور على نتيجة إيجابية تتراوح من -10 20% ومن المهم أن نفهم أنه يتم إرسال عينة دم المريض لإجراء هذا الاختبار في معظم الحالات بعد إجراء اختبار النمط النووي له وتبين أنه طبيعي؛ لذا فإن النتيجة الإيجابية على الشريحة الجينية تمثل تقدمًا كبيرًا من حيث القدرة على التشخيص (على الرغم من أننا لا نزال لا نملك تفسيرًا لجزء كبير من الحالات)، وهي قدرة تشخيصية لم تكن متاحة لنا قبل بضع سنوات فقط. . أما إذا كانت عينة دم من مريض (طفل أو بالغ) مصاب بالتوحد، فإن الفرصة حسب السلاسل المختلفة تتراوح بين 5-10%. أي أنه في أكثر من 90% من حالات التوحد، وخاصة في الحالات الخفيفة، لن نتمكن من إيجاد تغيير في اختبار الشريحة الجينية.
ما هي فرصة العثور على نتيجة غير طبيعية في عينة الخلايا الجنينية على الشريحة الوراثية؟ تتضاءل فرصة العثور على نقص أو زيادة في شريحة وراثية صغيرة في الشريحة الجينية بشكل كبير عندما يتعلق الأمر بأخذ عينات من خلايا الجنين (من السائل الحميد أو الوخز بالإبر للكيس المشيمي) مقارنة بفرصة المرضى الذين يعانون من التخلف العقلي. وتتأثر هذه الفرصة بدرجة الشك وعوامل الخطر التي كانت موجودة في الحمل قبل إجراء الاختبار، وما هو سبب إجراء الاختبار الغزوي لجمع خلايا الجنين في المقام الأول. في طريقة الرقاقة الجينية، يتم استخراج الحمض النووي من مزرعة الخلية أو من عينة مباشرة من السائل الأمنيوسي.
إذا تم إجراء الوخز بالإبر للسائل الأمنيوسي بسبب نتيجة واحدة غير طبيعية في الموجات فوق الصوتية (مثل الأصابع المتعددة، أو الشفافية القفوية غير الطبيعية، أو عيب في القلب أو تشوه هيكلي في الكلى أو الهيكل العظمي)، فإن فرصة وجود نتيجة غير طبيعية في اختبار الرقاقة الجينية هي حوالي الساعة 1:40، بعد أن وجد أن النمط النووي طبيعي. كلما زادت درجة خطورة نتائج الموجات فوق الصوتية، زادت فرصة اكتشاف نقص أو زيادة في جزء صغير من الكروموسومات ويمكن أن تصل إلى 10٪ (عندما يتعلق الأمر بالعيوب المتعددة في الأنظمة الرئيسية مثل القلب والأطراف، الكلى والدماغ).
إذا تم إجراء الوخز بالإبر بسبب تاريخ عائلي - أخ أو طفل مصاب بالتخلف العقلي أو التوحد - فإن فرصة العثور على نتائج غير طبيعية في الشريحة الجينية تبلغ حوالي 1:50-1:100. إذا تم إجراء الوخز بالإبر بسبب عمر الأم أكثر من 35 سنة (السبب الرئيسي لفحوصات السائل الأمنيوسي في إسرائيل) أو بسبب وجود خطر متزايد للإصابة بمتلازمة داون في اختبارات متابعة الحمل الروتينية، مثل الفحص الكيميائي الحيوي في الفترة الأولى وفي الثلث الثاني من الحمل، فإن احتمال ظهور نتائج غير طبيعية على الشريحة يكون حوالي 1:50. من المهم أن نفهم أنه حتى في حالات الحمل التي تم فيها إجراء الوخز بالإبر دون أي سبب طبي، ولكن بناءً على إرادة الوالدين فقط، لا تزال هناك فرصة لاكتشاف غير طبيعي في الشريحة الجينية، ولكن مع احتمال أقل، حوالي 1 :100-1:200.
متى ينصح بإجراء اختبار الشريحة الجينية عندما يكون من المعروف أن النمط النووي الكلاسيكي ليس طبيعيا؟ كما ذكرنا سابقًا، يكشف اختبار النمط النووي عن أوجه القصور أو التجاوزات أو التغيرات الهيكلية الكبيرة في الكروموسومات. في معظم الحالات تكون إجابة هذا الاختبار قاطعة: إجابة صحيحة أو غير صحيحة، كما في حالة التثلث الصبغي، مثل التثلث الصبغي 21 الذي يسبب متلازمة داون، أو التثلث الصبغي الآخر: تثلث الصبغي 13 (متلازمة باتو)، التثلث الصبغي 18 (متلازمة إدواردز) ، تثلث الصبغي الجنسي X. هناك حالات يظل فيها الشك فيما يتعلق بالأهمية السريرية للنتائج في النمط النووي، كما هو الحال في حالات وجود فائض في شريحة الكروموسومات المعزولة، التي يكون محتواها الجيني غير واضح ( نتيجة تسمى "العلامة" في اللغة المهنية)، أو في حالات تبادل أجزاء من المادة الوراثية بين اثنين من الكروموسومات (نتيجة تسمى النقل). في هذه الحالات، يمكن أن يضيف اختبار الشريحة الجينية معلومات أساسية - إذا كان هناك نقص أو زيادة في المعلومات الوراثية لدى المريض أو الجنين. إن اكتشاف شريحة وراثية غير طبيعية يمكن أن يفسر الصورة السريرية لدى المريض، أو يؤكد الشك في أن الصورة السريرية التي لوحظت في الجنين هي نتيجة لتغير الكروموسومات ونقص أو زيادة الجينات الأساسية. من ناحية أخرى، تزيد إجابة الشريحة الجينية الطبيعية من الثقة في أن الحمل الجيني للمريض أو الجنين متوازن، وأن اكتشاف الكروموسومات الذي لوحظ في اختبار النمط النووي على الأرجح غير مهم سريريًا.
اختبار الرقاقة الجينية: المزايا والعيوب
كما تتذكر، هذا اختبار تبلغ دقته 100 مرة أعلى من اختبار النمط النووي الكلاسيكي، وبالتالي فإن اختبار الرقاقة يكتشف أوجه القصور أو التجاوزات التي تكون صغيرة جدًا بحيث لا يمكن اكتشافها بواسطة الاختبار القديم. ثانيًا، إنه شامل ويشخص التغيرات في جميع معلوماتنا الوراثية، حتى بدون الاشتباه السريري في وجود متلازمة معينة، على عكس اختبارات FISH الموضعية. بالإضافة إلى ذلك، فإن هذه الطريقة قادرة أيضًا على تشخيص التغيرات التي لا توجد إلا في بعض خلايا الجسم، في حالة تسمى "الفسيفساء"، حتى عندما تكون في 7% فقط من خلايا الجسم، وهي نتيجة لم يتم اكتشافها في اختبار النمط النووي. كما أن هذا اختبار سريع نسبيًا ويتم الحصول عليه بعد عشرة أيام إلى أسبوعين. تعتبر الإجابة السريعة مهمة بشكل خاص عند إجراء الاختبار على عينة من الخلايا الجنينية عندما يريدون الحصول على إجابة في أقرب وقت ممكن من الحمل للسماح للوالدين باتخاذ قرار بشأن الخيارات المتاحة لإنهائه.
يوصى بإجراء اختبار الرقائق لكل مريض يعاني من التخلف العقلي أو لديه اشتباه في وجود متلازمة وراثية لا يمكن العثور على تفسير لها من خلال اختبار النمط النووي أو الاختبارات الروتينية الأخرى. من الممكن التفكير في إجراء الاختبار في المرضى الذين يعانون من مرض التوحد أو في أولئك الذين تم تشخيص إصابتهم بالعديد من العيوب الخلقية (مثل عيب القلب الخلقي). إن المؤشرات الخاصة بإجراء اختبار الشريحة الجينية أقل وضوحًا ومتفق عليها عندما يتعلق الأمر بالخلايا الجنينية. هناك إجماع على أنه إذا تم الكشف عن عيوب هيكلية في الأعضاء المختلفة عن طريق الموجات فوق الصوتية أثناء الحمل، فينصح بإجرائها: أما بالنسبة لحالات الحمل الأخرى التي يتم فيها إجراء وخز السوائل الحميدة لأسباب أخرى مثل ارتفاع عمر الأم أو دون أي سبب. لسبب طبي، ليس من الواضح في هذه المرحلة ما إذا كان الأمر يستحق إجراء الاختبار وما هي نسبة التكلفة - الاستفادة من أدائه. قرار نقابة أطباء الوراثة في إسرائيل في هذه المرحلة هو إبلاغ كل امرأة تخضع لفحص غزوي أثناء الحمل بإمكانية إجراء اختبار الشريحة الجينية على عينة الخلايا الجنينية، والسماح لها باختيار إجراء ذلك الاختبار أم لا . ويجب أن نتذكر أنه عند استخدام أي تقنية جديدة قد تكون هناك أخطاء في فك تشفير الإجابات؛ النتائج التي تم فك تشفيرها حاليًا على أنها طبيعية قد تتحول في المستقبل إلى الإشارة إلى مشاكل والعكس صحيح: التغييرات التي يتم فك تشفيرها حاليًا على أنها غير طبيعية قد يتبين في المستقبل أنها حميدة.
ومن أبرز عيوب هذه الطريقة، ومن العوائق أمام جمع المعلومات في هذا المجال، ارتفاع تكلفة الاختبار. يتم إجراء هذا الاختبار حاليًا في بعض معاهد الجينات في إسرائيل وكذلك في بعض المختبرات السريرية الخاصة في العالم وبتكلفة لا تقل عن 4,000 شيكل. التمويل يكون من الجيب الخاص للمريض وعائلته، وبالتالي فإن العديد من المرضى الذين لا تستطيع ذراعهم تحقيق ذلك يتم حرمانهم من الاختبار.
סיכום
الاستشارة الوراثية هي إجراء معقد ومهم للعديد من العائلات. إن فك رموز اختبار الشريحة الجينية بعد الفحص الذي يجريه شخص مؤهل يمكن أن يسهم بشكل كبير في قرارات الأسرة وأولياء الأمور في المستقبل. لا يحل اختبار الشريحة الجينية محل اختبار النمط النووي القياسي الذي يتم إجراؤه على عينة الدم أو السائل الحميد. وعلى الرغم من التحفظات، فإن اختبار الشريحة الجينية هو اختبار مهم، وقد اكتسبنا بالفعل الكثير من الخبرة، وهو يزيد من الدقة ويزيد من نسب الكشف والتشخيص. على الأرجح، في المستقبل القريب، عندما تزداد المعرفة والخبرة، سيكون هذا الاختبار جزءًا من الاختبارات الروتينية التي يتم إجراؤها على المرضى وعينات الخلايا الجنينية.
دكتور عيديت مايا تخرجت من كلية الطب في الجامعة العبرية في القدس بدرجة دكتوراه في الطب. متخصص في الطب الباطني ويتخصص حاليًا في تخصص فائق في علم الوراثة الطبية في معهد رافائيل ريكاناتي لعلم الوراثة، مستشفى بيلينسون، المركز الطبي رابين في بيتح تكفا.
البروفيسور مردخاي (موتي) شوحط تخرج من كلية الطب بجامعة تل أبيب بدرجة دكتوراه في الطب. متخصص في طب الأطفال وعلم الوراثة الطبية ومدير معهد رافائيل ريكاناتي لعلم الوراثة في مستشفى بيلينسون، المركز الطبي رابين في بيتح تكفا. أستاذ علم الوراثة الطبية في جامعة تل أبيب.

تعليقات 5
إذا فهمت بشكل صحيح، فيمكن أن يكون لدى الأشخاص الأصحاء أوجه قصور أو تجاوزات في أجزاء معينة من الكروموسومات التي لن يكون لها أي تعبير سريري؟
أم سيكون لديهم مظهر سريري "خفيف" مثل الميل إلى الإصابة بمرض السكري على سبيل المثال؟
ولا يبدو لي... أن ما قد يمنع التطورات والانتخاب هو التشريع... لكن الظاهر أن التشريع لن يمنع الانتخاب الذي يمنع الأمراض الوراثية. لذلك سيكون هناك اختيار، انظروا إلى ما يحدث اليوم بالفعل مع اختبارات الحمل، من بين 200,000 حالة حمل في إسرائيل، تم إنهاء 50,000 حالة بسبب نتائج وراثية أو خفقان القلب أثناء الحمل (وهو ما لا يضمن بشكل عام دقة 100٪) إسرائيل الأولى في اختبارات الحمل التي ليست ضرورية بالضرورة على سبيل المثال.
إذا كان هناك اختبار سريع للحمض النووي، فهذا يعني أنه يمكن اختبار كل حيوان منوي بسرعة. ربما…
أما بالنسبة للشيخوخة، فمن المحتمل أن يتغير هناك أيضًا يومًا ما، فقد وجدوا بالفعل طريقة لتمديد التيلوميرات، علميا...
http://www.tasciences.com/ta-65/
ناهيك عن زراعة الأعضاء، وزرع الخلايا لاستعادة الأعضاء، والحبوب التي تعمل على تشغيل الجزء المتوقف من الحمض النووي لدينا والذي يسمح بزيادة 30٪ أخرى في متوسط العمر المتوقع (100+ أو نحو ذلك)، وما إلى ذلك ...
ابحث في BBC.Horizon.S48E11.Dont.Grow.Old
هناك يتعلق ببعض الأشياء، وجزء آخر عن البرامج الأخرى.
كما اعتادوا أن يعيشوا ما يصل إلى 30 عامًا، واليوم أصبح عمرهم أكثر من 80 عامًا في المتوسط
من الممكن أن نصل خلال السنوات العشر إلى العشرين القادمة إلى قدرة تحسين مضاعفة... ما يصل إلى 10 سيكون لديك
التقاعد عند سن 120 سنة
؟؟؟؟
لا تتكتم يا عمري، التطور القديم البطيء لن يذهب إلى أي مكان وهو على وشك مفاجأة كل من تم إصلاحه من خلال برعم كبير في التناوب.
حسنًا، الفيلم قادم قريبًا..
نهاية التطور البطيء..
كلما زادت سرعة ترجمة الحمض النووي، زادت سرعة اختيار النسل من بين ملايين البذور... تمامًا كما في الفيلم