بحث إسرائيلي يكشف: كيف يهرب الطفيلي القاتل من جهاز المناعة
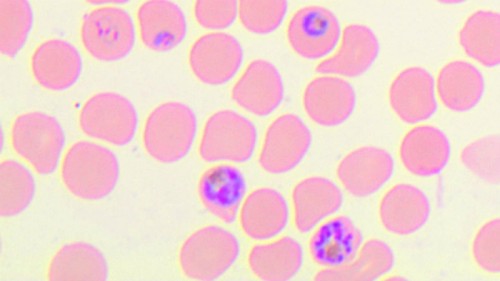
بالنسبة لأولئك الذين يعيشون في دولة متقدمة، يبدو أن الملاريا قد اختفت بالفعل من العالم. وبالفعل، منذ تجفيف المستنقعات، والقضاء على معظم البعوض، اختفت الملاريا من العالم. الغرب من ناحية أخرى، لا تزال الملاريا شائعة جدًا في العالم الثالث - حيث يصاب بها الملايين، خاصة في أفريقيا وجنوب شرق آسيا، ويموت حوالي مليون شخص بسبب الملاريا كل عام، معظمهم من الأطفال الصغار والنساء الحوامل. التفاوت الكبير في معدلات الإصابة بالأمراض بين المناطق يرجع أيضًا إلى أسباب مناخية، فمن الصعب جدًا إبادة البعوض في المناطق الاستوائية حيث تكثر الأمطار ودرجات الحرارة المرتفعة على مدار السنة (الضرورية لتطور البعوض)، ولكن بشكل أساسي لأسباب اقتصادية. في البلدان غير المتقدمة، هناك وسائل أقل لإنشاء بنى تحتية فعالة لتجفيف المستنقعات، ومن الصعب إنشاء نظام منظم لإبادة البعوض، والأهم من ذلك كله أنه لا يوجد استثمار كافٍ للموارد في تطوير طرق جديدة ومبتكرة. الأدوية أو اللقاحات الفعالة للملاريا. ومن المرجح أن المرض كان سيقتل مئات الآلاف في الولايات المتحدة وأوروبا الغربية كل عام، إذ كان هناك منذ فترة طويلة لقاح فعال ضده. يوجد اليوم العديد من الأدوية الفعالة للوقاية من الملاريا والتي يتم إعطاؤها للسياح قبل القدوم إلى المنطقة المصابة. ومع ذلك، فإن علاج السكان بهذه الأدوية على نطاق واسع ليس على جدول الأعمال، سواء من حيث التكلفة العالية أو بشكل رئيسي لأن طفيليات الملاريا تطور مقاومة للأدوية بسرعة، وهي عملية ستحدث بسرعة أكبر مع تقدم البشرية. يتوسع استخدام الدواء مما سيؤدي بالطبع إلى فقدان فعالية الدواء خلال فترة زمنية قصيرة من بداية استخدامه. ولذلك أجمع العلماء على أن الحل الفعال ضد الملاريا هو تطوير لقاح. ولكي نتمكن من تنفيذه، يجب أن يكون اللقاح سهل الاستخدام حتى في الظروف الصعبة (على سبيل المثال، لا يتطلب تجميده)، وفعالاً على المدى الطويل (لأنه من الأصعب بكثير إدارة عمليات التطعيم المتكررة والخدمات الطبية). المتابعة في العالم الثالث)، وقبل كل شيء - رخيصة. ولا تؤدي هذه المتطلبات إلا إلى زيادة التحدي الذي يواجهه العلماء الذين يحاولون تطوير لقاح للملاريا، ولكن التحدي الرئيسي في تطوير مثل هذا اللقاح يكمن في التعامل مع واحد من أكثر الأنظمة البيولوجية تعقيدًا -وإبهارًا- التي تطورت في الطبيعة.
الدم واللعاب والعضات
سبب الملاريا هو طفيل وحيد الخلية يسمى البلازموديوم. على عكس البكتيريا أو الفيروسات، فإن البلازموديوم عبارة عن خلية "حقيقية"، تشبه في كثير من النواحي خلايا الجسم. وينتقل الطفيل بين البشر عن طريق لدغات بعوضة الأنوفيلة. في الواقع، إنها ليست لدغة، بل لدغة - وبشكل أكثر دقة "وجبة دم" لأنثى البعوض، التي تتغذى على البروتينات الموجودة في الدم. أثناء الوجبة، تقوم البعوضة بحقن اللعاب في الجرح. يحتوي اللعاب على مواد مخدرة (إذا كانت اللدغة مؤلمة، فإن فرص البعوض في الاستمرار في طريقها بأمان، دون أن يتم اكتشافها)، بالإضافة إلى مواد مضادة للتخثر، للسماح للبعوضة بامتصاص الدم دون تدخل، ستقل بشكل كبير. وفي اللعاب تسبح له أيضًا طفيليات الملاريا، ويتم حقنها في دم الشخص. وفي وقت قصير جدًا (أقل من ساعة)، تخترق الطفيليات من مجرى الدم إلى نوع معين من خلايا الكبد، وتبدأ في الخلط بسرعة هناك. وبعد بضعة أيام، تنفجر خلايا الكبد من حمولة الطفيليات، وتنطلق الطفيليات إلى الدم. سيعود عدد قليل منها ويغزو خلايا الكبد، لكن معظمها سيغزو خلايا الدم الحمراء، وينمو بداخلها أثناء تغذيتها على محتوياتها، بل ويستمر في التكاثر. وبعد فترة زمنية معينة (يومين أو ثلاثة أيام) تتفكك الجلطة الدموية وتتحرر الطفيليات منها. ستخترق الغالبية العظمى منها على الفور خلايا الدم الحمراء الجديدة وتستمر في التكاثر داخلها بالطريقة المعتادة: تنمو الخلايا الطفيلية وتنقسم إلى خلايا جديدة. ومع ذلك، فإن بعض الطفيليات تمر بعملية مختلفة، وتتطور في خلايا الدم الحمراء إلى خلايا قادرة على إنتاج الخلايا الجنسية. وعندما تصل كريات الدم الحمراء التي تحتوي على هذه الخلايا إلى أمعاء البعوضة، تستشعر الخلايا الطفيلية التغيرات الكيميائية حولها وانخفاض درجة الحرارة، وتبدأ بإنتاج خلايا طفيلية ذكرية أو أنثوية. يتم إطلاقها من خلايا الدم الحمراء، وتمر عبر أمعاء البعوض للتكاثر الجنسي. وبعد عدة دورات من التكاثر الجنسي، تظهر أيضًا الطفيليات اللاجنسية (التي تتكاثر بالانقسام الطبيعي). تخترق جدار أمعاء البعوضة، وتهاجر إلى غدتها اللعابية. ومن هناك يتم حقنها في الدم بينما تأكل البعوضة قلبها، مما يؤدي إلى إصابة شخص آخر بالملاريا. تتسبب الملاريا في تلف الكبد، لكن الضرر الرئيسي يحدث بسبب تلف خلايا الدم الحمراء والمواد السامة التي تنشأ فيها بسبب نشاط الطفيل، وتنطلق في الدم عندما تتحلل الخلايا. تشمل أعراض الملاريا ارتفاع درجة الحرارة والألم والقيء في بعض الأحيان. ظاهرة أخرى هي أن الطفيلي يجعل خلايا الدم التي يحتوي عليها لزجة، فهي تلتصق بجدار الأوعية الدموية، مما يمنعها من الوصول إلى الطحال، حيث يقوم الجهاز المناعي بتكسيرها. ومع ذلك، يمكن لهذه العدوى أيضًا أن تؤدي إلى انسداد في الأوعية الدموية الصغيرة - وعندما يحدث هذا - بشكل رئيسي في الدماغ والكلى والرئتين، يمكن أن يكون الضرر قاتلاً.
استبدل البروتينات
إن طفيليات البلازموديوم، التي تسبب الملاريا، ليست مجموعة موحدة. هناك المئات من الأنواع المختلفة من البلازموديوم، والتي تسبب المرض للعديد من الحيوانات. ومن بين هذه الأنواع أربعة أنواع تسبب المرض للإنسان، وأحدها - Plasmodium falciparum - هو المسبب لأخطر وأخطر الأمراض. وكما ذكرنا فإن جهاز المناعة قادر على مهاجمة طفيليات الملاريا وتدميرها. وهذا تحدٍ معقد إلى حد ما، لأن معظم أشكال الطفيليات تكون معظم الوقت داخل خلايا الدم (أو خلايا الكبد)، ولا تتعرض بشكل مباشر لخلايا الجهاز المناعي. ومع ذلك، عندما يكون الطفيل داخل خلايا الدم الحمراء، يتم عرض بعض بروتيناته على السطح الخارجي للخلايا، وهي التي تسبب التصاقها بالأوعية الدموية. يمكن للجهاز المناعي التعرف على هذه البروتينات ومهاجمتها، وهو ما يحدث بالفعل. لسوء الحظ، فإنه يفعل ذلك ببطء شديد، وإلى أن يتمكن الجهاز المناعي من الاستجابة - تتكاثر طفيليات الملاريا بسرعة وتسبب الكثير من الضرر. لماذا تكون استجابة الجهاز المناعي بطيئة جدًا؟ اتضح أن الطفيلي لديه طريقة للهروب من جهاز المناعة. كما ذكرنا، توجد بروتينات معينة للطفيلي خارج خلية الدم الحمراء عندما تتكاثر داخلها. ينتج الجهاز المناعي أجسامًا مضادة تتعرف على البروتين الغريب، وترتبط به وتنشط دفاعًا مناعيًا فعالًا ضده - وهي تمثل هدفًا لخلايا الدم البيضاء التي تتمثل مهمتها في تحطيم وتدمير أي غازي. جهاز المناعة هو نظام تعليمي، وخلاياه قادرة على إنتاج جسم مضاد فعال ضد أي بروتين، حتى لو لم يقابله من قبل، لكن هذا يستغرق بضعة أيام. ويستغل الطفيل هذه الأيام بشكل جيد، وبحلول الوقت الذي تصل فيه الأجسام المضادة، فإنه يستبدل البروتين الخارجي ببروتين آخر، له نشاط مماثل، ولكن تركيبته مختلفة قليلاً، ولا تتعرف الأجسام المضادة المنتجة ضد البروتين الأصلي. هو - هي. مرة أخرى، ستمر بضعة أيام حتى يتم إنتاج الجسم المضاد المناسب، ومرة أخرى يقوم الطفيل بتغيير بروتينه إلى نسخة أخرى مختلفة قليلاً. كيف يفعل ذلك؟ البروتين الذي يتسبب في التصاق خلايا الدم الحمراء لا يتم إنتاجه من جين واحد، مثل معظم البروتينات. هناك عائلة كاملة مكونة من حوالي 60 جينًا تنتج نسخًا بديلة من هذا البروتين، ولهذا السبب تسمى عائلة البروتينات بأكملها var (اختصار للتنوع). وهذا يعني - أن الطفيل يمكنه البقاء في الدم لعدة أسابيع وأشهر قبل أن ينجح الجهاز المناعي في القضاء عليه، وفي هذه الأثناء يمكن أن يسبب الكثير من الضرر، وحتى قتل المريض. ومع ذلك، فإن المعرفة العلمية حول هذا النظام المعقد لا تزال قليلة جدًا. كيف ينشط الطفيل جينًا واحدًا فقط من بين عشرات الجينات، بينما يتأكد في الوقت نفسه من بقاء جميع الجينات الأخرى معطلة؟ كيف يقرر متى يتم استبدال الجين المعبر عنه؟ ولماذا يستمر في استبدال الجينات النشطة من وقت لآخر، حتى عندما تنمو الطفيليات في أنبوب اختبار، ولا تتعرض لتهديدات الجهاز المناعي؟ يحاول مختبر البروفيسور رون دزيكوفسكي، في كلية الطب في الجامعة العبرية ومعهد إيمريك، تقديم إجابات على هذه الأسئلة.

كاتم الصوت والمنشطات
وفي العمل الذي قاده الطالب البحثي إنبار عميت أبراهام، اكتشف الباحثون أن الكيان المسؤول عن التعبير عن جين معين هو جزيء RNA طويل. في معظم الخلايا، يتم تخزين المادة الوراثية في النواة على شكل DNA. الحمض النووي الريبوزي (RNA) هو جزيء مشابه للحمض النووي، وعادة ما يستخدم لإنشاء "نسخة عاملة" من الحمض النووي - عندما تنتج الخلية بروتينًا يعتمد على الحمض النووي الموجود في النواة، فإنها لا تزيل المادة الأصلية، ولكنها تخلق نسخة من الحمض النووي. القسم المختص (في جزيء RNA)، والنسخة هذه هي التي تذهب إلى آلات إنتاج البروتين خارج نواة الخلية. ومع ذلك، فإن الحمض النووي الريبوزي (RNA) له استخدامات أخرى، وهي في هذه الحالة التحكم في تنشيط الجينات.
في كثير من الأحيان، يقوم عامل خارجي يرتبط بموقع معين في الجين، بتنشيط أو تعطيل التعبير عن هذا الجين - أي أنه يؤدي إلى إنتاج الحمض النووي الريبي (ومن ثم البروتين) أو التوقف عن إنتاجه. في طفيل الملاريا، اكتشف أميت أبراهام ودزيكوفسكي وزملاؤهما أن وظيفة التحكم تنتمي إلى جزء معين من الحمض النووي الريبوزي: عندما يرتبط الحمض النووي الريبي بواحدة من عشرات جينات فار، يتم إنتاج هذا البروتين المعين فقط، ويتم إنتاج جميع الجينات الأخرى. يتم إسكاتهم. ولم يكتف الباحثون بتحديد جزيء الحمض النووي الريبوزي الذي ينشط الجين المحدد، بل حددوا أيضًا الحمض النووي الذي يرمز له، وهو جزء معين داخل ذلك الجين.
وقد سمح لهم ذلك بإجراء تجارب خاضعة للرقابة: حيث قاموا بإنشاء طفيليات معدلة وراثيًا، حيث كان للباحثين سيطرة على ذلك الجزء من الجين المسؤول عن إنتاج الحمض النووي الريبوزي (RNA) المهم. وعندما تسببوا في إنتاج الكثير من هذا الحمض النووي الريبوزي (RNA)، أصبح الجين الخاص بالطفيلي نشطًا في الوقت الذي كان ينبغي إسكاته. وبدلاً من ذلك، أدى منع التعبير عن الحمض النووي الريبوزي (RNA) إلى شلل الجين الذي كان من المفترض أن يكون في حالة نشطة. وفي دراسات سابقة، كشف دزيكوفسكي وزملاؤه عن جزء من الآلية التكميلية، واكتشفوا العديد من المواد المشاركة في إسكات جينات فار في طفيلي الملاريا. وفي الدراسة الجديدة التي نشرت مؤخرا في أكاديمية بيتون PNAS الأمريكية للعلوميشرح الباحثون لأول مرة الآلية التي تمكن نشاط جين معين، عندما يتم إسكات جميع الجينات الأخرى. يوضح دزيكوفسكي: "يمكن أن تسمح لنا النتائج بتطوير طرق للعمل ضد طفيل الملاريا". "يمكننا إيجاد طريقة لمنعه من تفعيل الجين الذي يهتم به، وبالتالي إيقاف المرض، أو بدلا من ذلك، نجبره على تنشيط جميع الجينات، وبالتالي منع قدرته على الهروب من جهاز المناعة والسماح له بتدميره ".
أنقذ حياة
إن البحث الذي أجراه دزيكوفسكي وزملاؤه، والذي تم تمويله جزئيًا من قبل الأكاديمية الوطنية الإسرائيلية للعلوم، يعد خطوة كبيرة نحو تطوير طرق فعالة لمكافحة الملاريا، ولكن لا يزال هناك طريق طويل لنقطعه قبل فك رموز جميع أسرار الملاريا. طفيلي متطور. يعرف الباحثون الآن كيف يتم تنشيط جين معين من العائلة الكبيرة، لكنهم ما زالوا لا يعرفون الكثير عن آلية التحكم في النظام: ما الذي يجعل الطفيلي يحل محل الجين النشط في وقت معين، وكيف يعرف الطفيلي كيفية تنظيم نشاط الجينات (وعدم تنشيط نفس الجين مثلاً مرتين في وقت قصير)، وكيف -إن حدث ذلك- يتم التنسيق بين الخلايا الطفيلية- بحيث تقوم بتنشيط نفس الجينات في نفس الوقت الوقت، وعدم تعريض أصدقائهم لنشاط الجهاز المناعي. وبفضل أحدث الإنجازات، حصل المختبر على منحة بحثية كبيرة من الاتحاد الأوروبي، للسماح للباحثين بالاستفادة من معرفتهم بالآليات المعقدة للملاريا، وتطوير لقاح يمكن أن ينقذ حياة مئات الآلاف من الناس.
المزيد عن الموضوع على موقع العلوم:

تعليقات 3
نعم.
خطأ في السطر 2 في فصل "كاتمات الصوت والمنشطات"، Tsel RNA هو جزيء مشابه للحمض النووي
أعجبتني بالرغم من أنني لم أفهم بشكل كامل شرح آلية التفعيل والتعطيل للـ var.
ييجال