وصمم علماء المعهد إنزيمًا صناعيًا، وأخضعوه لعملية تطور في أنبوب اختبار، وقاموا بتحسين أدائه

وفي المنافسة الوثيقة القائمة بين الطبيعة والإنسان، فاز العلماء مؤخراً بعدة نقاط مهمة، عندما تمكنوا من خلق إنزيم جديد من لا شيء، من نوع غير موجود في الطبيعة. ويفتح هذا الإنجاز الباب أمام مجموعة متنوعة من التطبيقات المستقبلية، في مجالات الطب والصناعة. إن الإنزيمات هي بلا شك مثال صارخ على إنجازات التطور. وتقوم هذه الآلات الجزيئية، التي بدونها لا تكون الحياة ممكنة، بجميع العمليات الكيميائية التي تجري في الجسم الحي. لقد أدت ملايين السنين من الانتقاء الطبيعي إلى تحسين نشاطها وتحسينه، بحيث أصبحت قادرة على تسريع معدل بعض التفاعلات الكيميائية بمليارات بل وأكثر. من أجل إنشاء إنزيم جديد، غير موجود في الطبيعة، يلزم فهم شامل لمبادئ العمل وبنية الإنزيمات، وقدرة متقدمة في مجال هندسة البروتين.
ونجح فريق من العلماء من جامعة واشنطن في سياتل ومعهد وايزمان للعلوم في هذه المهمة، وذلك لأول مرة في العالم. وقد نشرت نتائج البحث مؤخرا في مجلة الطبيعة.
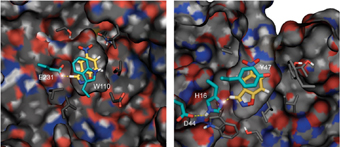
الإنزيم هو محفز بيولوجي. إنه جزيء بروتين مصنوع من "سلسلة" من الأحماض الأمينية، والتي تطوى لتشكل بنية محددة ثلاثية الأبعاد. واقترب فريق الباحثين، في الخطوة الأولى، من تصميم قلب الآلة -"الموقع النشط"- الذي يتم فيه التفاعل الكيميائي. الدور الذي نسبه العلماء للإنزيم الجديد هو إزالة بروتون من ذرة الكربون. ولتحقيق هذه الغاية، قاموا بإنشاء مصفوفة تحتوي على حمض أميني يتمثل دوره في "التقاط" البروتون، وأحماض أمينية إضافية تعمل على تسريع عملية نقل البروتون.
وكانت الخطوة التالية في العملية هي تصميم الهيكل الإنزيمي، أي تحديد تسلسل ما يقرب من 200 من الأحماض الأمينية التي تشكل البروتين. ومن الواضح أن عدد طرق ترتيب الأحماض الأمينية من 20 نوعًا مختلفًا، في سلسلة مكونة من 200 وحدة، يكاد يكون لا نهائيًا. لكن في الواقع، لا يأخذ في الاعتبار سوى عدد محدود من الاحتمالات، لأن تسلسل الأحماض الأمينية يحدد البنية المكانية للإنزيم، وبالتالي يؤثر أيضًا على نشاطه. استخدم البروفيسور ديفيد بيكر من جامعة واشنطن في سياتل أساليب محوسبة لمسح عشرات الآلاف من التسلسلات المحتملة، وحدد موقع حوالي 60 هيكلًا قادرًا على دعم الموقع النشط المصمم. ثمانية منها نجحت في الانتقال من مرحلة النموذج الحاسوبي إلى مرحلة البروتين في المختبر، وتبين أنها نشطة بيولوجيا. ومن بين هذه الإنزيمات، وصل الإنزيمان الأكثر فعالية إلى "المرحلة النهائية". قامت الدكتورة أورلي ديم بوتبول والدكتورة شيرا ألبيك، من قسم البيولوجيا الإنشائية في معهد وايزمان للعلوم، بفك رموز البنية المكانية لهذه الجزيئات الإنزيمية، وأكدا أن الهياكل التي تم إنشاؤها عمليًا تكاد تكون مطابقة تمامًا لتلك التي تم تصميمها وتصنيعها. مصممة باستخدام برامج الكمبيوتر.
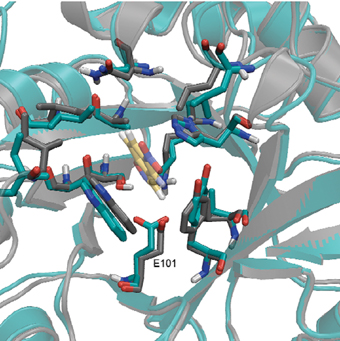
عند هذه النقطة، كانت كفاءة الإنزيمات الجديدة أقل بكثير من كفاءة الإنزيمات الطبيعية التي تم إتقانها على مدى ملايين السنين من التطور. هنا كان من الممكن أن يواجه البحث الطموح صعوبة كبيرة، إلا أن البروفيسور دان توفيق وطالبته البحثية أولغا خيرسونسكي من قسم الكيمياء البيولوجية في معهد وايزمان، طورا طريقة تسمح لجزيئات البروتين بالمرور بعملية تطور متسارعة والتي تحاكي التطور الطبيعي. تعتمد هذه الطريقة على إحداث طفرات عشوائية، ومسح مجموعة متنوعة من الإنزيمات التي تم إنشاؤها، من أجل العثور على تلك التي حسنت كفاءتها. وتمر هذه الإنزيمات بجولة أخرى من الطفرات، ولا سمح الله. أدت سبع دورات من "التطور في المختبر" إلى تحسين كفاءة الإنزيمات الجديدة 200 مرة مقارنة بكفاءتها الأصلية، مما سمح لها بتسريع التفاعل المختار مليون مرة مقارنة بالتفاعل الكيميائي الذي يحدث بدون إنزيم.
وهكذا، على سبيل المثال، تسببت الطفرات في منطقة قشرة الموقع النشط في حدوث تغييرات مكانية صغيرة في بنية الموقع، مما أدى إلى تصحيح العيوب في التخطيط المحوسب لموضع الأحماض الأمينية في الموقع النشط. وتبين أيضًا أن تصحيح العيوب الصغيرة، عند مستوى جزء من المليون من المليمتر، يؤثر بشكل كبير على معدل مرور البروتون. وقد أدت طفرات أخرى إلى زيادة مرونة الإنزيم، مما ساعد على تحرير المنتج من الموقع النشط بسرعة أكبر.
يقول البروفيسور توفيق: "إن الجمع بين التقنيات - تحديد البنية من خلال التخطيط المحوسب، والعملية التطورية في المختبر - يفتح آفاقًا جديدة في إنتاج الإنزيمات الاصطناعية". "بفضل هذا البحث، أصبحنا نفهم بشكل أفضل بنية الإنزيمات وطرق عملها. وهذا الفهم سيمكن من تصميم وإنتاج الإنزيمات لتطبيقات لم تفكر فيها الطبيعة، مثل إزالة السموم، وإنتاج الأدوية، والعديد من العمليات الأخرى.

تعليقات 7
كان يقصد إزالة بروتون (H+) من ذرة الكربون في السلسلة
النقطة الصحيحة.
أنا أيضًا انزعجت عندما قرأت هذا ثم نسيت التعليق.
يبدو مثل الخيمياء.
إزالة بروتون من ذرة الكربون؟ إنزيم؟ يرجى تصحيح…
واو واو واو…! يا له من خلق مذهل! مهم جدا للمستقبل
تم تصحيح ترتيب الأرقام. شكرا على التعليق.
العالم الجزيئي يذهلني بكل بساطة في كل مرة. المجد للباحثين.
إلى محرر المقال:
تم عكس ترتيب الأرقام في الأرقام.
إلى كل حمقى التطور:
لذا أخبرني من فضلك، كيف يمكننا، على الرغم من عدم وجود تطور، أن نتمكن من استخدامه في أي مجال نريده.
في الفكرة الثانية: من الأفضل عدم القول.