أريد في المقال الحالي أن أتطرق إلى الطريقة التي تم بها تطوير لقاحي فايزر وموديرنا، وكيف حصلوا على الموافقة الطارئة، وماذا يعني ذلك في النهاية بالنسبة لمستوى أمانهم وفعاليتهم. للقيام بذلك، سنستعرض كل خطوة في عملية تطوير اللقاح والموافقة عليه، ونرى كيف سارت الأمور خلال العام الماضي
منذ اللحظة التي حصلت فيها اللقاحات على موافقة إدارة الغذاء والدواء الأمريكية، بدأت الأسئلة تتزايد عبر شبكة التواصل الاجتماعي: هل تمت الموافقة على استخدامها حقًا؟
الجواب نعم: تمت الموافقة عليهم. لا، لم تتم الموافقة عليهم.
سوف نقوم بتسوية الأمر.
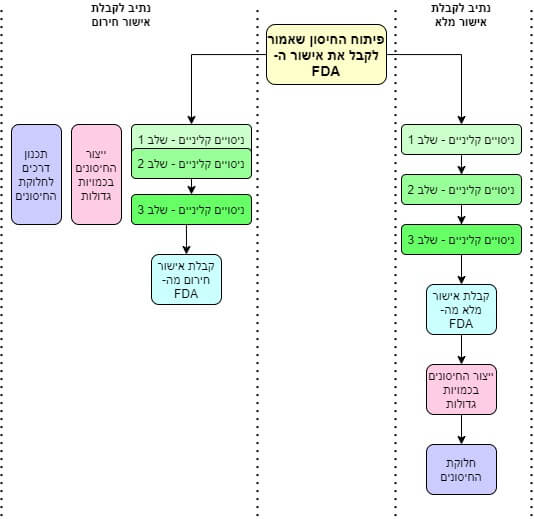
سبب هذا الارتباك يأتي من حقيقة أن إدارة الغذاء والدواء الأمريكية تستخدم مصطلحين مختلفين باللغة الإنجليزية، واللذان يبدوان متماثلين باللغة العبرية. الأول هو الموافقة. من الآن فصاعدا سوف نسميها "الموافقة العادية". إذا قررت إدارة الغذاء والدواء الأمريكية (FDA) أن المنتج فعال وآمن للاستخدام، فإنها تحصل على الموافقة العادية[أنا]. إن عملية الحصول على مثل هذا التصريح طويلة للغاية، ويمكن أن تصل بسهولة إلى 245 يومًا أو أكثر[الثاني].
النوع الثاني من التفويض يسمى التفويض باللغة الإنجليزية. أو باسمها الكامل - ترخيص الاستخدام في حالات الطوارئ (EUA). وسوف نسميها "الموافقة الطارئة" من الآن فصاعدا. تمنح إدارة الغذاء والدواء موافقات طارئة في حالات استثنائية، حيث تكون هناك حاجة ملحة للأدوية أو الأجهزة الطبية التي يمكن أن تنقذ الأرواح، وتكون المخاطر المرتبطة باستخدامها ضئيلة. موقف مثلا ينتشر فيه فيروس جديد في العالم ويقتل الملايين من الناس ويسبب آثارا جانبية لا نفهمها ويتسبب أيضا في شلل دول بأكملها[ثالثا].
حتى الآن، لم تحصل شركات اللقاحات إلا على موافقة طارئة من إدارة الغذاء والدواء. وعلى الرغم من أنها ليست موافقة منتظمة، فإن التوصية الشاملة لجميع البالغين (باستثناء الاستثناءات النادرة) هي استخدام اللقاح دون التفكير مرتين.
وهنا يأتي المشككون ويسألون -بحق مطلق- كيف ذلك؟ بعد كل شيء، يمكن أن تستغرق عملية تطوير لقاح عادي من 10 إلى 15 عامًا بسهولة[الرابع]. ورغم وجود بعض الاستثناءات النادرة على مر السنين ــ لقاحات الأنفلونزا الآسيوية، وأنفلونزا الخنازير، وأنفلونزا هونج كونج التي تم تطويرها في ستة أشهر أو أقل ــ فقد تمت الموافقة عليها بسرعة على وجه التحديد بسبب الخوف الكبير من حدوث جائحة عالمي.[الخامس]. هذه ليست بالضبط الأمثلة التي نود الاعتماد عليها، إذا أردنا الادعاء بأن لقاح كورونا آمن وفعال.
أريد في المقال الحالي أن أتطرق إلى الطريقة التي تم بها تطوير لقاحي فايزر وموديرنا، وكيف حصلوا على الموافقة الطارئة، وماذا يعني ذلك في النهاية بالنسبة لمستوى أمانهم وفعاليتهم. وللقيام بذلك، سنستعرض كل خطوة في عملية تطوير اللقاح والموافقة عليه، ونرى كيف تم تنفيذ ذلك خلال العام الماضي.
الخطوة الأولى: الدراسة
في هذه المرحلة، يتعين على الباحثين في المختبرات تحديد مادة معينة قد يكون لها إمكانات لقاحية، وتوصيفها، وفهم كيفية عملها، وإقناع المديرين أو شركات الأدوية بأن الأمر يستحق المخاطرة ومحاولة الحصول على الموافقة عليها من إدارة الغذاء والدواء الأمريكية – وهي عملية تتطلب عشرات الملايين من الدولارات. في المجمل، تستمر هذه المرحلة ما بين سنتين وأربع سنوات.
عندما حاولت الشركات إنتاج لقاحات في الماضي، كان عليها عزل الفيروسات، ثم قتلها - أو على الأقل إضعافها بشكل كبير. وبهذه الطريقة يطور الجسم مناعة ضدها، دون أن تتمكن الفيروسات من الإضرار به. والمشكلة هي أننا إذا قتلنا الفيروس قبل حقنه في الجسم، فقد يتحلل، ومن ثم لن يطور الجسم مناعة ضده. وإذا لم نضعف الفيروس بما فيه الكفاية، فسوف يسبب المرض نفسه. إن إضعاف الفيروسات هو فن بحد ذاته، ويمكن أن يستغرق سنوات عديدة. وإذا كنت قد نجحت بالفعل في إضعاف الفيروس وحقنه في الجسم، فسيعمل جهاز المناعة على تطوير مئات وآلاف من الأجسام المضادة ضد جميع المناطق الموجودة على سطح الفيروس التي يتعرف عليها. وقد يتعرف أحد تلك الأجسام المضادة عن طريق الخطأ على الخلايا البشرية كأعداء.. ومن هنا يكون الطريق إلى مرض المناعة الذاتية قصيرا، حيث يهاجم الجسم نفسه، ولا يخرج أحد من هذه الحرب بخير.
باختصار، صداع يستغرق سنوات لحله.
ولكن هنا حدث شيء رائع.
استخدمت شركتا فايزر وموديرنا أحدث التقنيات في علم الأحياء لمراجعة بنية الفيروس وشفرته الجينية - وهي المهام التي كانت ستتطلب سنوات في نهاية القرن العشرين - وحددت موقعًا محددًا (بروتين سبايك) على سطح الفيروس. الفيروس الذي اعتقدوا أن الأجسام المضادة سترتبط به جيدًا. ثم حددوا التعليمات الموجودة في الشفرة الوراثية للفيروس والتي بفضلها يمكنه إنتاج نفس البروتين الشوكي. وأخيرًا، قاموا بتكرار نفس التعليمات بحيث ظهرت في شريط قصير من الحمض النووي الريبوزي (RNA) - وهي مادة متوفرة بكثرة في الخلايا. كان من المفترض أن يدخل الحمض النووي الريبوزي (RNA) إلى الخلايا ويجعلها تنتج بروتين السنبلة ويعرضه على سطحها حتى يتعلم الجهاز المناعي التعرف عليه وتطوير المقاومة ضده.
كم من الوقت استغرقت هذه العملية برمتها؟ تدعي شركة موديرنا أن الأمر استغرق يومين إجمالاً[السادس]. من المحتمل أنهم يبالغون، ولكن ليس كثيرًا. العملية التي كانت ستستغرق سنوات في الماضي، سيتم تنفيذها في عام 2020 في غضون أيام قليلة.

المرحلة الثانية: مرحلة ما قبل السريرية
تصل شركات الأدوية إلى المرحلة الثانية من الطريق بلقاحها، وتريد إجراء تجارب سريرية عليه على البشر. ولكن قبل أن يُسمح لهم حتى بالاقتراب من الناس باستخدام حقنة، يجب على الشركات اختبار المادة على نوعين على الأقل من الحيوانات للتأكد من أنها لا تسبب أي ضرر.
جميع المعلومات من هذه التجارب - التي تسمى التجارب ما قبل السريرية (أي "قبل السريرية") - تذهب إلى لجنة تقوم بفحصها بعناية. هذه اللجنة لا تقدم أي تنازلات لأي أحد. אם החברה עיגלה פינות, למשל, ובחרה לערוך ניסוי אך ורק על עכברים זכרים למרות שיש חשש שהחומר הנבדק עלול לגרום לעיכובים התפתחותיים בעובר, הוועדה תזרוק את החוקרים מכל המדרגות בחזרה למעבדה, ותדרוש שיראו לה ניסויים גם בנקבות, או בבעלי-חיים שפגיעים במיוחד לחומרים מהסוג هذا.
يمكن أن تستغرق المرحلة ما قبل السريرية بسهولة سنة أو سنتين. فكيف تمكنت شركتا فايزر وموديرنا من إنجازه بسرعة قياسية؟
وهنا نعود إلى اختيار الشركات لاستخدام لقاحات الحمض النووي الريبي. يتحلل الحمض النووي الريبي (RNA) بسرعة في الجسم، لذلك لا يوجد خوف من الآثار الجانبية الخطيرة. كما كانت هناك تجارب كثيرة في المختبرات في الماضي على لقاحات الحمض النووي الريبوزي (RNA)، والتي لم تظهر أن لها تأثير سلبي على الحيوانات.
لكن اللقاح لا يتكون من الحمض النووي الريبوزي (RNA) فقط. الحمض النووي الريبوزي (RNA) هو الرسالة الأخيرة التي نرسلها إلى الخلايا، ولكن لكي يصل إلى هناك بأمان، فإنه يحتاج إلى "شاحنة" لنقله إلى وجهته. هذه الشاحنة عبارة عن غلاف مصنوع من مادة تعرف باسم PEG (البولي إيثيلين جلايكول) لطلابي السابقين من كلية الهندسة الطبية الحيوية، والذين يعرفون اليوم بالفعل أكثر بكثير مما أعرفه في هذه المجالات، ولا، لست أشعر بالمرارة على الإطلاق. عن ذلك). وفيما يتعلق بهذه المادة أيضًا، هناك الكثير من الدراسات السابقة التي أظهرت أنها غير سامة للجسم بجرعات منخفضة. لذا فإن معايير التجارب قبل السريرية لم تكن عالية في البداية، وذلك لأن سمية جميع المواد ذات الصلة معروفة.
أجرت شركة فايزر تجارب على وجه التحديد على الفئران وقرود المكاك، واختبرت تأثير اللقاح عليها لمدة 28 يومًا، وعندما لم يتم اكتشاف أي علامات للضرر - حصلت على إذن بالبدء في التجارب السريرية[السابع]. أعترف أنني أرغب في رؤية نتائج من تجارب أطول على الحيوانات - شهرين أو حتى أكثر - ولكنني أيضًا على استعداد للتنازل عما هو متاح، إذا قرر الخبراء من لجنة إدارة الغذاء والدواء أن هذه فترة زمنية طويلة بما فيه الكفاية. للتأكد *بما فيه الكفاية* من سلامة اللقاح. لا بد أن هذا القرار كان له علاقة، مرة أخرى، بحقيقة أن لقاحات RNA وPEG معترف بها بالفعل على أنها آمنة منذ السنوات العشر الماضية.
الخطوة الثالثة: تقديم طلب لفتح التجارب السريرية
في هذه المرحلة، تقدم الشركات طلب IND - تطبيق الدواء الجديد الاستقصائي إلى إدارة الغذاء والدواء. يصفون التجارب التي أجروها، والتركيب الكيميائي والبيولوجي للمادة التي تم اختبارها، والطريقة التي سيجرون بها التجارب السريرية، وطرق إنتاج اللقاح وغير ذلك الكثير. في المجمل، إنها كمية موسوعة من الوثائق، وهيئة الغذاء والدواء توافق أو ترفض استمرار التجارب خلال ثلاثين يومًا[الثامن]. أعتقد أنه في حالة لقاحات فيروس كورونا، أمرت إدارة الغذاء والدواء عدة عشرات من الموظفين بإسقاط كل شيء والتركيز على المعلومات المقدمة من شركتي فايزر وموديرنا للموافقة عليها في غضون أيام.
المرحلة الرابعة: الانقسام الكبير
وهنا توجد خطوة مختلفة تمامًا بين نوعي الموافقات – الموافقة العادية والموافقة السريعة. عادة، يجب على الشركات إجراء التجارب السريرية وعندها فقط يمكنها الحصول على موافقة (BLA) لإنتاج اللقاحات بكميات كبيرة.[التاسع]. في حالة الطوارئ، تحصل الشركات على إذن خاص لبدء الاستعدادات لإنتاج اللقاحات بالفعل أثناء التجارب السريرية. وبفضل هذه الموافقة، تمكنوا من فتح مصانع وتكييف خطوط إنتاج خاصة لصالح اللقاح الجديد... حتى قبل أن تتم الموافقة عليه من قبل إدارة الغذاء والدواء. وقد أنقذهم هذا الاختصار لمدة عام على الأقل، وبفضله تمكنوا من البدء في إنتاج اللقاح حتى قبل نهاية عام 2020.
المرحلة الخامسة: التجارب السريرية
وهنا، أخيرًا، وصلنا إلى مرحلة التجارب السريرية. هناك ثلاث مراحل من التجارب السريرية:
- الخطوة الأولى: تجربة على العشرات من المتطوعين الأصحاء تمامًا، مصممة فقط للتأكد من أن اللقاح لا يضرهم وتحديد الجرعة المثالية لهم.
- الخطوة الثانية: إجراء تجربة على مئات المتطوعين لاختبار مدى فعالية اللقاح.
- الخطوة الثالثة: تجربة مع عشرات الآلاف من المتطوعين تهدف إلى التحقق أخيرًا من فعالية اللقاح وآمنه.
واختارت شركة فايزر الجمع بين المرحلتين الأولى والثانية من التجارب السريرية. هذا ليس إجراء غير عادي. على العكس من ذلك: تستخدمه العديد من الشركات. موديرنا كانت تكتفي بالمرحلة الأولى فقط. تم اختبار كلاهما على 45 متطوعًا فقط في التجارب السريرية الأولية. وأعلنوا النتائج منتصف يوليو (موديرنا)[X] وفي منتصف أغسطس (فايزر)[شي]. باختصار: كل شيء على ما يرام.
ومرة أخرى، في هذه المرحلة، كان يتعين على الشركات تقديم النتائج إلى إدارة الغذاء والدواء للموافقة عليها في الأيام المعتادة، وكانت العملية برمتها ستستغرق ما بين ستة أشهر وسنة. لكن في الطاعون كما في الطاعون، دفعت إدارة الغذاء والدواء الأمر إلى قمة أولوياتها، وفي وقت قصير جداً حصلت على الموافقة للانتقال إلى المرحلة الثالثة.
وفي المرحلة الثالثة، تم اختبار عشرات الآلاف من القائمين على التطعيم. يستغرق جمع مثل هذا العدد من المشاركين في التجارب أشهرًا طويلة جدًا ويكلف ثروة. هذه المرة، توافد الناس للمشاركة في هذه التجارب بمحض إرادتهم. اختصار آخر أصبح ممكنا بسبب الوضع. قامت شركتا فايزر وموديرنا بتطعيم حوالي نصف المشاركين، ثم أطلقتاهما في البرية وتابعتهما لمدة عشرة أسابيع (شهرين ونصف) لمعرفة من أصيب بالعدوى ومن لم يصاب.
فكر في الأمر للحظة: مع اللقاحات المنتظمة - ولنقل ضد شلل الأطفال أو الهربس - يتعين عليك الانتظار حتى يصاب متلقيك بهذه الأمراض. قد يستغرق الأمر سنوات. ولكن عندما يكون هناك وباء، مع فيروس معد بشكل خاص؟ وفي تلك الأسابيع العشرة وحدها، أصيب 170 مشاركا في تجربة فايزر، و196 مشاركا في تجربة موديرنا. جميع المصابين تقريبًا جاءوا من المجموعة الضابطة، في حين أن الأشخاص الذين تم تطعيمهم لم يصابوا أبدًا بالعدوى، وأولئك الذين أصيبوا بالعدوى كانوا يعانون من أعراض خفيفة فقط [الثاني عشر] [الثالث عشر].
وماذا عن الآثار الجانبية المحتملة؟ حسنًا، هناك سبب لمتابعة المطعوم لمدة عشرة أسابيع. تظهر معظم الآثار الجانبية للقاحات حتى الأسبوع السادس من لحظة إعطاء اللقاح. ورغم ذلك، لم يتم اكتشاف أي آثار جانبية خطيرة للقاح خلال الأسابيع العشرة. على الأكثر، ظهر رد فعل تحسسي عند 0.63% من متلقي اللقاح... وفي 0.51% من متلقي العلاج الوهمي (أي حقنة بدون لقاح). واليوم، بعد إعطاء عشرات الملايين من جرعات اللقاح في جميع أنحاء العالم، لا يزال من المستحيل العثور على آثار جانبية خطيرة ذات تواتر مرتفع.[الرابع عشر]. هناك شكوك معينة بأن اللقاح قد يسبب أمراض القلب، لكن لم يتم إثباتها وما زالت قيد التحقيق. وحتى لو كان هذا صحيحًا - فمن المحتمل أن يكون معدل انتشاره واحدًا من كل مائة ألف شخص تم تطعيمهم تقريبًا. وبما أنه بدون اللقاح سنصاب جميعًا بالسلالة البريطانية، وبما أن فرصة الإصابة بمرض خطير أعلى بكثير من واحد في مائة ألف، فإن الموافقة على اللقاح لا تزال مبررة.
وهذه هي نهاية القصة: كانت نتائج التجارب واضحة للغاية، وكانت الآثار الجانبية للقاحات خفيفة للغاية، لدرجة أن إدارة الغذاء والدواء الأمريكية منحت الموافقة الطارئة بسرعة. وبما أن مصانع اللقاحات قد بدأت العمل بالفعل في بداية التجارب السريرية، فبمجرد الحصول على الموافقة النهائية، تم إرسال الملايين من جرعات اللقاح على الفور إلى من طلبوها مبكرًا. ربما لاحظتم أننا هنا في إسرائيل تلقينا الكثير منهم.
تصحيح خطأ فيما يتعلق بالمرحلة الرابعة من التجارب السريرية
وهناك من يذكر «المرحلة الرابعة» في التجارب السريرية، ويقول إنه كان ينبغي أن نوصل اللقاحات من خلالها. هذا سوء فهم. تُعرف المرحلة الرابعة أيضًا بمرحلة "مراقبة ما بعد التسويق".[الخامس عشر]. أي أن الشركة وهيئة الغذاء والدواء تواصلان جمع البيانات حول المطعوم، للتأكد من عدم ظهور أي آثار جانبية إشكالية. الافتراض بعد المرحلة الثالثة هو أن اللقاح آمن، ولكن للتأكد فقط - نستمر في مراقبة جميع المطعومين. وحتى لو حصل اللقاح على الموافقة العادية، فإن المرحلة الرابعة لن تبدأ إلا بعد الحصول على الموافقة.
وحتى الآن - لماذا تصريح الطوارئ؟
لا بد أنك لاحظت أنني متفائل بشأن اللقاحات. لقد مروا بجميع الخطوات المطلوبة للحصول على تصريح الطوارئ، بعد كل شيء. وكانت هذه الخطوات مشابهة لتلك التي تمر بها التطعيمات في الوضع الطبيعي للحصول على الموافقة العادية. لذا نعم، لدي ثقة كاملة في فعالية اللقاح وسلامته على المدى القصير.
لكن على المدى الطويل، لا يمكنك التأكد أبدًا. وهذه هي المشكلة الحقيقية: كانت تجارب المرحلة الثالثة قصيرة نسبيًا، لأنها أظهرت نتائج جيدة. وهذه نعمة، ولكنها تجعل من الصعب علينا أيضًا التأكد من أن اللقاحات ليس لها آثار جانبية طويلة المدى. لذا فهذا صحيح - لا ينبغي أن يكون لها آثار جانبية طويلة المدى. لكن في علم الأحياء، لا يمكنك أبدًا أن تعرف على وجه اليقين ما الذي سيحدث بالضبط. على أقصى تقدير يمكن القول أنه - "بحسب كل ما نعرفه عن اللقاح، لا يوجد سبب لحدوث آثار جانبية له على المدى الطويل".
لم يهدئك؟ أنا أفهم تماما. وكما قلت لأي شخص سألني على انفراد: أود بشدة أن أرى تجارب سريرية طويلة الأمد لهذا اللقاح، فقط لكي أكون آمنًا.
ماذا بعد؟ أصبح من الواضح الآن أن أولئك الذين لم يحصلوا على التطعيم سيصابون بالعدوى. وإذا أصبت بالعدوى، فإن فرص ذهابي إلى المستشفى أعلى بعشرات المرات من فرص الإصابة بالأعراض الجانبية على المدى القصير. وعلى عكس اللقاح – نعلم بالفعل أن المصابين غالبًا ما تظهر عليهم آثار جانبية تصاحبهم لعدة أشهر، وربما أبعد من ذلك.
بمعنى آخر، يتعلق الأمر بإدارة بسيطة للمخاطر: فمن ناحية، هناك الفيروس، الذي نعرف أنه يمكن أن يسبب أضرارًا جسيمة للجسم، وفرص الإصابة به عالية جدًا. ومن ناحية أخرى، هناك اللقاح الذي نعلم يقينا أنه غير ضار على المدى القصير، والذي ليس لدينا أي سبب للاعتقاد بأنه ضار على المدى الطويل.
في مثل هذه الحالة، أفضّل اللقاح، على الرغم من أنه تمت الموافقة عليه "فقط" في حالات الطوارئ.
وهذه هي القصة الكاملة وراء الادعاءات المتعلقة بتفويض الطوارئ المحدود. نعم، إنه محدود حقًا، لكن اللقاحات مرت بجميع خطوات الاختبار المطلوبة أيضًا للحصول على الموافقة العادية. لقد مروا بها بسرعة كبيرة جدًا، وهذا أمر جيد جدًا. المخاطر على المدى الطويل موجودة، لكنها في حدها الأدنى.
لقد تلقيت اللقاح بالفعل، ولست أندم عليه. تصريح الطوارئ كافٍ تمامًا هنا.
[أنا] https://www.fda.gov/news-events/approvals-fda-regulated-products/about-fda-product-approval
[الثاني] https://www.qualio.com/blog/fda-medical-device-approval-process
[ثالثا] https://www.fda.gov/emergency-preparedness-and-response/mcm-legal-regulatory-and-policy-framework/emergency-use-authorization
[الرابع] https://www.historyofvaccines.org/content/articles/vaccine-development-testing-and-regulation
[الخامس] https://www.visualcapitalist.com/the-race-to-save-lives-comparing-vaccine-development-timelines/
[السادس] https://www.businessinsider.com/how-moderna-developed-coronavirus-vaccine-record-time-2020-11
[السابع] https://www.biorxiv.org/content/10.1101/2020.09.08.280818v1.full.pdf
[الثامن] https://www.fda.gov/drugs/investigational-new-drug-ind-application/ind-application-procedures-overview
[التاسع] https://www.fda.gov/vaccines-blood-biologics/development-approval-process-cber/vaccine-development-101
[X] https://www.nejm.org/doi/full/10.1056/NEJMoa2022483
[شي] https://www.nature.com/articles/s41586-020-2639-4
[الثاني عشر] https://www.sciencemag.org/news/2020/11/absolutely-remarkable-no-one-who-got-modernas-vaccine-trial-developed-severe-covid-19
[الثالث عشر] https://www.pfizer.com/news/press-release/press-release-detail/pfizer-and-biontech-conclude-phase-3-study-covid-19-vaccine
[الرابع عشر] https://medshadow.org/covid19-vaccine-side-effects/
[الخامس عشر] https://www.news-medical.net/health/What-is-a-Phase-4-Clinical-Trial.aspx
المزيد عن الموضوع على موقع العلوم:
