الانتقاء الطبيعي: كشف باحثون في التخنيون عن آلية تطورية تحمي الكائن الحي من التفاعلات داخل الخلايا التي تعرضه للخطر. التطبيق المحتمل: إلحاق الضرر بالبكتيريا المعادية التي تهاجم البشر
أفادت المجلة العلمية PNAS عن اكتشاف آلية تطورية تحمي البكتيريا والكائنات الحية الأخرى من التفاعلات الجزيئية التي تعرضها للخطر. هذه الآلية الفريدة، التي اكتشفها فريق البحث التابع للبروفيسور نوعام أدير من التخنيون، تحمي جميع الكائنات الحية عن طريق تصفية "التسلسلات القاتلة" للأحماض الأمينية في البروتينات التي ستضر بالكائن الحي. إن استخدام المعلومات حول الآلية سيسمح بإتلاف البكتيريا الضارة بشكل دقيق دون الإضرار بالشخص الذي يحملها.
التطور، كما نعلم، هو عملية يتم فيها الحفاظ على الطفرات - التغيرات في الحمض النووي، المادة الوراثية للكائن الحي - أو اختفائها وفقًا لميزة البقاء التي تمنحها للكائن الحي. إن الكائن الحي الذي سيكون أكثر نجاحًا - من حيث التكيف مع البيئة وإنتاج ذرية خصبة - سوف يتمتع بفرص أفضل للبقاء على قيد الحياة ونقل سماته إلى الأجيال القادمة. ومن الجدير بالذكر في هذا السياق أن عبارة "البقاء للأصلح" ليست صياغة علمية صحيحة، فالفرد الأقوى ليس بالضرورة الفرد الأكثر ملاءمة للبيئة. الصيغة الصحيحة، كما صاغها تشارلز داروين، هي "البقاء للأصلح".
في عملية الانتقاء الطبيعي التي تعد من المبادئ الأساسية للتطور، يتعرض الأفراد المتنافسون للضغوط التطورية، وهي مجموعة العوامل التي تؤثر على تكيف الفرد مع البيئة: مقاومة الأمراض، الحيوانات المفترسة، التحديات المناخية، وما إلى ذلك والقدرة على إنتاج ذرية خصبة يمكنها البقاء على قيد الحياة وتمرير تلك السمات المتوافقة مع البيئة.
طريقة مبتكرة
البحث المنشور في PNAS أجراه البروفيسور أدير، عضو هيئة التدريس في كلية شوليك للكيمياء في التخنيون، بالتعاون مع الدكتور شارون بانياس نافون وطالبة الماجستير تالي شوارتزمان من مجموعته البحثية. استخدم الباحثون طريقة مبتكرة لتحديد URSs - تسلسلات ناقصة التمثيل، أي تسلسلات مفقودة أو نادرة، من قاعدة البيانات الواسعة للمعلومات البيولوجية. وبعد تحديد هذه التسلسلات بهذه الطريقة، اختبروا تجريبيًا تأثير URSs على البكتيريا. الاستنتاج: ندرة تسلسلات محددة في بكتيريا معينة مشتقة من الضرر المحتمل لهذه التسلسلات، مما قد يمنع تكوين البروتينات (التوليف) ويمنع تطور البكتيريا. وبعبارة أخرى، فإن الضغط التطوري يقلل بمرور الوقت من تكرار "التسلسلات القاتلة" التي تهدد مرونة البكتيريا.
يوضح البروفيسور أدير: "إن الآلات الجزيئية التي تجعل الحياة ممكنة، هي عبارة عن بوليمرات طويلة مبنية من تسلسلات خطية لمجموعات كيميائية مختلفة: البروتينات، والحمض النووي الريبي (DNA)، والحمض النووي الريبي (RNA)." إن التنوع المذهل الذي يميز العالم البيولوجي هو نتيجة للتغيرات التطورية المطبقة على هذه البوليمرات."
على المستوى الجزيئي، ينبع هذا الاختلاف بشكل أساسي من العدد الفلكي للاحتمالات المختلفة لترتيب الأحماض الأمينية الطبيعية التي تُبنى منها البروتينات. وهذا الرقم مستمد من وجود 20 حمض أميني طبيعي؛ يؤدي استخدام ثلاثة منها فقط إلى 8,000 تسلسل محتمل مختلف، واستخدام خمسة منها يسمح بأكثر من 3 ملايين تسلسل مختلف، وهكذا. البروتين النموذجي لا يحتوي على ثلاثة أو خمسة أحماض أمينية بل مئات. "يحدد تسلسل الأحماض الأمينية البنية ثلاثية الأبعاد للبروتين وبالتالي خصائصه وقدراته. إن ربط البروتين ببروتينات أخرى قد يخلق قدرات جديدة ومحسنة، ولكن الارتباط الخاطئ قد يؤدي إلى تلف البروتين وحتى يؤدي إلى موت الخلية، أي البكتيريا.
مثل هذه الارتباطات غير الصحيحة يمكن أن تنتج عن التكوين العشوائي للطفرات "السلبية"، أي تلك التي لا يتوقع أن تبقى على قيد الحياة لأنها تقلل من قدرة الكائن الحي على البقاء في البيئة. وهنا تظهر واحدة من أهم الثورات العلمية في السنوات الأخيرة في الصورة - المعلوماتية الحيوية، حيث يتم تجميع معلومات هائلة حول تسلسل الحمض النووي لكائنات كاملة - من البكتيريا البسيطة إلى البشر. "إن البحث الحالي نتج عن فهم أن قاعدة البيانات هذه توفر لنا فرصة للتحقق ليس فقط من التسلسلات المشتركة في الكائنات الحية المختلفة، كما تفعل العديد من مجموعات البحث في العالم، ولكن أيضًا URSs - التسلسلات المفقودة والنادرة."
ولتحقيق هذه الغاية، كتب الباحثون برنامجًا حاسوبيًا يقوم بمسح جميع التسلسلات المشفرة لجميع البروتينات المحتملة (البروتينات) في جينومات الكائنات الحية الدقيقة المختلفة، وخاصة المسببة للأمراض (المسببة للأمراض). الهدف: الكشف عن URSs في كائنات محددة. حساب تعريفي
تختلف URSs من بكتيريا إلى أخرى، وفي هذه المرحلة من الدراسة ركز الباحثون على البكتيريا E. كولاي.
التجربة: زرع تسلسلات نادرة
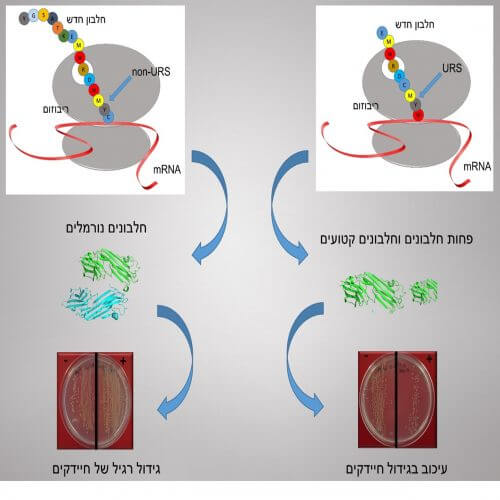
الآن سعى الباحثون إلى إثبات أن URSs ضارة بالفعل (وبالتالي ندرتها) وتحديد المكان الدقيق لإصابتها. وللقيام بذلك، قاموا بتطعيم تسلسلات URS هذه في بروتينات طبيعية. والنتيجة، والتي يمكن رؤيتها على الجانب الأيمن من الرسم البياني المرفق: زرع URS أضر بعملية تخليق البروتينات الجديدة. علاوة على ذلك، عند استخدام تسلسلات URS أطول - سلسلة من 4 أحماض أمينية - أدى وجود تسلسل URS إلى تثبيط تطور البكتيريا وحتى موتها.
يتم دمج الأحماض الأمينية لتكوين بروتين جديد بواسطة الريبوسوم، الذي يتلقى التعليمات من الشفرة الوراثية. ولذلك، لجأ الباحثون إلى خبراء متخصصين في قياس نشاط الريبوسومات الفردية: البروفيسور جوزيف بوغليسي من جامعة ستانفورد وطالب الدكتوراه غاي كورنبرغ. قام بوغليسي وكورنبرغ أيضًا بزرع تسلسلات URS في البروتين وأكدا النتائج: هذه التسلسلات تمنع بالفعل عملية الترجمة وتطور البروتين. علاوة على ذلك، فقد حددوا بالضبط مكان حدوث تأخير في عملية الترجمة في الريبوسوم: عند مدخل قناة خروج الريبوسوم، التي "تنبثق" منها البروتينات الجديدة.
حتى أن مجموعة البحث في التخنيون زرعت نفس التسلسلات في البروتين في مزرعة خلايا بشرية، وكانت النتيجة: لم يكن هناك أي تأثير واضح على البروتين، مما يعني عدم حدوث أي ضرر للشخص. يقول البروفيسور أدير: "توضح هذه النتائج أن استخدام URS قد يستهدف البكتيريا التي نريد قتلها، دون الإضرار بالشخص الذي توجد هذه البكتيريا في جسده. في ضوء ذلك، وعلى أمل أن يتم اختبار الإمكانيات العملية لاكتشافنا في المستقبل القريب، قمنا بتسجيل براءة اختراع له بالتعاون مع التخنيون".
