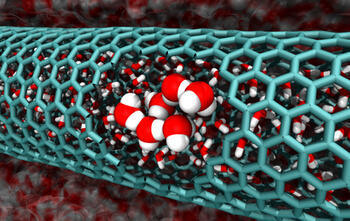
في السنوات الأخيرة، اكتشف الباحثون أن الماء يتدفق تلقائيًا داخل أنابيب صغيرة للغاية من الجرافيت، الجرافين، تسمى أنابيب الكربون النانوية
يكشف العلماء أحيانًا عن نتائج غريبة وغير متوقعة عندما ينظرون إلى المواد على مستوى النانومتر الخاص بها - مستوى الذرات والجزيئات الفردية. وهذا صحيح حتى بالنسبة للمواد الأكثر شيوعا، مثل الماء.
في السنوات الأخيرة، اكتشف الباحثون أن الماء يتدفق تلقائيًا داخل أنابيب صغيرة جدًا من الجرافيت، الجرافين، تسمى أنابيب الكربون النانوية. هذه الملاحظة غير المتوقعة رائعة لأن أنابيب الكربون النانوية تبشر بالخير في المجالات الناشئة للتدفق النانوي والترشيح النانوي، حيث قد تساعد الأنابيب النانوية في الحفاظ على التدفقات الصغيرة أو فصل الشوائب عن الماء. ومع ذلك، لم يتمكن أحد من تفسير كيف يميل السائل المستقر، على المستوى الجزيئي، إلى حصر نفسه في مثل هذا المجال الصغير.
الآن، باستخدام طريقة مبتكرة يمكن من خلالها حساب ديناميكيات جزيئات الماء، يعتقد باحثون من معهد كاليفورنيا للتكنولوجيا أنهم حلوا اللغز. لقد اتضح أن الإنتروبيا، وهي مقياس الفوضى، كانت العامل المفقود.
يقول ويليام جودارد، أستاذ الكيمياء وعلوم المواد والفيزياء التطبيقية في معهد كاليفورنيا للتكنولوجيا: "إنها نتيجة مفاجئة للغاية". "يركز الباحثون عادة في هذا المجال على الطاقة وليس على الإنتروبيا." وذلك لأن الماء يشكل شبكة واسعة من الروابط الهيدروجينية، مما يجعلها مستقرة للغاية. يتطلب كسر هذه العلاقات الوثيقة استثمارًا للطاقة. وبما أنه يجب كسر ما يكفي من الروابط حتى يتدفق الماء في الأنابيب النانوية الصغيرة، فمن غير المرجح أن يتم تصنيع الماء بهذه السهولة.
يقول الباحث الرئيسي: "ما وجدناه هو أنها في الواقع مقايضة". "إنك تفقد بعضًا من استقرار الطاقة الجيد الذي يأتي من الروابط الكيميائية، لكنك تكتسب الإنتروبيا." الإنتروبيا هي إحدى القوى الدافعة التي ستحدد في النهاية ما إذا كانت أي عملية ستحدث من تلقاء نفسها أم لا. يمثل هذا المقياس عدد الطرق التي يمكن أن يوجد بها النظام في حالة معينة. كلما زادت الترتيبات الممكنة للنظام، زاد اضطرابه، وارتفعت الإنتروبيا. ومن حيث المبدأ، فإن الطبيعة تميل إلى الفوضى.
عندما يرتبط الماء على النحو الأمثل، فإن جميع الروابط الهيدروجينية "تحبس" الجزيئات في مكانها، مما يحد من حريتها ويحافظ على إنتروبيا الماء منخفضة. ووجد الباحثون أنه في حالة العديد من الأنابيب النانوية، يتلقى الماء ما يكفي من الإنتروبيا عن طريق دخول هذه الأنابيب بحيث يتجاوز فقدان الطاقة الناجم عن كسر عدة روابط هيدروجينية. ونتيجة لذلك، يتدفق الماء بشكل مستقل في الأنابيب. ونشرت نتائج البحث في المجلة العلمية وقائع الأكاديمية الوطنية للعلوم (PNAS).
قام الباحثون بفحص أنابيب الكربون النانوية بأقطار تتراوح من 0.8 إلى 2.7 نانومتر ووجدوا ثلاثة أسباب لتدفق الماء بحرية داخل الأنابيب، اعتمادًا على قطرها. بالنسبة لأصغر الأنابيب النانوية - ما بين 0.8 و 1.0 نانومتر - تكون الأنابيب صغيرة جدًا بحيث تصطف جزيئات الماء في عمود واحد تقريبًا بداخلها وتكون في حالة تشبه الغاز. وهذا يعني أن البنية الطبيعية المرتبطة بالماء السائل تنهار، مما يمنح الجزيئات حرية أكبر في الحركة. هذه الزيادة في الإنتروبيا تسمح للماء بالدخول إلى الأنبوب. بالنسبة للمجموعة التالية من الأنابيب، التي يتراوح قطرها بين 1.1 و1.2 نانومتر، تنتظم جزيئات الماء المحصورة في بلورات متجمعة تشبه الجليد. واكتشف الباحثون أن الأنابيب النانوية من هذا النوع هي بالحجم المثالي "لاستضافة" المياه البلورية. في هذه الحالة، علاقات الترابط بين البلورات، وليس الإنتروبيا، هي التي تسمح للمياه بالتدفق عبر الأنابيب.
بالنسبة للمجموعة ذات الأقطار الأكبر، والتي تمتد بين 1.4 و2.7 نانومتر، وجد الباحثون أن جزيئات الماء المحصورة تتصرف مثل الماء السائل. ومع ذلك، مرة أخرى، يتم كسر بعض الروابط الهيدروجينية الطبيعية، بحيث تتمتع الجزيئات بحرية أكبر في الحركة داخل الأنابيب. والزيادة في الإنتروبيا تعوض الخسارة في طاقة الرابطة الهيدروجينية.
نظرًا لأن الجزء الداخلي من أنابيب الكربون النانوية صغير جدًا بحيث لا يمكن للباحثين فحصه تجريبيًا، فقد قام الفريق بفحص ديناميكيات جزيئات الماء المحصورة باستخدام عمليات المحاكاة الحاسوبية. وباستخدام طريقة حسابية جديدة، تمكنوا من حساب الإنتروبيا لجزيئات الماء الفردية، بينما كانت مثل هذه الحسابات في الماضي صعبة وتستغرق وقتًا طويلاً - فقد استهلكت الطرق القديمة 8 سنوات من وقت الكمبيوتر من أجل حساب الإنتروبيا التي توصل إليها الباحثون. الآن احسب في 36 ساعة فقط.
أجرى الفريق أيضًا عمليات محاكاة باستخدام وصف بديل للمياه، حيث يتمتع الماء بالخصائص المعتادة للطاقة والكثافة واللزوجة، لكنه يفتقر إلى القدرة على الارتباط الهيدروجيني. في هذه الحالة، لم يميل الماء إلى التدفق داخل الأنابيب النانوية، وهو اكتشاف يوفر دليلًا إضافيًا على أن الروابط الهيدروجينية الواسعة للمياه العادية، التي لديها إنتروبيا منخفضة، تؤدي إلى الامتلاء التلقائي لأنابيب الكربون النانوية مع زيادة الإنتروبيا.
ويعتقد الباحثون أنه يمكن استخدام أنابيب الكربون النانوية في تصميم الجزيئات العليا لتنقية المياه. ومن خلال إنتاج فوهات بنفس قطر أنابيب الكربون النانوية، سيكون من الممكن تطوير بوليمر غرضه امتصاص الماء من المحلول (مياه البحر، على سبيل المثال).

تعليقات 5
رجل،
يتم التعبير عن الصيغة التي تربط "الاستقرار" وميل العملية إلى الحدوث في صيغة "طاقة جيبس الحرة":
ز = ح − تي*س.
ز – طاقة جيبس. من حيث المبدأ، كلما انخفضت طاقة جيبس، زادت احتمالية حدوث التفاعل وكان المنتج النهائي أكثر استقرارًا (يميلون إلى القول أنه إذا كانت G للمنتج أقل من G للمواد المتفاعلة، أي يكون فرق G هو سلبيا، فإن رد الفعل "عفوي").
ح - طاقة المحتوى الحراري، والتي تعلم بشكل أساسي درجة "استقرار الطاقة" للعملية. كما ترون، كلما انخفضت الطاقة، زادت استقرار المادة والعملية.
تي – درجة الحرارة.
S – الإنتروبيا (الفوضى)، لذلك يمكن ملاحظة أنه كلما ارتفعت الإنتروبيا، كلما زادت احتمالية حدوث العملية ومنتجها النهائي.
ملاحظة صغيرة: هذا تحويل ديناميكي حراري يعبر عن مدى "استقرار" العملية، لكنه لا يعلم بشكل مباشر عن الحركية (كم من الوقت سيستغرق حدوث التفاعل).
وبطبيعة الحال، هذا مجرد تفسير شامل للغاية. يمكنني أن أشرح أكثر ولكن أعتقد أن هذا يكفي للإجابة على سؤالك.
هل قال أحد العطور الأعلى؟؟؟
يذكرني بمحرك عدم اليقين اللانهائي من "دليل المسافر إلى المجرة"
http://en.wikipedia.org/wiki/Technology_in_The_Hitchhiker's_Guide_to_the_Galaxy#Infinite_Improbability_Drive
رجل،
إنها ليست مقايضة بين الإنتروبيا والطاقة، بل منافسة. يمكن أن تكون حالة معينة من النظام أكثر تفضيلاً من الناحية الحيوية، ولكنها في نفس الوقت أقل تفضيلاً من الناحية الانتروبية. إن الإجابة على سؤال أيهما أكثر هيمنة ستحدد ما إذا كان النظام سينتقل إلى هذه الحالة.
من المستحيل الجمع بين البرتقال والأفوكادو، لذلك لا يوجد مثل هذا المبلغ. في الأنظمة المغلقة تكون الطاقة ثابتة (دائمًا)، ويمكن أن تتغير الإنتروبيا.
شكرا لك يا أبي، مثيرة جدا للاهتمام.
إذا كانت هناك مقايضة بين الإنتروبيا والطاقة، فهل مجموعهما (إذا كان بإمكانك تسميتهما) في الأنظمة المغلقة
سوف تبقى عند قيمة ثابتة؟