دراسات جديدة تظهر أن الحاجز الدموي الدماغي هو نظام ديناميكي ونشط يمكن أن يؤدي إلى ثورة في علاج أمراض مثل السرطان والزهايمر
أثناء إحدى تجارب تلوين الأنسجة الشهيرة التي أجراها بول إرليخ في نهاية القرن التاسع عشر، وهي إحدى التجارب التي أدت في النهاية إلى علاج مرض السيلان والحصول على جائزة نوبل، واجه ظاهرة لا تزال تشغل العلماء حتى يومنا هذا. اخترقت الصبغة التي تم حقنها في مجرى الدم لدى الفئران جميع الأنسجة باستثناء الدماغ. وقد صبغت خلايا الكلى والكبد والقلب لدى الفئران، التي تمت ملاحظتها تحت المجهر، بلون أزرق بنفسجي قوي وواضح، لكن لون خلايا الدماغ ظل مائلا إلى الأبيض المصفر. وعندما قام أحد طلابه بحقن الصبغة مباشرة في أدمغة الفئران، تم الحصول على نتيجة عكسية: كانت أنسجة المخ مصبوغة باللون الأزرق، ولكن الأعضاء الأخرى لم تكن كذلك. ومن الواضح أن الطالب فكر في نفسه، لا بد أن يكون هناك نوع من الحاجز (يسمى باللغة الألمانية بلوت-هيرن-شرانك) بين الدماغ والجهاز الدوري.
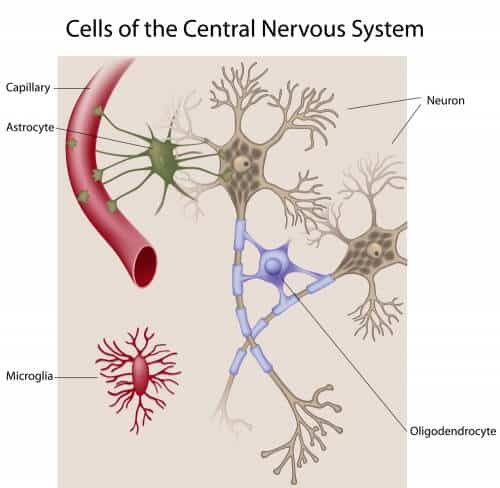
وبعد مرور نصف قرن فقط، وبمساعدة مجهر أقوى بنحو 5,000 مرة من المجهر الذي استخدمه إيرليك، تمكن العلماء من تحديد موقع الحاجز المخفي داخل نظام الأوعية الدموية في الدماغ. يحتوي الدماغ البشري العادي على أوعية دموية يبلغ طولها حوالي 640 كيلومترًا. إنها تلتف وتنحني في مجموعة لا نهاية لها من الحلقات المتشابكة، وتحيط في النهاية بكل خلية من الخلايا العصبية الموجودة في الدماغ والتي يبلغ عددها حوالي 100 مليون. وتصطف جدران هذه الأوعية الدموية بطبقة من الخلايا البطانية، وكذلك جدران جميع الأوعية الدموية في الجسم. لكن الخلايا البطانية الموجودة على سطح الأوعية الدموية التي تغذي الدماغ منظمة في طبقة أكثر إحكاما، وهو التنظيم الذي يفسر سبب عدم قدرة الأصباغ التي حقنها إيرليك، وكذلك معظم الأدوية المستخدمة اليوم، على الاختراق من مجرى الدم إلى الدماغ.
ومع ذلك، قبل وقت طويل من تمكن الباحثين من مراقبة هذا الحاجز مباشرة، تعلم الأطباء الاعتزاز به وتجنب إتلافه. يقول ليستر دروز، عالم الأحياء الوعائية وخبير الحاجز الدموي الدماغي في جامعة مينيسوتا: «على مدى عقود، رأينا الحاجز الدموي الدماغي كنوع من جدار من الطوب لا يمكن اختراقه». "كان الإجماع العام على أنه كان هناك لسبب محدد وطلب منا العبث معه".
واليوم تغير هذا الموقف. اكتشف العديد من العلماء أن جدار الطوب الصلب كان يعج بالنشاط. وتتواصل الخلايا الموجودة على جانبي الحاجز، في الدماغ والدم، وتؤثر على بعضها البعض. وأكثر من ذلك، هناك مجموعة واسعة من الممرات المخصصة لجزيئات معينة، الموجودة في أغشية الخلايا البطانية، تنظم دخول المواد إلى الدماغ، وتمنع مواد معينة وتنقل أخرى. وحتى خلايا الدم البيضاء، التي كان يُعتقد سابقًا أنها أكبر من أن تخترق الحاجز، تمر عبره بشكل روتيني للبحث عن الغزاة الأجانب.
ومن أجل وصف النتائج بشكل أفضل، بدأ العلماء يطلقون على الحاجز اسم "وحدة الأوعية الدموية العصبية" (من الأعصاب والأوعية الدموية): أي أنهم توقفوا عن رؤيته كحاجز صلب مصنوع من الخلايا البطانية، بل كعضو حيوي يتكون من من أنواع مختلفة من الخلايا التي تشمل أيضًا الخلايا التي تحيط بخلايا الدم، والتي تلعب دورًا حاسمًا في نمو الجسم، أثناء الشيخوخة وأثناء المرض. وبفضل ثورة أخرى في مجال الفحص المجهري، أصبح بإمكان العلماء الآن مراقبة نشاط هذا العضو بشكل مباشر.
الحواجز مكسورة
إن الحاجز الدموي الدماغي، كما يُرى من خلال المجهر "ثنائي الفوتون" للعالم مايكن نيدرجارد من جامعة روتشستر، هو أكثر روعة بكثير مما كان يمكن أن يتخيله إريك. كان نيدرجارد، على عكس إرليخ، يراقب عقول الحيوانات (الفئران على وجه الدقة) بينما كانت على قيد الحياة وتتنفس. تقوم بإزالة جزء من جمجمة الفأر، وتحقن صبغة في مجرى الدم ثم تراقب الحاجز الدموي الدماغي في الوقت الحقيقي. تعبر الخلايا الحاجز من مجرى الدم إلى الدماغ عبر جدران الشعيرات الدموية الرقيقة المكونة من طبقة واحدة من الخلايا البطانية. المنظر ملهم، خاصة أنه كان من الصعب الوصول إلى الحاجز عندما بدأت نيدرجارد مسيرتها العلمية قبل حوالي 20 عامًا.
طريقة الفحص المجهري ثنائي الفوتون هي تقنية تصوير متقدمة تسمح باختراق الـ 300 ميكرون العلوي من القشرة الدماغية. قبل تطويره، لم يكن الباحثون قادرين على جمع بيانات أفضل بكثير من بيانات إيرليك، أي عرض الأنسجة الميتة المثبتة على شرائح المجهر. ويقول نيديرجارد إن هذه التجارب لم تعلم علماء الأحياء سوى القليل جدًا عن العمل الفعلي للحاجز الدموي الدماغي. والسبب في ذلك هو أن تدفق الدم ضروري لحسن سير العمل في الدماغ والحاجز. إن إدراك مدى أهمية تدفق الدم لنشاط الحاجز فاجأ وتحدى تفكير الباحثين المشاركين في هذا المجال.
على سبيل المثال، في سلسلة من التجارب التي أجرتها نيدرجارد وزملاؤها مؤخرًا، وجدوا أنه عندما يتم تحفيز مجموعة معينة من الخلايا العصبية، يزداد قطر الأوعية الدموية المحيطة بها بحيث تكون قادرة على حمل المزيد من الدم والمواد المغذية إلى الجسم. اللحظة الدقيقة التي تبدأ فيها الخلايا العصبية في إطلاق النار. إذا ضعفت شدة التحفيز، تتقلص الأوعية الدموية وتقل كمية العناصر الغذائية الموجهة إلى هذه المنطقة. يقول دروز: "إنها عملية ديناميكية للغاية".
إنها أيضًا عملية معقدة بطريقة يصعب وصفها. حول الشعيرات الدموية توجد خلايا تسمى الخلايا النجمية والبيريسيتس التي تحيط بجميع الأوعية الدموية في الدماغ وتساعد في التواصل بين الخلايا العصبية والدورة الدموية والخلايا البطانية. وفي المقابل، تُحاط هذه الخلايا بخلايا من أنواع أخرى.
من بين جميع أنواع الخلايا، يجد نيدرجارد اهتمامًا خاصًا بالخلايا الدبقية الصغيرة، وهي خلايا في الجهاز العصبي المركزي تشبه الخلايا البلعمية، أي الخلايا التي تبتلع الخلايا التي تتعامل مع دفاع الجسم. تقوم الخلايا الدبقية الصغيرة بدوريات منتظمة في الدماغ والحبل الشوكي بحثًا عن الخلايا التالفة وعوامل المرض الأخرى لتدميرها. لطالما ارتبط وجود الخلايا الدبقية الصغيرة التالفة بأمراض التنكس العصبي مثل مرض الزهايمر ومرض باركنسون. يشتبه Nedergaard في أن هذه العلاقة ترجع إلى عدم قدرة الخلايا الدبقية الصغيرة التالفة على حماية حاجز الدم في الدماغ.
يفترض نيدرجارد أنه عندما تموت الخلية البطانية، إما نتيجة لإصابة أو بشكل طبيعي، تنفتح فتحة مؤقتة في الحاجز الدموي الدماغي. لا يمكن للخلايا البطانية المجاورة أن تغلق الفتحة على الفور، لأنها متصلة ببعضها البعض عن طريق الوصلات الضيقة بين الخلايا (الوصلات بين الخلايا). إن حقيقة أن مثل هذه الشقوق تنفتح أحيانًا في الحاجز الدموي الدماغي تتطلب وجود خط دفاع آخر يسمح بإغلاق الحاجز على الفور واستمرار العمل الطبيعي للدماغ. وفي سلسلة من التجارب، قام نيدرجارد بتفجير الشعيرات الدموية في أدمغة الفئران الحية باستخدام شعاع الليزر. وتقول إنه في غضون 10 إلى 20 دقيقة، تقوم الخلايا الدبقية الصغيرة بتغطية المنطقة المتضررة بإحكام. "لقد غطوا المنطقة بسرعة لا تصدق، في الواقع، كان مشهدا جميلا للغاية".
ويحاول مجموعتها البحثية الآن معرفة ما إذا كانت الخلايا الدبقية الصغيرة هي بالفعل خط الدفاع الأول في حماية حاجز الدم في الدماغ، وفريق الطوارئ الذي يصل بسرعة ويغلق الثغرة حتى يتم استبدال الخلايا البطانية التالفة أو إصلاحها. يقول نيدرجارد: "من الممكن وصف الحالة التي لا تعمل فيها الخلايا الدبقية الصغيرة بشكل صحيح، وبالتالي لا تغلق الفجوات في حاجز الدم في الدماغ بسرعة كافية، مما يؤدي إلى انحطاط الخلايا العصبية". هذه الفرضية هي مجرد واحدة من العديد من الفرضيات الأخرى التي يختبرها العلماء حاليًا لاكتشاف العلاقة بين عمل الحاجز الدموي الدماغي والأمراض المختلفة.
على سبيل المثال، التصلب المتعدد، وهو مرض يتميز بنوبات من آلام العضلات المنهكة، ونقص الإحساس ومشاكل في الرؤية. لقد عرف الأطباء منذ عقود أن مرض التصلب المتعدد ينجم عن انهيار نسيج المايلين، وهو نسيج مرن يلتف حول المحاور العصبية (الأسلاك الكهربائية في الدماغ) ويشكل طبقة عازلة كهربائية حولها، تمامًا مثل الطبقة المطاطية. الذي يعزل أسلاك الهاتف. ولكن لا توجد حتى الآن إجابة على السؤال حول سبب اندلاع المرض في شكل هجمات، وما أسباب تفشي المرض. تشير أدلة مختلفة من التصوير بالرنين المغناطيسي (MRI) إلى أن اختراق حاجز الدم في الدماغ يعجل بنوبات مرض التصلب العصبي المتعدد. تسمح الخروقات غير الطبيعية في الحاجز لكمية كبيرة من خلايا الدم البيضاء بالدخول إلى الدماغ ومهاجمة طبقة المايلين. ويعتقد العلماء الآن، استنادا إلى بعض التجارب الجديدة، أن جزيئات الأكسجين النشطة تهاجم حاجز الدم في الدماغ وتضعفه. وبالتالي يمكن لمضادات الأكسدة أن توقف هذه الظاهرة وتثبت الحاجز. يقول دروز: "لقد اعتقدنا دائمًا أن مرض التصلب العصبي المتعدد هو مرض يصيب الجهاز المناعي". "الآن بدأنا نفكر في الأمر باعتباره مرضًا يصيب الحاجز الدموي الدماغي."
هناك تغيير إدراكي مماثل يتعلق بالصرع. لقد عرف العلماء والأطباء منذ زمن طويل أن النوبات تتزامن مع حدوث اختراقات في الحاجز الدموي الدماغي، ولكن حتى وقت قريب كانت هذه الانتهاكات تعتبر نتيجة وليس سببًا للنوبات. وقد بدأت طريقة التفكير هذه تتغير الآن. اكتشف علماء من جامعة أمستردام أن إحداث اختراقات اصطناعية في الحاجز الدموي الدماغي لدى الفئران هو وسيلة موثوقة لزيادة عدد النوبات التي ستعاني منها الفئران، وأنه كلما زاد الاختراق الاصطناعي للحاجز الدموي الدماغي، زاد احتمال إصابة الفئران بذلك. المعاناة من نوبة الفص الصدغي. أظهرت الدراسات التي أجريت في عيادة كليفلاند أنه في الخنازير (تجريبيًا) وفي البشر (وفقًا للملاحظات) يحدث انهيار حاجز الدم في الدماغ قبل النوبة وليس بعدها.
وفي مجال آخر، اكتشف العلماء بروتينين قد تلعب وظيفتهما غير الطبيعية دورًا في الإصابة بمرض الزهايمر. أحد البروتينات (المعروف باسم RAGE) يقود جزيئات بيتاالنخاعي من مجرى الدم إلى الدماغ، بينما يقوم البروتين الثاني (المعروف باسم LRP1) بإزالتها من الدماغ. عندما يختل التوازن بين نشاط هذين البروتينين، فإن بيتا أالنخاعي يتراكم في الدماغ ويشكل ترسبات تميز مرض الزهايمر. وعلى الرغم من أن تطوير الأدوية بناءً على هذه النتائج لا يزال بعيدًا، إلا أنها لا تزال تقدم قدرًا من الأمل. تمكن العلماء من منع تطور رواسب بيتا أميلويد في الفئران عن طريق تثبيط نشاط الجين الخاص ببروتين RAGE في الخلايا البطانية. ومن الممكن أن تؤدي الأدوية التي تثبط نشاط هذا البروتين (الأدوية التي يتم تطويرها حاليًا) إلى نتيجة مماثلة عند البشر.
ومع ذلك، فإن إصلاح التسربات في الحاجز الدموي الدماغي لا يمثل سوى نصف التحدي العلمي. أما النصف الآخر فهو تطوير وسائل لاختراق حاجز حقن المخدرات مباشرة في الدماغ بشكل متعمد. حتى الآن، وجد الأطباء طريقة واحدة مثبتة على الأقل للقيام بذلك، ولا يزال السباق مستمرًا للعثور على أكبر عدد ممكن من الطرق الإضافية.
فتحت يا سمسم
على الرغم من تعقيد الحاجز الدموي الدماغي، فإن مرور المواد بين الدم والدماغ يتم تحديده من خلال مجموعة بسيطة بشكل ملحوظ من القواعد. لعبور الحاجز، يجب أن يكون الجزيء أصغر من 500 كيلو دالتون (مثل معظم مضادات الاكتئاب، ومضادات الذهان، وأدوية النوم)، وأن يكون له هيكل يسمح له بعبور الحاجز باستخدام أحد المسارات الطبيعية للنظام (مثل عقار باركنسون لـ - دوبا)، أو أن تكون محبة للدهون، وهذا يعني أن لديها خاصية كيميائية تسمح لها باختراق الجزء الكاره للماء من غشاء الخلية الظهارية (مثل الكحول والكافيين والهيروين). ووفقاً لأغلب التقديرات فإن 98% من الأدوية المعروفة لا تستوفي هذه المعايير، أي أنها إما تخترق الدماغ بكمية صغيرة جداً لا فائدة منها طبياً، أو أنها لا تخترق الدماغ على الإطلاق.
معظم المحاولات السابقة لاستغلال هذه المجموعة من القواعد باءت بالفشل. على سبيل المثال، سمحت زيادة قابلية ذوبان الأدوية في الدهون لها باختراق حاجز الدم في الدماغ بسهولة نسبية، لكن العلماء سرعان ما اكتشفوا أن هذه الاستراتيجية لها أيضًا بعض العيوب المهمة. لقد اخترقت بعض الأدوية الدماغ، لكن عوامل أخرى مختلفة موجودة في الدماغ أزالتها على الفور وإعادتها إلى الدورة الدموية. وتعلق أدوية أخرى على أغشية الخلايا البطانية وفشلت في اختراق الدماغ وأداء وظيفتها. ولكن الأسوأ من ذلك، أن جميعها اخترقت جميع أعضاء الجسم الأخرى بشكل عشوائي.
منذ حوالي 30 عامًا، عندما كان طبيبًا ممارسًا، قرر إدوارد أ. نيوفيلت البحث عن استراتيجية مختلفة. نيوفيلت، جراح الأعصاب ومدير برنامج دراسة الحاجز الدموي الدماغي في جامعة أوريغون للطب والعلوم، هو أول إجراء جراحي لاختراق الحاجز. في الخطوة الأولى، قام بحقن محلول من مادة تعرف باسم مانيتول في الشرايين المؤدية إلى الدماغ. بما أن المانيتول مادة مفرطة الحركة، أي محلول يحتوي على مواد مذابة أكثر بكثير من السائل داخل الخلايا للخلايا البطانية، فإنه يتسبب في مرور السائل من الخلايا البطانية إلى الدورة الدموية، مما يؤدي إلى انكماش الخلايا البطانية، تماماً مثل نقع الأصابع في الماء لفترة طويلة من الزمن. بعد ذلك، تنفتح الوصلات بين الخلايا وتترك فتحة واسعة بما يكفي لمرور الأدوية التي يتم إدخالها إلى الدماغ عبر نفس الشريان. بعد 40 دقيقة إلى ساعتين، تعود الخلايا البطانية وتتوسع إلى حجمها الطبيعي، وتعيد إنشاء الوصلات بين الخلايا وتعيد إغلاق الحاجز.
منذ حوالي عشرين عامًا، استخدم نيوفيلت هذا الإجراء لاختراق حاجز الدم في الدماغ لدى نوع خاص من المرضى: أولئك الذين يعانون من أورام دماغية سرطانية من المتوقع أن يستجيبوا للعلاج الكيميائي إذا تمكن من اختراق الورم فقط.
إحدى هؤلاء المرضى هي جواني لافيرتي، وهي أم لثلاثة أطفال تبلغ من العمر 57 عامًا، وتم تشخيص إصابتها بسرطان الغدد الليمفاوية في الجهاز العصبي المركزي في عام 2007 (السرطان الذي يغزو الجهاز اللمفاوي ويخترق الجهاز العصبي المركزي). أعطاها الأطباء حوالي شهر لتعيشه. عندما وصلت لأول مرة إلى جامعة أوريغون، بعد أسبوعين من أخذ الخزعة من دماغها، كان الجانب الأيمن من جسدها مشلولا بالفعل. حذرتها شركة التأمين الخاصة بها من الإجراء الجراحي على أساس أنه لا يزال تجريبيًا ويمكن أن يسبب صرعًا طويل الأمد أو سكتة دماغية أو ما هو أسوأ. لكن لافيرتي لم يكن لديه ما يخسره. وتقول: "كان هذا هو العرض الوحيد المطروح على الطاولة". "وأردت أن أعيش."
وكما تبين، لم تمض سوى أسابيع قليلة على تشخيص إصابتها بالزرقة حتى استلقيت على طاولة العمليات لنوفلت وفريقه وسمح لهم بإدخال قسطرة من خلال فخذها إلى الشريان السباتي الأيسر وحقن محلولين من خلالها. أنبوب القسطرة، أولًا محلول مانيتول مفرط الحركة، ثم تبعه سريعًا عقار العلاج الكيميائي الميثوتريكسيت. وفي اليوم التالي كرروا العملية باستخدام الشريان السباتي الأيمن. كرر نيوالت وفريقه البروتوكول على فترات شهرية لمدة عام. أولاً عبر الشريان السباتي الأيسر ثم عبر الشريان السباتي الأيمن. أحدث المانيتول شقوقًا في الحاجز الدموي الدماغي لدى لافيرتي حتى يتمكن الدواء من اختراق الورم في دماغها ومهاجمته. وفي نهاية الدورة الثانية من العلاج، تمكنت ليبيرتي من مغادرة المستشفى بدون كرسيها المتحرك. وبعد شهرين اختفى الورم. وبعد خمس سنوات لا تزال على قيد الحياة.
بالنسبة للمرضى الذين تقل أعمارهم عن 60 عامًا، يعمل علاج نيوفيلت على إطالة متوسط العمر المتوقع بمقدار 13 إلى 14 عامًا مع نتائج معرفية أفضل بكثير من تلك التي يتم الحصول عليها بعد العلاج الإشعاعي لكامل الدماغ (ويجب أن نتذكر أنه لا يمكن علاج جميع الأورام بالعلاج الإشعاعي). ). صحيح أنه لا يمكن نقل جميع أدوية العلاج الكيميائي عبر الحاجز الدموي الدماغي بهذه الطريقة، ولا يمكن علاج جميع أنواع السرطان باستخدام بروتوكول العلاج هذا. اليوم، تم اختبار عدد قليل فقط من الأدوية وتبين أنها آمنة للاستخدام باستخدام طريقة نيولت. لأنه أثناء العلاج يتم حقن المانيتول من الشرايين الموجودة في جميع أنحاء الدماغ، ويتم اختراق معظم الحاجز الدموي الدماغي، لذلك هناك مخاطر مثل تورم الأنسجة والتسمم والعدوى.
وبينما يقوم نيفلت وفريقه بتحسين بروتوكول العلاج الخاص بهم ومحاولة توسيع تطبيقاته، يبحث الأطباء في جميع أنحاء العالم عن علاجات بديلة. أحد البدائل الواعدة هو استخدام القسطرة الدقيقة. على غرار تقنية نيفلت لكسر الحاجز الدموي الدماغي، يتضمن هذا النوع من العلاج أيضًا إدخال قسطرة في الأوعية الدموية واستخدام مانيتول لكسر الحاجز الدموي الدماغي. ومع ذلك، بدلاً من التوقف عند الشريان السباتي، تخترق القسطرة الدقيقة كل الطريق إلى الدماغ وتفتح الحاجز الدموي الدماغي في منطقة محدودة جدًا بالقرب من المنطقة التي يوجد بها الورم المرضي. يقول جون بوكوير، جراح الأعصاب في مركز ويل كورنيل المشيخي الطبي في نيويورك، الذي يدير التجارب السريرية للقسطرة الدقيقة: "إنه إجراء دقيق للغاية".
ليس من الواضح بعد ما إذا كان هذا العلاج له أي ميزة أو عيب. فمن ناحية، يؤدي اختراق الحاجز الدموي الدماغي في منطقة محدودة إلى تقليل خطر تورم الأنسجة والنوبات، وغني عن القول أن جزءًا صغيرًا فقط من الدماغ يتعرض لأدوية العلاج الكيميائي السامة. ومن ناحية أخرى، كما يشير نيولت، فإن التركيز على منطقة محدودة من الدماغ له عيب في علاج الأمراض التي تشمل الدماغ بأكمله مثل السرطان أو مرض الزهايمر المتقدم. يقول: "مع القسطرة الدقيقة، فإنك تهاجم فقط ما تراه". ولكن بشكل خاص في أورام المخ، فإن هذه هي على وجه التحديد النقائل الصغيرة وغير المرئية التي تسبب في النهاية وفاة المريض."
يتم الآن استخدام القسطرة الدقيقة بشكل روتيني لحقن الأدوية المضادة للتخثر مباشرة في الدماغ لمرضى السكتة الدماغية. ويقوم بوكوير وفريقه الآن باختبار فعالية العملية في إدخال بعض أدوية السرطان. ويقولون إنه في نهاية المطاف، سيكون من الممكن استخدام هذه التكنولوجيا لعلاج أمراض مثل مرض الزهايمر، ومرض باركنسون، أو نظريًا أي مرض دماغي يوجد له دواء لا يمكنه عبور حاجز الدم في الدماغ دون مساعدة.
هناك إستراتيجية أخرى تستخدم لاختراق الحاجز تستخدم موجات فوق صوتية مركزة وفقاعات مجهرية. يقوم الباحثون بحقن محلول ملحي في مجرى الدم يحتوي على فقاعات مجهرية. ثم يستخدمون شعاعًا مركزًا من الموجات فوق الصوتية التي تجعل الفقاعات تهتز بسرعة وتخترق حاجز الدم في الدماغ في مكان محدد ودقيق. ونتيجة لذلك، يمكن للأدوية التي يتم حقنها أيضًا في مجرى الدم أن تخترق الدماغ. بعد مرور بعض الوقت على العلاج، يتم تجديد الوصلات بين الخلايا وتسد حاجز الدم في الدماغ مرة أخرى. ويعمل حاليًا باحثون من جامعتي هارفارد وكولومبيا ومؤسسات بحثية أخرى على تطوير هذه التكنولوجيا. وأظهرت التجارب التي أجريت على القرود أن هذه التقنية آمنة، وفي ضوء ذلك من المقرر إجراء تجارب على البشر في المستقبل القريب.
وبطبيعة الحال، فإن اختراق الحاجز الدموي الدماغي ليس الطريقة الوحيدة لوصول المخدرات إلى الدماغ. هناك طريقة أخرى تتمثل في تسللها عبر الحاجز عن طريق ربطها بمواد تمر عبر الحاجز بشكل طبيعي. الباحثون الذين يطورون هذه الأدوية يطلقون عليها اسم أحصنة طروادة. إلى حد ما هذه تسمية خاطئة. والدواء لا يختبأ داخل المادة الطبيعية، بل يرتبط بها في نهايته مثل العربة المسحورة. الطريقة تعمل في بعض الحالات. تمكن حصان طروادة الذي طورته شركة Genentech من تقليل كمية رواسب الأميلويد في أدمغة القوارض بنسبة 47%. يخترق هذا الدواء الدماغ بمساعدة نفس المستقبلات المسؤولة عن مرور أيونات الحديد. ويعمل الباحثون حاليًا على تطوير أدوية مماثلة (ليس فقط لعلاج مرض الزهايمر، بل أيضًا لأمراض الدماغ التنكسية الأخرى) في جامعة كاليفورنيا وأماكن أخرى، وكلها تتحرك ببطء نحو نفس الهدف: التجارب البشرية.
ألفا وأوميغا
وفي الوقت نفسه، تشير النتائج الجديدة إلى أهمية الحاجز الدموي الدماغي ليس فقط في تطور الأمراض، ولكن أيضًا في العمليات البيولوجية الأساسية مثل عمليات التطور والشيخوخة: بداية الحياة نفسها ونهايتها. كشفت التجارب التي أجريت في العشرينات من القرن العشرين أن الحاجز قد أصبح ناضجًا بالفعل عند الأطفال حديثي الولادة، وهذا التفسير مقبول من قبل علماء الأحياء التنموية والباحثين في مجال الحاجز الدموي الدماغي حتى يومنا هذا. ومع ذلك، تظهر الأبحاث الحالية أن الوصلات بين الخلايا تتشكل في نفس الوقت تقريبًا الذي تنمو فيه الأوعية الدموية في دماغ الجنين. في الواقع، بدأ الباحثون يعتقدون أن الحاجز يلعب دورًا مركزيًا أثناء التطور الجنيني في خلق بيئة محمية حيث الخلايا العصبية فقط هي التي يمكنها التطور والاتصال بشكل صحيح.
وبعد ذلك، مع تقدمنا في السن، تبدأ هذه البيئة المحمية في الانهيار. بدأ الباحثون يشتبهون في أن التغيرات الطفيفة في الحاجز الدموي الدماغي، ربما إعادة تنظيم نظام الأوعية الدموية الدماغية أو ربما تسربات صغيرة في الحاجز نفسه، تمهد الطريق للأشكال المختلفة من الأمراض التنكسية للجهاز العصبي التي تظهر مع شيخوخة. يقول دروز، الذي يدرس الحاجز منذ أكثر من 20 عامًا: "هذا هو الشيء الكبير التالي الذي يجب أن ننظر إليه". "ربما يكون الدرس الذي نحتاج إلى تعلمه هو مدى ضآلة ما نفهمه بالفعل."
______________________________________________________________________________
على دفتر الملاحظات
جينان إنترلاندي (إنترلاندي) هي صحفية علمية تعيش في مدينة نيويورك. أمضت العام الماضي في دراسة تاريخ العلوم والطب كزميلة في برنامج نيمان في جامعة هارفارد.
باختصار
لأكثر من مائة عام يعتقد العلماء أن حاجز الدم في الدماغ هو حاجز صلب وغير قابل للاختراق. في الواقع، فهو يتكون من أوعية دموية طبيعية ذات ميزة خاصة واحدة: الأنسجة الخلوية التي تبطن هذه الأوعية الدموية منظمة بشكل محكم للغاية، مما يسمح فقط لعدد صغير من أنواع الجزيئات باختراق أنسجة المخ.
الحاجز فهو عضو حيوي عندما يكون مع نفسه، يعج بالنشاط. تتواصل الخلايا المختلفة التي تتكون منها مع بعضها البعض بشكل منتظم لتحديد الجزيئات التي يجب حظرها وأيها يجب نقلها. وفي الواقع، فإن عدد الخلايا التي تمر من أحد جانبي الحاجز إلى الجانب الآخر أكبر بكثير مما كان يُعتقد سابقًا.
لتعكس المفهوم الجديد في فهم الحاجز الدموي الدماغي، بدأ العلماء يطلقون عليه اسم الوحدة الوعائية العصبية.
الكثير يعتقدون إذا فهمنا كيفية فتح الحاجز وإغلاقه، يمكننا أن نمتلك مفتاح علاج الأمراض المتعلقة بالجهاز العصبي المركزي.
كيف تعمل
الائتمان: إميلي كوبر
لعبور الخط
في حين أن الحاجز الدموي الدماغي يحمي الدماغ من المواد الضارة، فإنه يمنع أيضًا دخول المواد التي قد تنقذ الحياة. إن إدخال الأدوية إلى الدماغ لعلاج الأورام السرطانية أو لاختبار فعاليتها في علاج مرض باركنسون قد شكل تحديًا خاصًا للأطباء لسنوات عديدة. واليوم، يقوم الباحثون باختبار تقنيات جديدة واعدة من شأنها أن تسمح لهم بالقيام بما كان يعتبر في الماضي شبه مستحيل: اختراق حاجز الدم في الدماغ دون الإضرار بالأداء الطبيعي للدماغ، والقيام بذلك بالضبط خلال الفترة الزمنية اللازمة. لحقن المخدرات في الدماغ.
حاجز الدم في الدماغ
يتكون الحاجز من الخلايا البطانية التي تبطن الأوعية الدموية. في الدماغ، ترتبط هذه الخلايا ببعضها البعض بشكل وثيق عند الوصلات بين الخلايا. الخلايا البطانية محاطة بالخلايا النجمية والخلايا الحوطية، وهي الخلايا التي تغلف الأوعية الدموية وقد تسمح بالاتصال بين الخلايا. وتحيط بها الخلايا الدبقية الصغيرة التي تشارك في إصلاح الأضرار التي لحقت بالحاجز الدموي الدماغي.
أحصنة طروادة
على الرغم من أن الاسم يوحي بوجود أدوية مخبأة داخل مواد أخرى، إلا أنها في الواقع أدوية مرتبطة بنهاية جزيئات قادرة على عبور حاجز الدم في الدماغ بشكل طبيعي، على غرار مقطورة السيارة. وقد أظهرت شركة الأدوية Genentech أن مثل هذه الأدوية فعالة في الفئران، ولكن سوف يستغرق الأمر عدة سنوات قبل أن تبدأ التجارب السريرية على البشر.
فقاعات مجهرية
الصودا في الدم؟ يقوم الأطباء بحقن المرضى بمحلول ملحي يحتوي على فقاعات غازية مجهرية. عندما تصل الفقاعات إلى الدماغ، يؤدي شعاع الموجات فوق الصوتية المركزة إلى اهتزازها بطريقة تؤدي إلى فتح الحاجز وتسمح للأدوية بالتغلغل في الدماغ.
قسطرة دقيقة
يقوم الأطباء بإدخال قسطرة صغيرة عبر الأوعية الدموية إلى الدماغ ويستخدمون محلول مانيتول لفتح فتحة صغيرة في الحاجز الدموي الدماغي بالقرب من المكان الذي يريدون علاجه. ثم يقومون بحقن الدواء من خلال نفس القسطرة. تُستخدم هذه الطريقة بالفعل اليوم في الحالات التي يجب فيها حقن أدوية مضادة للتخثر في الدماغ بسبب السكتة الدماغية.
حلول فرط التناضح
يمكن لبعض المحاليل مثل المانيتول سحب السوائل من الأنسجة القريبة. عندما يقوم الأطباء بحقن محلول المانيتول في الشريان المؤدي إلى الدماغ، فإنه يمتص الماء من الخلايا البطانية ويؤدي إلى انقباضها. بعد ذلك، تنفتح الوصلات بين الخلايا ويمكن للأدوية أن تخترق الدماغ.
تمر عبر الحاجز
اعتاد علماء الأعصاب على الاعتقاد بأن التدخل في عمل الحاجز الدموي الدماغي أمر خطير للغاية. واليوم يستخدمون القسطرة، والفقاعات الصغيرة، والموجات فوق الصوتية، وحتى خدعة سُميت على اسم مشهد مشهور في الإنيادة لفيرجيل، لحقن المخدرات عبر الحاجز الدموي الدماغي.

تعليقات 5
مقالة مثيرة للاهتمام، شكرا.
يتم الوقاية من جميع الأمراض بما في ذلك عملية الشيخوخة عن طريق الآلية الوراثية. وفي المرحلة الثانية، أفترض أنهم سيكونون قادرين على استخدام عبور الحاجز الدموي الدماغي لإجراء إصلاح شامل لتصحيح الجينات المعيبة من خلال الهندسة الوراثية. وإصلاح الحاجز الدموي الدماغي وحتى تحسينه في الحالات التي يكون فيها سيساعد الاختراق أو الأكثر نفاذية مقارنة بالمتوسط على منع تغلغل العوامل المعادية في القشرة الدماغية. على مستوى البحث في وظائف المخ ودراسته، يعد الحاجز الدموي الدماغي أيضًا أداة بحثية.
خطأي، آسف إذا قفزت مبكرًا (أو تم تصحيح الصياغة السابقة)
"إنه نظام ديناميكي ونشط قادر على إحداث ثورة"
يا لها من صياغة - لغة عبرية قياسية حقًا، ومن المؤسف ألا تتم مراجعة المقالات هنا قبل نشرها.
مقالة مثيرة جدا للاهتمام! شكرا!
ساحر