ابتكر علماء من معهد وايزمان طريقة جديدة لتثبيت البروتينات، بناءً على حساب أولي للخصائص الفيزيائية، وإيجاد تسلسل البروتين المستقر، وهندسة البروتين المطلوب.
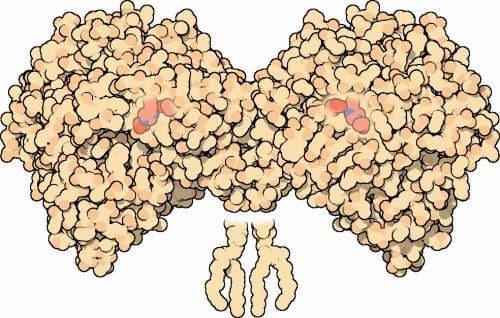
يعد الاستقرار صفة مهمة في الحياة، وفي حالات قليلة أيضًا في علوم الحياة. ومن الأمثلة الصارخة في هذا الصدد البروتينات التي تقوم بمعظم العمليات الحيوية في الخلية. وقد واجهت دراسة هذه البروتينات صعوبة في كثير من الأحيان، لأن العديد من البروتينات، وخاصة البروتينات الكبيرة الموجودة وتعمل في خلايا الجسم البشري، تكون غير مستقرة. ومن الصعب جدًا إنتاجها في الأنظمة البكتيرية، كما أنها حساسة للحرارة أو الظروف البيئية، والبعض الآخر ببساطة له عمر قصير للغاية.
في مجال البحوث نشرت مؤخرا في المجلة العلمية خلية جزيئية يعرض دكتور شيرال فليشمان وطالبه البحثي عدي غولدنزويج، وكذلك البروفيسور دان توفيق وفريق العمل الدكتور موشيه جولدشميت، من قسم العلوم الجزيئية الحيوية في معهد وايزمان للعلوم، طريقة لحل هذه الصعوبة. كجزء من بحث الدكتوراه، طورت غولدنزويج طريقة لتثبيت البروتينات، بناءً على حساب الخصائص الفيزيائية، من ناحية، وعلى قواعد بيانات الهياكل الجزيئية التي تم بناؤها في السنوات الأخيرة، من ناحية أخرى. وكجزء من بحثها، حاولت إنشاء نسخة مستقرة من إنزيم أستيل كولين أو AChE (انظر الإطار). يعد هذا اختيارًا شجاعًا إلى حد ما، نظرًا لأن هذا الإنزيم ليس حساسًا للحرارة فحسب، وقد تؤدي التغيرات في درجات الحرارة إلى إضعاف وظيفته، ولكنه أيضًا نشط في الدماغ وفي نقاط الاتصال بين الأعصاب والعضلات، ويلعب دورًا مركزيًا في وظيفتين. مجالات مختلفة - مرض الزهايمر وطرائق عمل غازات الأعصاب والمبيدات الحشرية. قد تسمح النسخة المستقرة من الإنزيم بمجموعة متنوعة من التطبيقات في كل من البحث والطب.
كتب غولدنزويج خوارزميات لتصميم البروتينات، وبعد فحص التصميمات المحتملة لإستراز الأسيتيل كولين مع الدكتور فليشمان، توقعوا أن النسخة المستقرة من الإنزيم ستتضمن 51 طفرة مختلفة - حوالي 10٪ من الأحماض الأمينية في الجزء النشط من البروتين. إنزيم. إن تطبيق مثل هذه الكمية من التغييرات على جزيء بروتين واحد هو عملية صعبة ومعقدة، وهنا يدخل الصورة عالم الفريق الدكتور موشيه جولدشميد، من مختبر البروفيسور توفيق، وهو أيضًا من قسم العلوم الجزيئية الحيوية في المعهد. وأكد الدكتور جولدشميت هذا التوقع في إحدى التجارب، وأظهر أن البروتين الذي تم إنتاجه وفقًا للخطة، وشمل جميع الطفرات المقترحة، استقر بالفعل بشكل كبير، وأصبح من الممكن الآن إنتاجه بكميات كبيرة في الأنظمة البكتيرية، و أنها ستعمل بشكل جيد في درجات حرارة عالية.

وبعد نجاح هذه التجربة، أنشأ العلماء - الذين انضم إليهم العالم الدكتور حاييم بريلوسكي - خادمًا آليًا للتنبؤ بالتغيرات اللازمة لتثبيت البروتينات، والذي أطلق عليه اسم Protein Repair One Stop Shop (PROSS). يقول الدكتور فليشمان: "الخادم مفتوح للاستخدام من قبل العلماء من جميع أنحاء العالم". "أنت تغذي البروتين، وبعد بضع ساعات تحصل على عدة تنبؤات مختلفة للإصدارات المستقرة من البروتين، والتي يسهل اختبارها في المختبر." وقد تساعد طريقة التثبيت الجديدة في تطوير أدوية تعتمد على البروتينات، أو في إنتاج البروتينات التي تحافظ على استقرارها حتى في درجات الحرارة المرتفعة، أو في تخزين اللقاحات دون تبريد، أو في توصيل الأجسام المضادة إلى أماكن بعيدة عن المستشفيات.
قصة الانزيم
في عام 1993، نجح عالمان من معهد وايزمان للعلوم، البروفيسور إسرائيل سيلمان من قسم البيولوجيا العصبية والبروفيسور يوئيل سوسمان من قسم البيولوجيا الهيكلية، في فك رموز البنية المكانية ثلاثية الأبعاد لإنزيم أستيل كولين. يلعب هذا الإنزيم دورًا مركزيًا في الجهاز العصبي: فهو يكسر الناقل العصبي أستيل كولين، مما يسمح بمرور إشارات إضافية عند الوصلات بين الأعصاب والعضلات. عندما لا يكون الإنزيم نشطًا عند المستوى المطلوب، ولا يكسر الأسيتيل كولين بشكل صحيح، يتم إنشاء فائض من الأسيتيل كولين في هذه الوصلات، ونتيجة لذلك، فإن الإشارات العصبية "تقفل" العضلات، مما قد يسبب توقف التنفس والوفاة. .
في الواقع، هذا هو بالضبط ما تفعله غازات الأعصاب والمبيدات الحشرية: فهي تمنع الإنزيم المتحلل، مما يتسبب في تراكم ضار للناقل العصبي. لكن تثبيط الإنزيم المتحلل يمكن أن يكون له أيضًا آثار إيجابية، على سبيل المثال، في المرضى الذين يعانون من مرض الزهايمر: تثبيط الإنزيم المتحلل، الذي يقوي التواصل العصبي، هو في الواقع عملية مرغوبة؛ في الواقع، تعتمد أدوية مرض الزهايمر على مواد تمنع الإنزيم المتحلل.
بعد حوالي عقد من فك رموز البنية المكانية ثلاثية الأبعاد لإستراز الأسيتيل كولين، حاول البروفيسور دان توفيق، من قسم العلوم الجزيئية الحيوية، تطوير نسخة فعالة من الإنزيم، لكن عدم استقرار الجزيء لم يسمح بذلك. ولهذا السبب اقترح البروفيسور توفيق على الدكتور شيرال فليشمان محاولة إيجاد طريقة لتثبيت البروتين. وهكذا، بعد مرور أكثر من 20 عامًا على إنجاز البروفيسور سوسمان والبروفيسور سيلمان، قد يساعد البحث الحالي الذي أجراه آدي غولدنزويج والدكتور فليشمان في إيجاد طرق أفضل لتثبيط هذا الإنزيم، وبالتالي يكون بمثابة أساس لعلاج متقدم لمرض الزهايمر. .
كتب العلوم
يتكون إنزيم أستيل كولين من 550 حمض أميني. عدد التسلسلات الممكنة لبروتين بهذا الحجم هو 10715 – أكثر من عدد الذرات الموجودة في الكون. لتقليل هذا العدد بشكل كبير، وإيجاد الحلول التي تتمتع بأفضل فرص العمل بشكل مستقر، من الضروري وجود خوارزمية متطورة وفعالة. الخوارزمية التي طورها العلماء خفضت عدد الاحتمالات إلى 1030.
