يتم الآن علاج عدة أنواع من السرطان في مراحل متقدمة بنجاح باستخدام الخلايا المناعية الاصطناعية، وهي أقوى وأطول عمرًا من أي خلية مناعية موجودة بشكل طبيعي في الجسم.
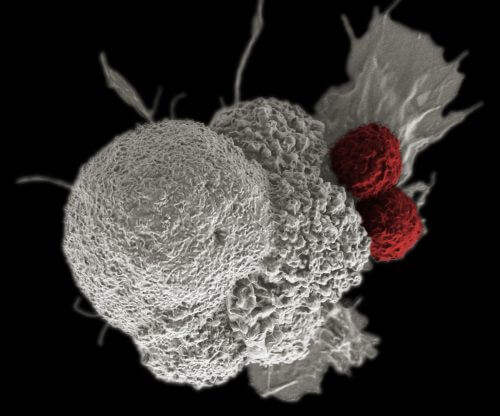
- لقد وجد أن الخلايا المناعية الاصطناعية، التي تسمى CAR T، فعالة بشكل مثير للإعجاب في علاج سرطان الدم وسرطان الغدد الليمفاوية.
- تعمل هذه الخلايا على زيادة وتقوية قدرة الجسم على محاربة الخلايا الخبيثة.
- ولكنها يمكن أن تسبب آثارًا جانبية غير مرغوب فيها، وفي بعض الحالات قد تسبب الوفاة. ويأمل الباحثون الآن في تطوير خلايا CAR T جديدة تكون مناسبة لعلاج أنواع أخرى من السرطان وتسبب آثارًا جانبية أقل.
ويعرف علماء المناعة المتخصصون في الأورام السرطانية منذ عدة عقود أن جهاز المناعة قد يكون حليفا مهما في مكافحة السرطان. ومع ذلك، فإن معظم المحاولات المبكرة لتوظيف قدرتها كانت مخيبة للآمال. وتبين أن الباحثين في الماضي لم يفعلوا ما يكفي لتحفيز المكونات الرئيسية لجهاز المناعة، والتي تعمل في الجهاز مثل التخصصات في الجيش، والتي تسمى الخلايا التائية. والجهاز المناعي الذي يخوض معركة ضد السرطان دون زيادة قدرة الخلايا التائية على التعرف على الخلايا السرطانية ومهاجمتها يشبه جيشًا يخوض معركة مجهزًا بالطائرات الورقية والمقاليع.
تم اكتشاف التلميحات الأولى إلى أن الخلايا التائية تحتاج إلى تعزيز كبير لتكون قادرة على مكافحة السرطان خلال الثمانينيات. وحاول الباحثون تعزيز استجابات الجهاز المناعي عن طريق استخراج الخلايا التائية من أجسام المرضى، مما يسمح لهم بالتكاثر في المختبر ثم حقن الخلايا العديدة مرة أخرى في دم المرضى. وقد ساعدت هذه الطريقة بعض المرضى ولكن ليس لفترة طويلة. فقدت الخلايا التي تم إعادتها إلى الجسم حيويتها تدريجيًا وتوقفت عن العمل بعد وقت قصير من إدخالها إلى الجسم.
حاولت مجموعات مختلفة من الباحثين معالجة المشكلة بطرق مختلفة. وقد أظهرت إحدى الاستراتيجيات، التي اعتمدناها نحن وزملائنا، مؤخراً علامات نجاح مثيرة في التجارب السريرية. في التسعينيات، أثناء محاولتنا اكتشاف علاجات جديدة لفيروس نقص المناعة البشرية، قام اثنان منا (جون وليفين) بتطوير تقنية محسنة قادرة على تعزيز الخلايا التائية المأخوذة من المرضى بشكل كبير. وزادت الطريقة من كمية الخلايا وجعلتها أيضا أكثر قوة ونشاطا من أي شيء تم تحقيقه بالطرق السائدة في ذلك الوقت. ثم، منذ حوالي 90 سنوات، قمنا بتطوير طريقة جديدة لتعديل الخلايا التائية وراثيًا بحيث تكون الخلايا قادرة على التوطين بشكل فعال ومهاجمة بعض الخلايا الخبيثة التي تتميز بسرطانات خلايا الدم البيضاء، مثل سرطان الدم وسرطان الغدد الليمفاوية.
في السنوات الأخيرة، تم اختبار هذه الخلايا المناعية الاصطناعية، المعروفة باسم "الخلايا التائية ذات مستقبل المستضد الخيميري" (عربة التسوق)، في عشرات الدراسات التي شملت ما يقرب من 1,000 مريض عانوا من سرطان الدم أو سرطان الغدد الليمفاوية في مراحل متقدمة. ويعيش نصف هؤلاء المرضى أو أكثر، حسب كل مرض، لفترة أطول من المتوقع، ويبدو أن السرطان قد اختفى لدى المئات منهم.
هناك إجماع متزايد بين الباحثين على أن العلاج باستخدام خلايا CAR T، سواء بمفردها أو بالاشتراك مع طرق العلاج الأخرى، سيوفر علاجًا طويل الأمد لأنواع معينة من سرطان الدم. وفي المستقبل، يحتاج الباحثون إلى التأكد من أن هذا العلاج فعال أيضًا ضد أنواع أخرى من السرطان، وإيجاد طريقة أفضل لتنظيم الآثار الجانبية، والتي يمكن أن تكون قاتلة في بعض الحالات. لكن النجاح الذي تحقق حتى الآن، والذي يتضمن مواجهة سلسلة من التحديات الصعبة على مدار ما يقرب من 20 عاما، أمر مشجع بالتأكيد.
ترقية الخلايا التائية
عندما انطلقنا في الطريق الذي قادنا في النهاية إلى خلايا CAR T، كانت مهمتنا الأولى هي إيجاد طريقة لزيادة القدرة القاتلة للخلايا التائية المأخوذة من المرضى. ولم تكن مهمة سهلة على الإطلاق. لكي تبدأ الخلايا التائية في العمل، يجب أن تتلقى إشارات من مجموعة أخرى من الخلايا التي تشارك في الجهاز المناعي تسمى الخلايا الجذعية. فقط بعد أن تتلقى الخلايا التائية الإشارات المناسبة، فإنها تكون قادرة على تحقيق إمكاناتها الكاملة. وعندما يحدث ذلك، فإنها تنقسم عدة مرات، وتنتج عددًا كبيرًا من الخلايا الجديدة المتطابقة (جميعها تهدف إلى إصابة نفس الهدف) وتطلق منها مواد تسمى السيتوكيناتوالتي تضيف وتزيد من قوة الاستجابة المناعية للجسم. وبعد بضعة أيام تعود الخلايا التائية إلى مستوى وظيفتها الأساسي وتسمح لجهاز المناعة والجسم بأكمله بالعودة إلى مستويات الوظائف الطبيعية.
في منتصف التسعينيات، أثناء العمل على فيروس نقص المناعة البشرية، قرر جون وليفين تحسين هذه العملية الطبيعية عن طريق تحفيز الخلايا التائية في المختبر. كانت خطتنا هي استخراج الخلايا التائية من جسم المريض، وتنشيطها، وتشجيعها على التكاثر بأعداد أكبر عدة مرات مما يمكنها التكاثر بشكل طبيعي في الجسم وحقنها مرة أخرى في ذلك الشخص. وكانوا يأملون أن يؤدي ذلك إلى تعزيز قدرة الجهاز المناعي للمريض بشكل كبير على مكافحة فيروس نقص المناعة البشرية وغيره من الأمراض التي تهاجم الشخص المصاب بالإيدز.
لكن كان علينا أولاً إيجاد طريقة فعالة لتنشيط الخلايا التائية. من الناحية النظرية، كان من الممكن تعريضهم للخلايا الجذعية، والتي عزلناها أيضًا من كل مريض، لكن الخلايا الجذعية تختلف اختلافًا كبيرًا من شخص لآخر من حيث عددها ونوعيتها، وخاصة بين حاملي فيروس نقص المناعة البشرية أو مرضى السرطان. وللتغلب على هذه المشكلة، قررنا تطوير بدائل اصطناعية للخلايا الجذعية. وبعد عدة محاولات، قررنا استخدام كرات مغناطيسية صغيرة، وقمنا بتغليفها بطبقة من بروتينين قادرين على تقليد النشاط المحفز للخلايا الجذعية، بل وحتى تحسينه.
قمنا بعد ذلك بجمع الخلايا التائية من دم المرضى وتحفيزها على العمل باستخدام الخرز متعدد الأغراض. وفي نهاية العملية، التي استمرت ما بين خمسة وعشرة أيام، تضاعفت الخلايا التائية لدى مرضانا وأنتجت 100 خلية إضافية. أصبحت طريقتنا القائمة على الكريات الآن واحدة من الأدوات الأساسية المتاحة للباحثين لتنمية الخلايا التائية المنشطة، وتستخدم على نطاق واسع في الأبحاث والتجارب السريرية.
إعادة تشكيل الخلية التائية
بينما يستعد الجسم للاستجابة المناعية ضد السرطان، فإنه يواجه تحديين رئيسيين. الأول: أصل الخلايا الخبيثة في خلايا الجسم نفسه. وبما أن الجهاز المناعي قد تطور بطريقة تجعله لا يتعرف على أنسجة الجسم ولا يهاجمها، فإنه يواجه صعوبة في التمييز بين الخلايا السرطانية والخلايا الطبيعية. التحدي الثاني هو أن العديد من الخلايا السرطانية مجهزة بوسائل متنوعة لقمع الاستجابة المناعية. لديهم وسائل تمويه تخفيهم عن خلايا الجهاز المناعي، كما أنهم قادرون على التدخل وتعطيل الاستجابة المناعية الفعالة.
تم تجهيز الخلايا التائية بوسائل تمنعها من مهاجمة خلايا الأنسجة السليمة. تتعرف الخلية التائية على الخلية السرطانية من خلال التعرف على جزيئين موجودين على سطحها الخارجي. يعد تحديد هذين الجزيئين ضروريًا لتحديد الخلية على أنها سرطانية. فقط في حالة وجودها، تقوم الخلية التائية بمهاجمة الخلية. إحداها عبارة عن بنية جزيئية كبيرة تسمى MHC تتكون من عدة بروتينات. يتضمن الهيكل مكون البروتين المستخدممولد المضاد: جزيء "تقدمه" الخلايا الجذعية إلى الخلايا التائية وتقوم بتنشيطها. أما الجزيء الضروري الثاني، والذي يسمى رابطة التحفيز المشترك، فهو يوفر الإشارة التي تخبر الخلايا التائية بالهجوم. إذا لم يكن أحد الجزيئين، وحدة مستضد MHC أو الربيطة، موجودًا على غشاء الخلية المشتبه بها، فإن الخلية التائية ستتجاهله ببساطة. إذا كان الأمر كذلك، فإن الخلية السرطانية لديها وسيلتان لخداع الخلايا المناعية: يمكنها التوقف عن إنتاج جزيئات التوافق النسيجي الكبير (MHC) على سطح غشاء الخلية، أو تقديم شكل مختلف من الروابط التحفيزية المشتركة على سطحها والتي تشير إلى الخلايا التائية بالامتناع عن النشاط .
ولكن ماذا سيحدث إذا خضعت الخلايا التائية لتغير جيني يسمح للباحثين بأخذ مكان الخلايا الجذعية، واختيار المستضد المستهدف لها: على سبيل المثال، مستضد متوافر بكثرة على سطح الخلايا السرطانية وليس بالضرورة المقدمة من جزيئات MHC؟ وماذا سيحدث إذا لم تخضع هذه الخلايا التائية لعملية مكونة من خطوتين لبدء مهاجمة الخلايا السرطانية؟ إن تطور تكنولوجيا خلايا CAR T أتاح للباحثين لأول مرة وسيلة تسهل عليهم تجربة هذا النهج عمليا.
على عكس الخلايا التائية الطبيعية، تهاجم خلايا CAR T الخلايا السرطانية فورًا بعد أن تتعرف على هدفها.
كان الحل هو مطابقة الخلايا التائية مع الجينات التي من شأنها أن تؤدي إلى إنشاء جزيء اصطناعي (CAR)، قادر على القيام بشيئين في نفس الوقت: التعرف على المستضد المختار (في أيدي الباحثين) وتنشيط المستضد T. -الخلية حتى في حالة عدم وجود إشارات التنشيط المعتادة. لقد تمكنا من تحقيق هذا الهدف من خلال الجمع بين مكونات البروتين التي هي في الواقع أجسام مضادة (والتي عادة ما تهاجم البكتيريا والفيروسات) مع بروتينات إضافية معروفة بتحفيز الخلايا التائية. وبشكل أكثر دقة، قمنا بتصميم الجزء الشبيه بالجسم المضاد من CAR، والذي يخرج من غشاء الخلية، بحيث يمكنه الارتباط بمستضد السرطان المحدد. علاوة على ذلك، قمنا بتجميع بقية اتحاد CAR، الذي يخترق غشاء الخلية بأكمله، بطريقة تولد الإشارات المناسبة وتنشط الخلية بمجرد أن تتعرف على المستضد الفريد للسرطان.
إن فكرة مهاجمة مستضدات خاصة بالسرطان لمحاربة الأورام الخبيثة ليست جديدة بالطبع. وفي التسعينيات، بدأ الأطباء في علاج المرضى بما يسمى بالأجسام المضادة الأجسام المضادة وحيدة النسيلة، الذي يحدد موقع البروتينات الفريدة الموجودة بشكل رئيسي على أغشية الخلايا لأنواع مختلفة من الأورام. لكن الأجسام المضادة تبقى في الجسم لبضعة أسابيع فقط. وعلى النقيض من ذلك، عندما يتم هندستها في الخلايا التائية، فإنها تظل نشطة طوال حياة الخلية التائية، وأحيانًا لسنوات.
كان التحدي التالي هو جعل الخلايا التائية تنتج الجزيء المطلوب لتنشيط الجسم المضاد. قررنا الاستفادة من الميل المعروف لفيروسات فيروس نقص المناعة البشرية لإصابة الخلايا التائية. لقد أزلنا الجينات التي تجعل فيروس نقص المناعة البشرية مميتًا وأدخلنا مكانها جينات تحتوي على المعلومات اللازمة لبناء جزيئنا الهجين، وهو منشط الأجسام المضادة. ثم سمحنا للفيروسات غير الضارة بإصابة الخلايا التائية التي أزلناها من مرضانا. قامت الفيروسات المعدلة وراثيا بنقل الجينات إلى الخلايا التائية؛ من هذه المرحلة، استمرت الخلايا في تكوين اتحادات CAR ودمجها في بنية أغشية الخلايا. (ليست هناك حاجة إلى معقد التوافق النسيجي الكبير (MHC) أو ربيطة التحفيز المشترك.) علاوة على ذلك، تم تصميم هذه الخلية التائية الجديدة بحيث يمكنها تعقب المستضد بالضبط، أو مجموعة المستضدات، التي اختارها الباحثون لها.
في منتصف التسعينيات وأوائل العقد الأول من القرن الحادي والعشرين، تعلمنا، بالتعاون مع آخرين، تحويل الخلايا التائية المأخوذة من مرضى مصابين بفيروس نقص المناعة البشرية إلى خلايا CAR T واختبرنا نشاطها في التجارب السريرية البشرية. نحن نواصل تحسين طريقتنا ونتوقع تطوير علاجات أكثر تقدمًا لفيروس نقص المناعة البشرية في غضون سنوات قليلة.
كما بدأ اختبار خلايا CAR T في علاج مرضى السرطان من قبل عدة مجموعات بحثية. لقد هدفنا إلى ربط التقنيات - لاستخدام ما تعلمناه حول تنشيط الخلايا التائية باستخدام الكريات، جنبًا إلى جنب مع طريقة CAR، لتصميم وإعادة توجيه الخلايا التائية غير الضارة وفيروسات فيروس نقص المناعة البشرية التي من شأنها أن تكون بمثابة نوع من حصان طروادة الصديق الذي من شأنه أن اختراق الخلايا التائية وإدخال الحمولة المخصصة للسيارة فيها.
وسرعان ما اكتشفنا مدى قوة خلايا CAR T هذه.
دراسة التخطيط الجديد
أصبح لدينا الآن قوة نيران عالية إلى حد ما تحت تصرفنا، وشعرنا أيضًا بالثقة في أن هدفنا كان راسخًا. إن الإشارة المثالية التي من شأنها أن تسمح للخلايا التائية لدينا بالتمركز على الهدف يجب أن تكون بالطبع مستضدًا موجودًا فقط في الخلايا السرطانية، لكن مثل هذه المستضدات نادرة جدًا. وبما أن أصل جميع الخلايا السرطانية هو خلايا الجسم الطبيعية، فإن الخلايا السليمة والخلايا السرطانية عادة ما تظهر نفس المستضدات على أغشية الخلايا. وغني عن القول أن خلايا CAR T الموجهة نحو المستضدات الشائعة ستدمر الأنسجة السليمة بالإضافة إلى أنسجة الورم.
ومع ذلك، هناك بعض الاستثناءات الهامة. على سبيل المثال، تتطور أنواع معينة من سرطان الدم وسرطان الغدد الليمفاوية من مجموعة من خلايا الدم البيضاء تسمى الخلايا البائية. يمكن للناس أن يعيشوا بدون الخلايا البائية، وهي الخلايا المنتجة للأجسام المضادة في أجسامنا، بشرط أن يتلقوا دفعات عرضية من الأجسام المضادة المجهزة. تحمل الخلايا البائية، ومثلها الخلايا السرطانية التي تنشأ منها، بروتينًا يسمى CD19. اعتقدنا نحن وباحثون آخرون في هذا المجال أن CD19 قد يكون هدفًا مناسبًا لعلاج خلايا CAR T لأنه غير موجود في أي نسيج سليم آخر.
قمنا أولاً باختبار الفكرة على الفئران. لاحقًا، في بداية عام 2010، بدأنا في إجراء تجارب سريرية باستخدام خلايا CAR T المُصممة لاستهداف CD19. كان ثلاثة من المرضى الأوائل مرضى بالغين كانوا في مرحلة متقدمة من سرطان الدم الليمفاوي المزمن (سرطان الدم الليمفاوي المزمن)، ولم يستجيب للعلاجات الأخرى.
كان المريض الأول هو ويليام لودفيج، وهو سجان متقاعد علم أنه مريض قبل عشر سنوات، والآن لديه كمية هائلة من خلايا سرطان الدم في جسده، حوالي كيلوغرامين ونصف، منتشرة في جميع أنحاء جسده. وفي أغسطس 2010، تلقى نصف مليار من خلاياه الخاصة التي تحتوي على خلايا CAR T الاصطناعية. وبعد عشرة أيام ارتفعت حرارته وانخفض ضغط دمه وعانى من صعوبات في التنفس، وهي أعراض جانبية حادة أدت إلى دخوله المستشفى في وحدة العناية المركزة. علمنا لاحقًا أن أعراض لودفيج كانت ناجمة عن زيادة نشاط جهاز المناعة لديه بشكل مفرط استجابةً للكمية الكبيرة من السيتوكينات الموجودة في دمه، وهي استجابة تُعرف باسم متلازمة إطلاق السيتوكين، وقد يكون قاتلاً إذا لم تتمكن من كبحه.
ولحسن الحظ، تعافى لودفيج وبعد شهر لم يجد الأطباء أي علامة على وجود خلايا بائية سرطانية في جسده. وكانت هذه النتيجة غير عادية وغير متوقعة لدرجة أن الأطباء أعادوا إجراء الخزعة للتأكد منها، وبالفعل حصلوا على نفس النتيجة. ثم قمنا بمعالجة مريضين آخرين، وكان لديهم أيضًا ردود فعل مفاجئة بنفس القدر. وبعد مرور أكثر من ست سنوات، لا يزال لودفيغ وأحد المريضين الآخرين على قيد الحياة وخاليين من سرطان الدم. وأظهرت اختبارات أخرى أن خلايا CAR T تكاثرت في مجرى الدم وفي نخاع العظم، وهو النسيج الذي ينتج خلايا الدم. وكانت كل خلية من خلايا CAR T التي تم حقنها في أجساد المرضى الثلاثة، أو الخلايا الوليدة لها، مسؤولة عن قتل ما بين 93,000 إلى 1,000 خلية سرطانية. عندما تم عزل خلايا CAR T من عينات دم المرضى بعد أشهر من العلاج، احتفظت بالقدرة على قتل خلايا سرطان الدم التي تحمل جزيئات CD19 في ظروف المختبر. في الواقع، كانت هذه الدروع بمثابة "دواء حي" طويل الأمد، والذي يستمر في الدوران في الجسم ويلتقط كل ظهور للخلية الخبيثة.
توسيع الذخيرة
وعلى الرغم من النتائج الأولية الهامة التي حققناها، فقد نفدت ميزانيتنا ولم نتمكن من تجربة علاجنا التجريبي على المزيد من المرضى. وقد توصلت لجان وكالات الأبحاث الفيدرالية التي فحصت عملنا إلى أن العلاج كان خطيرًا جدًا ولا يتطلب تمويلًا إضافيًا. ومع ذلك، فقد قدمنا مقالين يصفان نتائج المرضى الثلاثة الأوائل، وسرعان ما تم قبول المقالات ونشرها معًا في أغسطس 2011 في مجلة نيو إنجلاند للطب والعلوم الطب الانتقالي. وقد أدى هذا المنشور إلى مراجعة واسعة النطاق في وسائل الإعلام، فضلا عن اهتمام كبير من قبل المجموعات الناشئة وشركات التكنولوجيا الحيوية الذين تواصلوا مع جامعة بنسلفانيا، حيث عملنا، وكانوا مهتمين بإمكانية الحصول على ترخيص للتكنولوجيا.
في النهاية، تم الرد على أحد طلبات المنح التي قدمناها بشكل إيجابي وبالتالي تمكنا من إجراء تجربة سريرية أخرى بدأت في عام 2012، وهذه المرة على الأطفال. وفي وقت لاحق قررنا إقامة شراكة بين جامعة بنسلفانيا مع إحدى الشركات نوفارتيس لتمويل التطوير المستمر وتقديم النتائج إلى إدارة الغذاء والدواء للحصول على الموافقة للاستخدام التجاري للطريقة. لقد أطلقت هذه الشراكة سباقاً محموماً بين العديد من المراكز الطبية حول العالم التي قامت بتشكيل شركات جديدة في مجال التكنولوجيا الحيوية مخصصة لإنتاج نسخ جديدة من خلايا CAR T. وتُظهِر أحدث نتائجنا في الأطفال معدلات بقاء على قيد الحياة تبلغ 62% بعد عام واحد، مقارنة بمعدلات بقاء أقل من ذلك. أكثر من 10% بعد سنة واحدة، بسبب العلاجات القياسية.
على مدى السنوات القليلة الماضية، أبلغت العديد من المجموعات، بما في ذلك مركز صالون كيترينج للسرطان، ومستشفى سياتل للأطفال، ومركز فريد هاتشينسون لأبحاث السرطان، عن انضمامها إلى الشركة. جونو ثيرابيوتيكس، المعهد الوطني للسرطان، وهو عضو فيطائرة ورقية فارماوغيرها حول ردود أفعال مفاجئة لمرضى سرطان الدم وسرطان الغدد الليمفاوية في مراحل المرض المتقدمة. في مركزنا، قمنا بعلاج 300 مريض بخلايا CAR T التي تعالج الأورام الخبيثة في الخلايا البائية. تختلف معدلات الاستجابة اعتمادًا على المرض: حوالي نصف مرضانا الذين يعانون من سرطان الدم الليمفاوي المزمن في مرحلة متقدمة يظهرون تحسنًا سريريًا واضحًا (استنادًا إلى انخفاض عدد خلايا اللوكيميا في الجسم، إلى جانب عوامل أخرى)، بينما حوالي 90% من الأطفال مصابون بسرطان الدم الليمفاوي الحاد (الجميع) أظهرت الاستجابة الكاملة: عدم وجود علامات لوجود الخلايا السرطانية بعد شهر من العلاج.
لا نعرف سبب عدم نجاح العلاج بالخلايا CAR T في جميع المرضى الذين يعانون من الأورام الخبيثة الحاملة لـ CD19. في بعض الحالات، يكون هناك انسحاب على الأرجح بسبب عدم تكاثر خلايا CAR T في جسم المريض، أو بسبب ظهور خلايا سرطان الدم الجديدة التي لا تنتج CD19 وبالتالي لا تتأثر بالعلاج. ومع ذلك، فإن مدى الاستجابة لعلاج هذه السرطانات لم يسبق له مثيل. ومن المتوقع في عام 2017 أن تطلب شركتان من إدارة الغذاء والدواء الموافقة على استخدام خلايا CAR T لعلاج السرطان: شركة نوفارتيس لعلاج سرطان الدم الليمفاوي الحاد لدى الأطفال ولاحقًا لعلاج سرطان الغدد الليمفاوية، وشركة كايت للعلاج. من نوع معين من سرطان الغدد الليمفاوية.
ولا تزال تحديات كثيرة تواجهنا. لا يزال مجتمع البحث مشغولاً بتطوير طرق للتخفيف من أسوأ الآثار الجانبية وربما منعها. حتى لو كانت الوفيات بين المرضى نادرة، فإن بعض المرضى الذين عانوا من سرطان الدم الليمفاوي الحاد ماتوا بسبب مشاكل متعلقة بالعلاج، على الأرجح بسبب صحتهم العامة التي كانت هشة بشكل خاص، وربما أيضًا بسبب الاختلافات في بنية CAR T. الخلايا المستخدمة في معاهد البحوث المختلفة.
نحن الآن في مرحلة "الموديل ت"من أجل تطوير خلايا CAR T. أولويتنا الأولى هي توسيع نطاق إتاحتها للمرضى المصابين بسرطان الخلايا البائية والأورام الأخرى، وسيتم اختبار العديد من الابتكارات العلمية والتكنولوجية الحديثة في التجارب السريرية في السنوات المقبلة. لعلاج السرطانات غير المرتبطة بالأورام الخبيثة في الخلايا البائية، ربما يحتاج الباحثون إلى العثور على مجموعات من مستضدات معينة تكون أكثر شيوعًا في الخلايا السرطانية منها في خلايا الأنسجة السليمة، والتركيز عليها. أحدنا، على سبيل المثال (بوزي)، يحاول تطوير علاج يعتمد على الجهاز المناعي لسرطان الثدي وسرطان البنكرياس. هذه السرطانات وغيرها، وهي أمراض الأورام الصلبة، جيدة في إخفاء وتثبيط جهاز المناعة الطبيعي، أكثر من سرطان الغدد الليمفاوية وسرطان الدم، وهما أكثر عرضة للعلاج لأن خلاياهما تدور في جهاز الدم. لتحديد موقع خلايا الأورام الصلبة، يصمم بوسي خلية CAR T التي تستهدف هدفين بدلاً من هدف واحد: أحدهما هو جزيء سكر معين موجود فقط على أغشية الخلايا السرطانية ويسمح لها بالتكاثر بشكل أسرع من الخلايا السليمة؛ والثاني هو جزيء البروتين الموجود في الخلايا السليمة والسرطانية. من الناحية النظرية، من المتوقع أن يتم العثور على مزيج جزيء السكر مع البروتين بتردد عالٍ فقط على الخلايا السرطانية، مما يجب أن يحد من قدرة خلية CAR T هذه على إيذاء الأنسجة السليمة.
ونادرا ما يحدث التقدم في هذا المجال في خط مستقيم. إن خيبات الأمل والافتراضات الخاطئة والتأخير أمر لا مفر منه. ولكن ليس لدينا أدنى شك في أن النجاح الذي تم تحقيقه بالفعل في علاج سرطان الدم وسرطان الغدد الليمفاوية يبرر البحث المستمر وتطوير خلايا CAR T الإضافية.
الكشف: مثل العديد من الباحثين الآخرين في مجال السرطان، لدى المؤلفين علاقات تجارية مع العديد من الشركات الربحية. يمتلك Avery D. Posey ملكية فكرية وقد رخص استخدامه لشركة Vertis وTmunity Therapeutics، التي تطور علاجات السرطان. يتلقى كارل إتش جون وبروس إل ليفين حقوق الملكية وتمويل المختبر من شركة فيرتيس، مقابل ترخيص يسمح لهما باستخدام الملكية الفكرية واتفاقية مع جامعة بنسلفانيا. تقدمت شركة Vertis وجامعة بنسلفانيا بطلب للحصول على براءات اختراع للأدوية بناءً على بعض الأعمال البحثية الملخصة في هذه المقالة. جون وليفين هما مؤسسان ومساهمان في شركة Tmunity Therapeutics، كما أنهما يتلقيان رسومًا استشارية ويقدمان المشورة للعديد من الشركات المشاركة في العلاج بالخلايا وأبحاث السرطان. تتم إدارة هذه الاتصالات وفقًا لسياسات جامعة بنسلفانيا وتخضع لإشرافها.

تعليقات 2
فيديو مذهل