يجري "سباق تسلح" بين المضادات الحيوية والبكتيريا التي تتمكن من اكتساب مقاومة ضدها. من سيفوز؟ - مقال بقلم تسفي أتزمون نُشر في غاليليو عام 1994. أكثر موضوعية من أي وقت مضى
في نهاية الحرب العالمية الثانية، واجهت البشرية سلاحًا هدد بتدميرها بالكامل من على وجه الأرض - القنبلة الذرية. وفي المقابل: قبل سنوات قليلة، خلال نفس الحرب، تعرضت البكتيريا المسببة للأمراض (الممرضة) لسلاح المضادات الحيوية. وكان كثيرون يأملون في القضاء على أمراض مثل الالتهاب الرئوي الجرثومي، والتهاب السحايا الجرثومي، والإنتان بعد الولادة، أو الإصابة أو الجراحة، والسل، والزهري، والسيلان، وأي شيء آخر ــ الأمراض التي قتلت عدداً لا يحصى من الضحايا على مر التاريخ، وتسببت في معاناة لا توصف.
ولكن بينما لا يزال الشيطان النووي مسجونًا ولا يشكل سوى تهديد، فإن الجني - مقاومة البكتيريا للمضادات الحيوية - قد انزلق بالفعل من زجاجات المضادات الحيوية. وبالفعل، اليوم، بعد مرور أكثر من خمسين عامًا على علاج المرضى والجرحى بالبنسلين لأول مرة، وعندما يتم وضع أكثر من مائة دواء مضاد حيوي مختلف على الرفوف جاهزة للاستخدام، يموت الناس من أمراض كان من المفترض أن تصبح شيء من التاريخ. وهذه ليست مناطق متخلفة: وفقا لتقرير المركز الأمريكي لمكافحة الأمراض والوقاية منها، في عام 1992 توفي أكثر من 13 ألف مريض في المستشفيات في الولايات المتحدة بسبب الالتهابات البكتيرية المقاومة للمضادات الحيوية. وإذا لم يكن هذا الرقم المقلق كافيا، فإن المستقبل يبدو أكثر إثارة للقلق. في شهر مارس من هذا العام، نُشرت مقالة في مجلة نيوزويك بعنوان "نهاية المضادات الحيوية" مكتوبة بأحرف كبيرة. في إبريل/نيسان، تم تخصيص معظم أعداد المجلة العلمية المرموقة "ساينس" للموضوع، لكن عنوانها كان أكثر هدوءا: "مقاومة المضادات الحيوية". أولا، سمحنا لأنفسنا أن نربط مصطلح الجين بظاهرة مقاومة البكتيريا للمضادات الحيوية، سواء لوصفها بالشيطان الخطير الذي خرج من زجاجات الدواء، أو كتنقيح لغوي يوحي بأن أصل هذا الشيطان هو تغيير وراثي، تغيير طفيف في الجين.
لا تخطئوا في الظن أن بكتيريا المستشفيات مقاومة، لا قدر الله، لجميع أدوية المضادات الحيوية - لا، لم نصل بعد إلى نهاية المضادات الحيوية - لكن اليوم سلالات كثيرة مقاومة لكثير من الأدوية، وأحيانا حتى العلاج الطبي يتمكن الفريق من التعرف على دواء فعال ضد البكتيريا، وقد تتعرض أجهزة المريض لإصابة مميتة، ومن المتوقع أن يتفاقم الوضع. واليوم أصبحت العديد من سلالات المكورات العنقودية الذهبية التي تصيب المستشفيات مقاومة لكل أنواع المضادات الحيوية، باستثناء نوع واحد وهو الفانكومايسين. ومن الواضح للجميع أن إحدى سلالات المكورات العنقودية سوف تكتسب مقاومة للفانكومايسين أيضاً في مرحلة ما؛ ولكن عندما يحدث هذا الأخير إذا تم اختراق خط الدفاع، فسيصبح الأطباء والمرضى عاجزين، كما حدث في الأيام التي سبقت المضادات الحيوية.
أدوية غير عادية
في عام 1929، أفاد ألكسندر فليمنج عن ملاحظة قام بها: اختفت مستعمرات المكورات العنقودية من التربة النامية، أو بشكل أكثر دقة مرت عبر (Iysiis)، عندما تطور فطر البنسليوم بالقرب منها. استغرق الأمر 11 عامًا قبل أن يتمكن شايان وفلوري وزملاؤهما من استنفاد كمية كبيرة
البنسلين من فطر العفن Penicillium notatum (P. Notaton). في عام 1941، بدأ استخدام البنسلين للأغراض الطبية، وبالفعل في الحرب العالمية الثانية، تم إنقاذ حياة العديد من الجرحى بفضل حقن البنسلين. وفي عام 1949، كانت مصانع الأدوية تنتج بالفعل كميات تلبي احتياجات السوق. لقد وجد أن البنسلين جي دواء فعال للغاية ضد العديد من أنواع البكتيريا المسببة للأمراض، وعادةً لا ينطوي استخدامه على آثار جانبية سلبية. ومع ذلك، فإن البنسلينات الأصلية، والتي تم إنتاجها جميعًا من فطريات العفن، كانت لها أربعة عيوب: نشاطها ضد البكتيريا سالبة الجرام (انظر الإطار) كان منخفضًا، وكانت حساسة للأحماض، وبالتالي لا يمكن تناولها عن طريق البلع لأنها كانت دمرت في المعدة؛ أثارت ردود فعل تحسسية لدى بعض الأشخاص (المشكلة) لا تزال معروفة حتى اليوم (؛ تم تفكيكها بواسطة إنزيم البنسليناز. ومن أجل التغلب على بعض هذه العيوب على الأقل، حاول شين وزملاؤه استخراج الجزيء مشتركة بين البنسلينات المختلفة وتطوير دواء أفضل. وقد أثمرت جهودهم في عام 1957، وبالتالي فُتح الطريق لإنشاء البنسلينات شبه الاصطناعية (شبه الاصطناعية)، بما في ذلك البنسلينات (مثل الأمبيسيلين والأموكسيسيلين). يمكن تناوله عن طريق التناول، لأنه مقاوم لحموضة المعدة.
تنتمي البنسلينات إلى مجموعة من الأدوية التي تعمل على إتلاف جدار الخلية البكتيرية. ترتبط جزيئات البنسلين ببروتينات خاصة (تسمى “بروتينات ربط البنسلين”) الموجودة في الجدار، وتلعب هذه البروتينات أدواراً مختلفة في مراحل بناء الجدار، كما أن ارتباطها بجزيئات البنسلين يمنع استكمال البناء. الذي تضرر درعه الميكانيكي، وانفجر بسبب الامتصاص الأسموزي للماء.
إحدى آليات الدفاع الفعالة للبكتيريا ضد البنسلين هي إنتاج البنسليناز - وهو إنزيم يكسر البنسلين. في عام 1940، حتى قبل بدء الاستخدام الطبي للبنسلين، حدد أبراهام وتشين إنزيمًا تفرزه البكتيريا والذي يكسر البنسلين. على الرغم من أنهم افترضوا أن الإنزيم قد يخرب فعالية الاستخدام الطبي للبنسلين، فمن الممكن الافتراض أنهم لم يعرفوا مدى صحتهم. كما أن الفانكومايسين، الذي ذكرناه أعلاه، يقتل البكتيريا عن طريق إتلاف جدار الخلية البكتيرية، على الرغم من أنه ليس جزءًا من مجموعة البنسلين.
العديد من أدوية المضادات الحيوية لا تلحق الضرر بجدار الخلية البكتيرية ولكن مواقع ووظائف أخرى. هناك أدوية تضر بوظائف غشاء الخلية البكتيرية، وهناك أدوية تضر بعمليات بناء الأحماض النووية؛ العديد من أدوية المضادات الحيوية تدمر عملية بناء البروتين.
للقتال مع الريبوسوم - لتخريب البروتين
فيما يلي العديد من أدوية المضادات الحيوية ومواقع عملها في الخلية البكتيرية.
تم إنتاج الكلورامفينيكول (المعروف باسمه التجاري سينتومايسين) لأول مرة في عام 1947 من نوع من بكتيريا الستربتوميسيس. بالفعل في عام 9491 بدأوا في إنتاجه صناعيًا. يرتبط الكلورامفينيكول بالريبوسومات الموجودة في الخلية البكتيرية - تلك العضيات التي تعمل بمثابة "مصانع البروتين"، وبالتالي تمنع إنتاج البروتينات في البكتيريا. من بين التجمعات البكتيرية، يمكن العثور على طفرات مقاومة نسبيًا للكلورامفينيكول، كونها أقل نفاذية للدواء؛ عدا عن ذلك، هناك بكتيريا تنتج إنزيماً يقوم بتغيير كيميائي في جزيء الكلورامفينيكول، وبالتالي إلغاء عمله كدواء.
الأمينوغليكوزيدات - مجموعة من أدوية المضادات الحيوية (منها: الستربتوميسين، النيومايسين) التي ترتبط بريبوسومات الخلية البكتيرية وتمنع إنتاج البروتين، على مر السنين، طورت البكتيريا عدة آليات لمقاومة الأمينوغليكوزيدات، مثل الآليات التي تمنع الدواء من دخول الخلية البكتيرية؛ تطورت بروتينات الريبوسوم التي لا علاقة لها بالأدوية؛ تم عزل إنزيم يقوم بتغيير كيميائي في الدواء وبالتالي يلغي نشاطه. تم عزل الستربتوميسين لأول مرة من نوع من الستربتوميسيس بواسطة واكسمان وشاتز في عام 1944.
التتراسيكلين - مجموعة من الأدوية تم عزل أول ممثل لها في عام 1948 من نوع من الستربتوميسيس. بعد دخولها إلى الخلية البكتيرية، ترتبط التتراسيكلين بالريبوسومات وتمنع بناء البروتينات. قد تنشأ مقاومة التتراسيكلين بسبب عدم اختراقها لجدار الخلية، أو أن البكتيريا لديها آلية إزالة نشطة (الإزالة من البكتيريا باستخدام مضخة مستهلكة للطاقة).
الماكروليدات - الدواء الأكثر شهرة في هذه المجموعة هو الاريثروميسين. تم إنتاجه لأول مرة عام 1952 من أحد أنواع الستربتوميسيس. ترتبط الماكروليدات بالريبوسومات وتمنع بناء البروتينات في الخلية البكتيرية. تعد مقاومة البكتيريا للماكروليدات ظاهرة شائعة إلى حد ما، وتنشأ من الريبوسومات التي ليس لمكوناتها أي صلة بالماكروليدات.
المتانة - كيف؟
إن العوامل التي تعطي البكتيريا مقاومة (حساسية كاملة أو منخفضة لدواء ما) لمضاد حيوي معين كثيرة ومختلفة. في كثير من الحالات، تكون البكتيريا التي يكون معدل التمثيل الغذائي والتكاثر فيها بطيئًا أكثر مقاومة لأنواع معينة من المضادات الحيوية. وهذا هو، على سبيل المثال، بكتيريا السل. وفي حالة أخرى، في البكتيريا سالبة الجرام، فإن الغشاء الخارجي الذي يغطي الجدار يجعل من الصعب مرور مواد معينة، بما في ذلك الأدوية.
والظاهرة المثيرة للاهتمام والمهددة بشكل خاص هي مقاومة البكتيريا التي كانت حساسة للدواء في البداية. هذه الظاهرة هي مثال على عملية تطورية، "الوقود" الذي يحركها هو الضغط الانتقائي القوي (الاختيار)، الذي يتم إنشاؤه في ظل ظروف استخدام أدوية المضادات الحيوية. وبما أن هذه تغييرات سريعة للغاية - فبعد كل شيء، فإن التاريخ الكامل للاستخدام الطبي للمضادات الحيوية لا يتجاوز أكثر من 50 عامًا - يمكننا بالتأكيد أن نقول إننا نواجه التطور في العين، أو: التطور في الوقت الفعلي. يجب أن نتذكر أن هذه تغييرات وراثية - فالسكان المقاومون يختلفون وراثيا عن السكان الأصليين، الذين لديهم حساسية للدواء.
قد تمنح العديد من الآليات مقاومة للسلالات البكتيرية التي كانت حساسة في الأصل. إحدى الآليات هي ظهور الجين الذي يشفر تخليق إنزيم يعمل على الدواء، إما عن طريق التحلل الكيميائي، أو عن طريق تغيير كيميائي آخر، وبالتالي إلغاء فعاليته. وهناك آلية أخرى تتمثل في حدوث تغيير في الجزيء المستهدف، وهو جزيء البكتيريا التي يؤثر عليها الدواء. في هذه الحالة، من الممكن التمييز بين التغيير (الطفرة) في الجين الموجود، والذي يرمز إلى إنشاء الجزيء، و"اكتساب" الجين الذي يرمز إلى إنشاء إنزيم جديد تمامًا في الخلية وهو إنزيم يغير الجزيء المستهدف كيميائيًا ويجعله غير مرتبط بالمضادات الحيوية.
وهناك آلية أخرى تمنح المقاومة وهي تغيير خصائص نفاذية الغشاء (غشاء الخلية، أو الغشاء الخارجي في البكتيريا سالبة الجرام)، مما يجعله أقل نفاذية للدواء. مثل هذا التغيير لا يمكن أن يمنح عادة مقاومة كاملة (لأنه إذا كانت جزيئات صغيرة، فستبقى بعض النفاذية على أي حال)، ولكن فقط في تقليل حساسية البكتيريا للدواء.
الخيار الرابع هو شراء آلية لإزالة الدواء من الخلية بمساعدة بروتين خاص موجود في الغشاء يستخدم الطاقة لإزالة الدواء بشكل فعال من السيتوبلازم. منذ بداية الثمانينات، أصبحت أهمية الغسيل النشط كآلية تمنح المقاومة واضحة. ويأتي هذا في أعقاب البحث الذي أجراه ستيوارت ليفي وزملاؤه من جامعة تافتس في بوسطن. أثبتت الدراسات أن مقاومة بعض سلالات بكتيريا القولون (E. coli) للتتراسيكلين ترجع إلى طرد الدواء باستخدام الطاقة. في الآونة الأخيرة، لوحظت حالات تعمل فيها آليات التطهير "العامة" وواسعة النطاق، والتي لا تقتصر على دواء واحد أو مجموعة محدودة من الأدوية، ولكنها تقضي على مجموعة واسعة ومتنوعة من الأدوية. يعد الجمع بين تقليل النفاذية وتنشيط مضخة التنظيف فعالاً بشكل خاص - وبهذه الطريقة يمكن حماية البكتيريا تمامًا من عمل المضاد الحيوي.

تُظهر الصورة العلوية مزارع بكتيريا المكورات العنقودية الذهبية المعزولة من المرضى الذين يعالجهم أطباء الأسرة. وضعت لوحات تحتوي على المضادات الحيوية على وسط الثقافة. ويمكن ملاحظة أن معظم المستعمرات البكتيرية الموجودة حول الصفائح قد اختفت، وأصبح وسط النمو شفافًا. والسبب في ذلك هو أن هذه المكورات العنقودية حساسة لمعظم أنواع المضادات الحيوية.
يتم التعبير عن الوضع المعاكس في الصورة الوسطى. هنا، يتم زراعة "سلالات المستشفى" من نفس البكتيريا في وسط الثقافة. في حالة واحدة فقط يمكن إثبات الحساسية الكاملة لمضاد حيوي معين، في نفس المكان الذي يكون فيه قطر التثبيط كبيرًا. طورت سلالات المكورات العنقودية التي تنشأ في المستشفيات مقاومة لمعظم أنواع المضادات الحيوية.

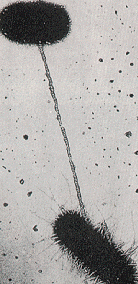
الصورة السفلية توضح عملية الاقتران بين نوعين من البكتيريا. تنتقل المادة الوراثية من بكتيريا إلى أخرى عبر الخيط الذي يربط بينهما.
توجد المضخات النشطة في غشاء الخلية. وهكذا، في البكتيريا سالبة الجرام، تقوم المضخات بإزالة الدواء، على ما يبدو، إلى المنطقة المحاصرة بين غشاء الخلية والغشاء الخارجي، وهي منطقة تعرف بالمحيطة. هذا النوع من الغسيل لم يكن ليجلب فائدة كبيرة للبكتيريا. وهنا يتبين أن البكتيريا سالبة الجرام لديها بروتينات خاصة تستخدم حسب الفرضية كبروتينات مساعدة. والافتراض هو أن هذه البروتينات تعبر المحيط، ومن خلالها تمر المواد التي تمت إزالتها بواسطة المضخة من الغشاء الخارجي.
 الروضة تمر حبي
الروضة تمر حبي
كيف "تمكنت" البكتيريا من التغلب على الأدوية التي استثمرت في تطويرها الكثير من العمل والفكر وثروة هائلة، مما ترك الأطباء عاجزين في كثير من الحالات؟ كيف تكتسب المجموعات البكتيرية الحساسة مقاومة للأدوية المضادة للمضادات الحيوية؟ ويبدو أن هذه آليات فعالة للغاية، تمكنت من مفاجأة حتى أصحاب النظر البعيد بين الباحثين.
إحدى الآليات الأكثر شيوعًا في التطور - آلية الطفرات: تغيير في تركيبة الحمض النووي الذي يسبب تغييرًا في البروتين المشفر بواسطة قطعة الحمض النووي التي تغيرت. مثل هذا البروتين يمكن أن يكون إنزيمًا، أو جزءًا من بنية بروتين الريبوسوم، على سبيل المثال. إذا كان نفس البروتين هو الجزيء المستهدف لعقار المضاد الحيوي، فإن تغييرًا بسيطًا فيه يكفي لجعله غير حساس للدواء. وهكذا، بعد الطفرات التي تؤدي إلى تغير في مكونات الريبوسومات، يمكن أن تظهر بكتيريا مقاومة للستربتومايسين أو الإريثروميسين. نتيجة للطفرات التي تسبب ضررا لبروتينات جدار البكتيريا، يمكن أن تظهر سلالات مقاومة للبنسلينات المختلفة. بعد حدوث طفرة في إنزيم بناء الحمض النووي الريبوزي (RNA بوليميراز)، يمكن أن تظهر سلالات مقاومة للمضادات الحيوية من مجموعة الريفاميسين.
ويمكن للطفرة أيضًا أن توسع نطاق عمل إنزيم البكتيريا وتسمح له بإلغاء فعالية المضاد الحيوي الجديد، الذي تم تطويره بعد "هزيمة" المضاد الحيوي السابق بواسطة البكتيريا، وبالتالي استنزاف العمالة والاستثمارات والآمال. منذ اكتشاف البنسلين، نشأ "سباق تسلح" بين شركات الأدوية والبكتيريا: فقد طورت هذه الشركات باستمرار مركبات جديدة تعمل ضد البكتيريا المقاومة، وهذه بدورها طورت مقاومة جديدة لأحدث "عقار عجيب". " كل مرة. في كثير من الحالات، يكفي تغيير حمض أميني واحد على طول السلسلة التي يتكون منها الإنزيم، لإحداث تغيير في مجال عمله. إن تغير حمض أميني واحد في البروتين ينتج عن تغير في ثلاثة توائم من النيوكليوتيدات على طول الجين الموجود في الحمض النووي للبكتيريا. في كثير من الحالات، يؤدي تغيير نيوكليوتيد واحد إلى تغيير معنى الثلاثي بأكمله، والذي يتم التعبير عنه في الحمض الأميني الذي يرمز إليه. إن تغيير نيوكليوتيد واحد على طول الحمض النووي هو طفرة نقطية. وفي هذا السياق، فإن قصة الإنزيمات المحللة للبنسلين والتي تمنح البكتيريا مقاومة للبنسلين مثيرة للاهتمام: فمن الممكن متابعة "السلالات" الجينية لهذه الإنزيمات، التي تختلف عن بعضها البعض بحمض أميني واحد فقط على طول السلسلة الطويلة، وفي الوقت نفسه تتبع التوسع في نطاق الأدوية التي يقومون بتفكيكها.
يمكن للطفرات النقطية أيضًا "تحويل" الإنزيمات التي تعمل ضمن عملية التمثيل الغذائي الطبيعي للخلية - على سبيل المثال في استقلاب السكريات - إلى تلك التي تعمل على أدوية المضادات الحيوية وتحييدها. ولكن كيف يمكن تفسير الظهور السريع للإنزيمات القادرة على التأثير على أدوية المضادات الحيوية الجديدة، في البكتيريا التي كانت حساسة لها في البداية؟ لقد اتضح أن ظهور المقاومة للمضادات الحيوية في السلالات المسببة للأمراض لا ينتج غالبًا عن إنشاء إنزيم جديد حقًا (عملية تطورية طويلة حتى عند التعامل مع أعداد كبيرة من السكان وحياة جيل قصير نموذجية للبكتيريا)، ولكن من عملية اكتساب المقاومة الجينية التي تنتقل من بكتيريا إلى أخرى.
كيف يحدث هذا؟ في الطبيعة، تتلامس البكتيريا مع العديد من المواد الحيوية المختلفة؛ يشير مصطلح "المضادات الحيوية" ذاته إلى الأصل الطبيعي لهذه المواد - إفرازات الكائنات الحية. ومن بين التجمعات البكتيرية التي تعرضت لمواد المضادات الحيوية الطبيعية لملايين السنين، تم بالفعل إنشاء إنزيمات تمنح المقاومة. من المعروف منذ زمن طويل أن البكتيريا تميل إلى تبادل أجزاء الحمض النووي مع بعضها البعض. اليوم أصبح من الواضح مدى شيوع هذه الظاهرة. وكما هو الحال مع البريد الإلكتروني، تتبادل البكتيريا البلازميدات (أجزاء مستقلة من الحمض النووي شائعة بين البكتيريا، وتتضمن جينات مهمة، بما في ذلك جينات المقاومة). تقوم البكتيريا أيضًا بنقل أجزاء من الكروموسومات. تعمل الفيروسات البكتيرية أيضًا كحاملات قادرة على نقل الجينات من بكتيريا إلى أخرى. تسمى عمليات النقل المختلفة الاقتران (ارتباط البكتيريا أثناء نقل المادة الوراثية)، والتحول، والتحول (النقل عبر فيروس بكتيري).

مستعمرات نوعين من المكورات العنقودية. أكبرها ينتمي إلى المكورات العنقودية الذهبية.
منذ حوالي عقد من الزمان، أصبح من الواضح أن الاقتران، الذي يعتبر نوعًا من أنواع التزاوج، لا يقتصر بالضرورة على البكتيريا التي تنتمي إلى نوع بيولوجي واحد؛ اتضح أن اثنين من البكتيريا، التي تنتمي إلى أنواع بيولوجية مختلفة، وحتى بعيدة عن بعضها البعض، يمكن أن تقوم بالاقتران، على سبيل المثال - عندما ينتمي أحدهما إلى نوع هوائي وشريكه هو بكتيريا لاهوائية (لاهوائية). وكانت المفاجأة أكبر عندما أصبح من الواضح أنه حتى البكتيريا الموجودة على جانبي "الحاجز"، والتي كان يُنظر إليها لسبب ما على أنها غير قابلة للعبور: البكتيريا إيجابية الجرام والبكتيريا سالبة الجرام، يمكنها إجراء الاقتران ونقل المواد الوراثية. وبالتالي، فإن المادة الوراثية تمر بحرية تقريبًا بين البكتيريا المختلفة، لدرجة أنه بدلاً من التفكير في البكتيريا التي تتبادل الجينات مع بعضها البعض، ربما يكون من الممكن التفكير في الجينات التي تتبادل مضيفات السيتوبلازم لنفسها. تعتبر التربة مكانًا مناسبًا للبكتيريا لاكتساب جينات جاهزة لأنفسها، لأنها تصيب العديد من أنواع البكتيريا. مكان جيد آخر هو أمعائنا، والتي تنتشر فيها أيضًا أنواع مختلفة من البكتيريا بأعداد كبيرة.
الثقافات البكتيرية المأخوذة من سطح الأنف.

وهناك ملاحظة مثيرة للدهشة: في بعض الحالات، يؤدي تعرض البكتيريا للمضاد الحيوي إلى زيادة ميلها إلى الارتباط بالشركاء وتبادل البلازميدات، والتي تتضمن أحيانًا جينات تمنح مقاومة لهذا المضاد الحيوي نفسه، و/أو للمضادات الحيوية الأخرى.
وربما تكون الفرضية أكثر إثارة للدهشة: فمنذ أكثر من عشرين عاما، اعتقد الباحثون أن أحد المصادر المحتملة المهمة للجينات التي تمنح المقاومة هي البكتيريا التي تنتج مواد المضادات الحيوية بنفسها. اتضح أن العديد من الشركات المصنعة للمواد المضادة للمضادات الحيوية لديها إنزيمات تحيد منتجاتها كيميائيًا - وهذا يمنع البكتيريا المنتجة من "الانتحار" بمنتجاتها الخاصة. في الواقع، عندما قارنوا المادة الوراثية للبكتيريا المنتجة للمضادات الحيوية والسلالات المسببة للأمراض المقاومة التي تغزو المستشفيات، تم العثور على تطابق، مما يشير إلى أن البكتيريا المسببة للأمراض اكتسبت خصائص مقاومة مستمدة من البكتيريا المنتجة للمضادات الحيوية. أحد الاستنتاجات التي يمكن استخلاصها من هذا - استنتاج ينتمي فعليًا إلى الفصل التالي: من الأفضل محاولة إنتاج مضاد حيوي صناعي، ليس له مثيل في الطبيعة، لأنه لا يوجد منتج طبيعي ولا يوجد مصدر. من انتشار المقاومة.
الاستنتاج الآخر هو أنه إذا تم اكتشاف المقاومة في بعض أنواع البكتيريا، فمن المتوقع أنه في غضون بعض الوقت سوف تنتشر أيضًا إلى أنواع أخرى من البكتيريا. وفي هذا الصدد: تبين أن حوالي 20 بالمائة من جميع المكورات المعوية (البكتيريا المعوية) التي تصيب المستشفيات مقاومة للفانكومايسين. ومن هنا يأتي الخوف الكبير - بل واليقين المرير في واقع الأمر - من أن هذه المقاومة ستصل في النهاية إلى المكورات العنقودية الذهبية - وهي عدوة المرضى في المستشفيات، والتي تقاوم سلالاتها حاليًا جميع أنواع المضادات الحيوية باستثناء الفانكومايسين. وعندما يحدث ذلك، سيكون الطب في ورطة كبيرة.
استياء الخبراء وضرع البقرة ومستقبل الطب
"إذا تناولت جرعة زائدة من دواء ارتفاع ضغط الدم لمريضي، فهناك خوف كبير من أن أؤذيه، ولكن لن أؤذي المرضى الآخرين بأي حال من الأحوال. ومن ناحية أخرى، إذا بالغت في جرعة المضاد الحيوي، فإنني أجعله أقل فعالية لجميع المرضى الذين يحتاجون إليه." هكذا يقول فرانك رام، مدير وحدة مكافحة العدوى في مستشفى جامعة مينيسوتا بالولايات المتحدة، مشيراً إلى مفارقة ومعضلة. والواقع أن استخدام المضادات الحيوية سلاح ذو حدين. لكن ادعاءات الخبراء واستيائهم لا موجهة فقط إلى الأطباء الذين يصفون المضادات الحيوية بشكل مفرط، بل وأيضاً إلى "الشرهين للمضادات الحيوية" - وهم في الأساس غالبية السكان. الطبيب العاقل، الذي يحاول إقناع مريضه بأن التهاب الحلق سببه عدوى فيروسية ولا فائدة ولا حاجة للمضادات الحيوية، غالبا ما يكتشف أن المريض سيفضل طبيبا أكثر "كرما" منه في المستقبل...
لكن خطايا الأطباء والمرضى تبطل في ستين (وعلى وجه الدقة - في ثلاثين) فيما يتعلق بمثلث المزارع والطبيب البيطري والبقرة. تتلقى حيوانات المزرعة مضادات حيوية أكثر بـ 30 مرة من البشر. في الولايات المتحدة تسمح السلطات الصحية بوجود 80! أنواع مختلفة من المضادات الحيوية الموجودة في الحليب (وإن كانت بتركيزات منخفضة). وهي تستخدم أساسا لمنع الالتهابات في ضروع الأبقار. وهذا يعني أنه عند شرب كوب من الحليب، تدخل مواد المضادات الحيوية إلى أجسامنا. وقد ثبت أنه حتى التركيزات المنخفضة المسموح بها حسب المعيار الأمريكي تزيد من معدل ظهور البكتيريا المقاومة بمقدار ستة إلى 72 مرة.
ولذلك يحتج الخبراء ضد الإفراط في استخدام المضادات الحيوية، سواء من قبل البشر أو من قبل الاقتصاد الزراعي. ولكن يجب أن نتذكر أن أي استخدام، حتى الأكثر مسؤولية، يؤدي في النهاية إلى ظهور سلالات مقاومة. لذلك، في كل الأحوال، من المهم الترويج لشر المقاومة. إحدى الطرق هي المثابرة في "سباق التسلح" - لمواصلة تطوير أدوية جديدة لكسب الوقت، حتى تظهر المقاومة لها. اتضح أنه حتى منتصف الثمانينيات، كان هناك دائمًا عقار مضاد حيوي جديد يلوح في الأفق في انتظار الموافقة على استخدامه، في حين أن شركات الأدوية الآن لم تعد تبذل أي جهد. وحتى من "النوافذ الأعلى" للحكومة، لم يعد هناك ما يكفي من الأموال "المتدفقة" لتشجيع أبحاث المقاومة والمساعدة في تطوير أدوية المضادات الحيوية الجديدة. ومن المناسب استثمار جهد خاص في تطوير المضادات الحيوية الاصطناعية، والتي لا يوجد لها أصلاً مصدر في الطبيعة لنشر المقاومة - وهي نفس البكتيريا التي تنتج المضادات الحيوية الطبيعية.
أحد الأساليب للتعامل مع مشكلة الإنزيمات التي تمنح المقاومة هو استخدام مثبطات تلك الإنزيمات التي تحطم المضادات الحيوية. أثمر هذا النهج في مجموعة الإنزيمات المهينة للبنسلين - حيث تم العثور على مثبط يرتبط بها ويحيد نشاطها. يتم تسويق الحبوب التي تحتوي على البنسلين بالإضافة إلى المادة المثبطة في الصيدليات، وهي خطوة أخرى في سباق التسلح. لكن العدو كان لديه بالفعل الوقت للرد: فقد ظهرت بالفعل سلالات من البكتيريا التي لا تقاوم عقار المضاد الحيوي فحسب، بل أيضًا للمثبط المضاف...
وهذا بلا شك عمل مرهق ومكلف وخطير، ويحتاج إلى كل مساعدة. ومن المهم التقليل من استخدام المضادات الحيوية إلى الحد الأدنى، وفي نفس الوقت الحرص الشديد على التطهير والتعقيم، وذلك لتقليل خطر نقل البكتيريا المسببة للأمراض، خاصة في المستشفيات. وربما يكون من المناسب أيضًا تقليل محيط الخصر ومحاولة إنشاء مكونات لقاح ضد البكتيريا المسببة للمشاكل بشكل خاص.
ينبغي للمرء أيضًا التفكير في اتخاذ تدابير متطورة لتحديث فعالية أدوية المضادات الحيوية. على سبيل المثال، فقدت التتراسيكلين الكثير من بريقها بسبب ظهور المقاومة في العديد من الأنواع البكتيرية المعروفة سابقًا بحساسيتها للتتراسيكلين. في كثير من الحالات، ترجع هذه المقاومة إلى آلية فعالة لغسل التتراسيكلين من البكتيريا. وتجري الآن دراسات لإيجاد جزيء يحجب البروتين الذي يعمل كمضخة تزيل التتراسيكلين، وبالتالي يعيد التتراسيكلين إلى توهجه.
الدواء الأكثر أهمية اليوم ضد بكتيريا السل هو الأيزونازيد. وهنا ظهرت في السنوات الأخيرة أصناف مقاومة. يقوم ويليام جاكوبس وزملاؤه من كلية ألبرت أينشتاين للطب في الولايات المتحدة بإجراء أبحاث مكثفة للوصول إلى جذور المشكلة. ويأمل الباحثون أن يساعد الفهم الشامل لآلية المقاومة في إيجاد طريقة فعالة لتحييدها، وبالتالي تجديد فعالية دواء السل، وهو مرض خطير يقتل ببطء. هل سيتبعهم باحثو مقاومة المضادات الحيوية؟
يبدو أن الطب اليوم يقف على مفترق طرق في التاريخ المجيد لأدوية المضادات الحيوية، التي أفادت البشرية في الماضي: طريق واحد يؤدي إلى زخم جديد، والطريق الآخر - الاستسلام للمقاومة والانحطاط. إذا كان الأمر كذلك، فربما لا تكون "نهاية المضادات الحيوية"، كما جاء في مجلة "نيوزويك"، ولكن "المضادات الحيوية - أين؟"
الإطار: الجدار الذي يحيط بالبكتيريا كما هو الحال في أي خلية، يتم أيضًا تغليف سيتوبلازم الخلية البكتيرية بغشاء خلية رقيق (غشاء)، والذي يتميز بنفاذية انتقائية. ولكن على عكس خلايا الحيوانات، فإن غشاء الخلية البكتيرية محمي بالجدار الذي يحيط به من الخارج. يتمتع جدار الخلية بقوة ميكانيكية كبيرة، مما يمنع تمزق الغشاء وانفجار الخلية البكتيرية بسبب الاختراق الأسموزي للمياه الزائدة. ويعرف أيضًا جدار وقائي من الخلايا النباتية، لكن التركيب الكيميائي لجدار الخلية النباتية يختلف تمامًا عن التركيب الكيميائي لجدار الخلية البكتيرية. عادةً ما يؤدي الضرر الذي يلحق بسلامة الجدار إلى اختراق الماء والانفجار الأسموزي للبكتيريا. جدار الخلية، على الرغم من تفوقه في القوة الميكانيكية الكبيرة، مسامي، لذلك لا يشكل حاجزًا أمام مرور الجزيئات الصغيرة، مثل الأدوية.
يتم فرز البكتيريا وفقًا لكيفية صبغها باستخدام طريقة الصبغ المعروفة باسم "تلطيخ جرام". بعض البكتيريا مصبوغة باللون الأرجواني ولا يمكن غسلها، ولذلك تسمى "موجبة الجرام"، وبعضها يفقد لونه عند غسلها، وتسمى "سلبية الجرام". تشير هذه الاختلافات في اللون إلى اختلافات في الميزات، كما سيتم مناقشته أدناه.
في البكتيريا سالبة الجرام، يتم تغليف الجدار من الخارج بطبقة تشبه غشاء الخلية. هذا الغشاء الخارجي -المشابه لغشاء الخلية- ذو نفاذية انتقائية، بحيث تجد العديد من المواد، بما في ذلك الأدوية، صعوبة في الوصول إلى جدار البكتيريا سالبة الجرام، بينما طريقها إلى جدار الخلية في البكتيريا إيجابية الجرام (التي تفتقر إلى غشاء خارجي) الغشاء) مفتوح. داخل الغشاء الخارجي، وهو غير منفذ نسبيا، يتم ترتيب البروتينات
الخاصة، والتي تخلق ما يشبه القنوات (المسام؟) (المسام = قناة) التي تسهل مرور المواد القابلة للذوبان في الماء. هناك فرق آخر بين البكتيريا إيجابية الجرام وسالبة الجرام يتمثل في سمك الجدار: سميك نسبيًا في البكتيريا إيجابية الجرام، وقليل نسبيًا في البكتيريا سالبة الجرام.
تسفي أتزمون، متخصص في علم الأحياء العصبي. يقوم بتدريس علوم الحياة في كلية ديفيد يلين. شغل منصب محرر مجلة "لادات" وكمحرر أول في نظام مدى.

תגובה אחת
الشركة التي أملكها تعمل في مجال التسويق والاستشارات في مجال البروبيوتيك والمكملات الغذائية البريبايوتيك للشركات الخاصة.نقدم الدعم المهني لدجاجة واحدة على أساس خصائص نموها. باعتباري اختصاصي تغذية في البوسنة والهرسك، وجدت الكثير من الاهتمام بالمقال، ويسعدني مناقشة موضوع استخدام بكتيريا البروبيوتيك، في الوقاية من الأمراض في البوسنة والهرسك. شكرا