وركز الباحثون، بقيادة البروفيسور دان فار من جامعة تل أبيب، على أمراض الأمعاء الالتهابية المزمنة، وطوروا ناقلًا نانومتريًا مستهدفًا يحمل إلى الخلايا المريضة المادة الوراثية (mRNA) التي تسبب إنتاج البروتينات المضادة للالتهابات. كما يرى الباحثون أن المنصة ستكون فعالة في عدد من الأمراض الخطيرة مثل: السرطان، والالتهابات المزمنة، والأمراض الوراثية النادرة وغيرها. البروفيسور بار: نأمل أن يكون متاحًا أيضًا لعلاج البشر في غضون سنوات قليلة. يتم نشر المقال اليوم (الأحد) في مجلة Nature Communications
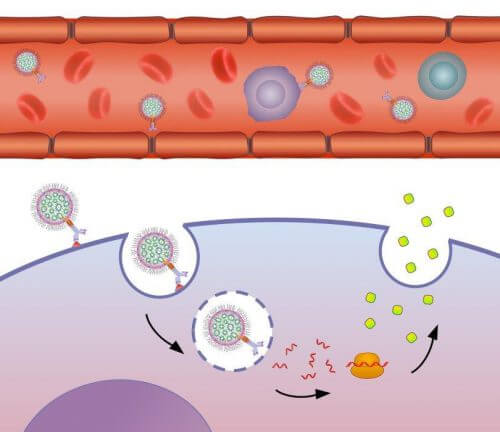
نجح الباحثون في مختبر البروفيسور دان بار، رئيس مركز أبحاث بيولوجيا السرطان في جامعة تل أبيب، في تطوير منصة لإطلاق مواد وراثية تشجع على إنتاج بروتينات محددة تحارب الخلايا المستهدفة المريضة.
تتيح المنصة المبتكرة، المناسبة لمجموعة واسعة من الأمراض (بما في ذلك السرطان والالتهابات المزمنة والأمراض الوراثية النادرة)، إجراء علاج جيني دقيق في الخلايا المريضة، دون التأثير على الخلايا السليمة، أو بمعنى آخر، دون آثار جانبية - والتي يمكن وفي بعض الأحيان تسبب أضرارًا أكبر من المرض نفسه.
تم إجراء البحث الرائد، الذي ركز على الالتهابات المعوية المزمنة المرتبطة بالمناعة الذاتية، مثل داء كرون والتهاب القولون، تحت قيادة طالبة الدكتوراه نوفر فيجا، وبمساعدة باحثين آخرين في مختبر البروفيسور بار. يتم نشر المقال اليوم (الاثنين) في مجلة Nature Communications.
"العلاج الجيني هو تقنية طبية مبتكرة تستخدم المواد الوراثية لتحفيز إنتاج الجسم للبروتينات التي تحارب المرض، أو بدلا من ذلك، لقمع إنتاج البروتينات التي تدعمه"، يوضح نوفير فيجا. "إن التحدي الرئيسي، الذي لم يتم الرد عليه حتى الآن، هو توصيل المادة الوراثية بدقة وبشكل محدد - حصريًا إلى الخلايا المستهدفة المريضة، لأنه إذا وصلت أيضًا إلى الخلايا السليمة في البيئة، فإنها
قد يسبب آثار جانبية خطيرة. في مختبرنا، انخرطنا لبعض الوقت في تطوير منصة جديدة ومحددة للغاية، والتي ستوفر إجابة للمشكلة."

تم استخدام الأجسام المضادة كملاحين للوصول إلى الهدف
ولأغراض عملهم، استخدم الباحثون نماذج من الفئران المصابة بأمراض معوية مناعية ذاتية مزمنة، والتي تنتج عن زيادة النشاط الالتهابي للخلايا في الجهاز المناعي المعروفة باسم Ly6c. ومن أجل تخفيف وضبط نشاط خلايا الجهاز المناعي التي خرجت عن السيطرة، سعى الباحثون إلى إرسال مادة وراثية لها من نوع mRNA (messenger RNA)، والتي من شأنها تحفيز إنتاج بروتين مضاد للالتهابات فيها. يسمى إنترلوكين 10 (IL10).
من أجل إطلاق جزيئات mRNA التي تشفر IL10 بدقة، بحيث تصل على وجه التحديد إلى خلايا Ly6c فقط، وتمارس تأثيرها عليها، استخدم الباحثون ناقلات مبتكرة: يتم تعبئة جزيء mRNA المناسب داخل جزيئات نانومترية تعتمد على جزيئات دهنية، مرتبطة بـ الأجسام المضادة الخاصة بـ Ly6c، والتي تستهدف الهدف بدقة كبيرة.
يشرح نوفر فيجا: "الميزة الكبيرة للأجسام المضادة كملاحة للحاملات الصغيرة هي خصوصيتها العالية. الجسم المضاد هو بروتين ينتجه الجهاز المناعي من أجل التعرف على جزيء واحد محدد، ويستهدفه فقط. في نظامنا، ترتبط الأجسام المضادة بالجزيئات الحاملة للبضائع باستخدام بروتين وسيط قمنا بتطويره في دراسة سابقة." وكجزء من الدراسة الجديدة، تم حقن الناقلات الصغيرة في أجسام الفئران المريضة، وكانت النتائج واعدة: فقد انخفضت الأعراض الشديدة لأمراض الأمعاء الالتهابية بشكل كبير.
ويخلص البروفيسور بار إلى أن "المنصة التي طورناها مناسبة للعلاج الجيني لمجموعة كبيرة جدًا من الأمراض - من السرطان إلى أمراض الالتهابات والمناعة الذاتية والأمراض الوراثية النادرة - ومن هنا أهميتها". "وبواسطتها يمكن إرسال أي مادة وراثية إلى أي خلية في الجسم حسب اختيارنا، وبهذه الطريقة تمنع أو تشجع إنتاج بروتينات مختارة تؤثر على مسار المرض. في الواقع، الدراسة الحالية هي دراسة متابعة للأعمال السابقة، حيث أرسلنا مادة وراثية من نوع siRNA (إسكات الحمض النووي الريبي) إلى الخلايا المريضة، مما يؤدي إلى إسكات تعبيرات الجينات التي تدعم المرض. وفي دراسة نشرت الصيف الماضي، نجحنا في علاج الفئران المصابة بسرطان العقد الليمفاوية (سرطان الغدد الليمفاوية) بهذه الطريقة. واليوم نواصل البحث وتطوير الطريقة واستخداماتها، ونأمل أن تكون متاحة أيضًا لعلاج البشر في غضون سنوات قليلة".

تعليقات 5
لماذا يتعين عليك الانتظار سنوات عديدة حتى تصبح أجنحة مليئة بالمرضى الذين يموتون كل يوم؟
ماذا يعتمد هذا على قلة الميزانية ونقص KA؟ لماذا لا يسمع علماء الأحياء في إسرائيل ما يحدث ولماذا لا يتم الترويج للأدوية مثل التقدم؟ لقد حان الوقت لإيقاظ الجمهور. إذا كان هناك شيء مفقود، سنبذل قصارى جهدنا لرفع التحدي.
ومساعدة الناس العاجزين.
كيف ولماذا يدخل هذا الناقل إلى الخلية بعد الارتباط بالمستضد الموجود في الخلية؟
وسيكون جاهزًا للاستخدام في عام 2045. عندما عرف كل طفل كيف يحضر الدواء بنفسه في المنزل.
موقع يقوم بالعمل المقدس وينقذ الأرواح! أبطال، استمروا!!
شكرا!