يسمح نهج تجريبي جديد يجمع بين الكيمياء والبيولوجيا للعلماء بالتعمق في أعماق الحاكم الأعلى للجسم

بقلم كارل ديسروث، تم نشر المقال بموافقة مجلة ساينتفيك أمريكان إسرائيل وشبكة أورت إسرائيل 08.12.2016
- لن يتم الكشف عن آليات عمل الدماغ للعلماء إلا من خلال فحص دقيق للخلايا الفردية بالإضافة إلى مراجعة واسعة النطاق للعضو بأكمله.
- تفشل الطرق الروتينية للتصوير البصري في اختراق أنسجة المخ بسبب تشتت الضوء عند ملامسته للماء وبسبب وجود جزيئات الدهون في أغشية الخلايا.
- إن الطرق الجديدة التي تزيل الدهون وتستبدلها بمادة تثبت أجزاء الدماغ في مكانها توفر نافذة لإلقاء نظرة خاطفة على ما وراء الحواجز التقليدية التي تمنعنا من رؤية الأجزاء الداخلية من الدماغ.
- إن الطرق التي تثبت الأنسجة في الهيدروجيل، كما تسمى هذه الطرق، تسمح للباحثين بفحص أسلاك دوائر عصبية محددة تتحكم في سلوكيات مختلفة.
نظامنا العصبي يشبه النسيج، شبكة متشابكة من الخيوط. تمتد هذه الأسلاك، وهي ألياف رقيقة تسمى المحاور، من الخلايا العصبية وتحمل المعلومات الكهربائية إلى الخلايا العصبية الأخرى التي تستجيب للإشارات. المحاور التي يتم إرسالها عبر مسافات طويلة، مثل خيوط الشوكران في النسج، يتم نسجها في "خيوط النسيج" في الدماغ: محاور عصبية تلتف ذهابًا وإيابًا عبر مسافات قصيرة وتنقل الإشارات لإجراء العمليات الحسابية.
لفهم الأعمال الداخلية للدماغ، يحتاج العلماء إلى فك كيفية تنظيم هذا النسيج العصبي على مستوى المكونات الفردية، مثل المحاور الفردية. ولكن لفهم الدور الذي يلعبه المحور العصبي، نود أيضًا أن يكون لدينا منظور عام للدماغ بأكمله، دون تجاهل المحور المفرد الرقيق وسياقاته. لكن العقل ليس مسطحًا مثل القماش، كما أنه ليس شفافًا، لذلك، لتحقيق وجهة النظر هذه، هناك حاجة إلى أداة خاصة. ومع ذلك، فإن الدماغ معتم للضوء: جزيئات الدهون (الدهون) الموجودة في جميع أنحاء الدماغ، وخاصة في أغشية الخلايا، تشتت الضوء المرسل من أجهزة التصوير وتضعف بشكل كبير قدرتنا على النظر إلى ما وراء الطبقة الخارجية والأرق من الدماغ إلى أعماقه.
الآن، فتحت التكنولوجيا الجديدة آفاقًا جديدة ومثيرة لعلماء الأعصاب، مما خلق طريقة للنظر إلى الدماغ بأكمله لرؤية المسارات العصبية وتحديد الخصائص الجزيئية للألياف العصبية الفردية التي تعمل في جميع أنحاء الدماغ. تعتمد هذه الطريقة على كيمياء المواد الهلامية ذات الأساس المائي، أو الهلاميات المائيةوهي عبارة عن بوليمرات تشكل شبكة ثلاثية الأبعاد من المناطق المترابطة وتكون قادرة على احتواء الماء دون أن تذوب. تُستخدم هذه الطريقة لإنتاج سقالات داخلية ثلاثية الأبعاد داخل الأنسجة البيولوجية. في هذه العملية المكونة من ثلاث خطوات، يتم أولاً تحضير مادة هلامية شفافة في أدمغة حيوانات المختبر أو البشر بعد الوفاة. يرتبط الجل بالأجزاء الجزيئية الغنية بالمعلومات في الدماغ ويحميها، بما في ذلك البروتينات والأحماض النووية (DNA وRNA). بعد هذه الخطوة، تتم إزالة مكونات الأنسجة التي ليست ذات أهمية أو المعروفة بتشتت الضوء، مثل الدهون. وأخيرًا، يتم حقن علامات الفلورسنت أو علامات أخرى في بنية الدماغ بأكملها. يعد إدخال العلامات ممكنًا لأن الجل ليس شفافًا فحسب، بل مصمم أيضًا للسماح بالإدخال السريع للمواد الإضافية. يمكن للعلماء بعد ذلك تسليط الضوء على الدماغ من خلال الهيدروجيل الشفاف، وجعل العلامات تتوهج، ورؤية الجزيئات والألياف ذات الأهمية مباشرة بدقة عالية جدًا في جميع أنحاء الدماغ بأكمله.
هذه القدرة الجديدة على النظر إلى أعماق الحاكم الأعلى للجسد تؤدي إلى العديد من الأفكار. ويستخدم العلماء النهج الجديد لربط الشكل المادي والوظيفة السلوكية للمسارات العصبية المشاركة في النشاط والإدراك، من الحركة إلى الذاكرة. ساعدت هذه الطريقة أيضًا على فهم العمليات التي تساهم في تطور الأمراض والمتلازمات: مرض باركنسون والزهايمر والتصلب المتعدد والتوحد وإدمان المخدرات ومتلازمات القلق. حتى أننا ساعدنا في تأسيس شركة لاستكشاف تطبيقات أنسجة الهيدروجيل لتشخيص السرطان. يتم الآن تطبيق هذه الطريقة ليس فقط على الدماغ، بل أيضًا على مختلف أعضاء وأنسجة الجسم.
انظر بعيدًا، انظر شفافًا
إن إنشاء دماغ شفاف أمر معقد للغاية، حتى أن التطور، على مدى مئات الملايين من السنين، لم يحقق هذا الهدف في الحيوانات الكبيرة. يمكن أن توفر الشفافية العديد من الفوائد المهمة. في الواقع، في بعض الأنواع البيولوجية، تم تطوير درجة معينة من الشفافية أثناء التطور، مما يحسن تكيف هذه الحيوانات مع البيئة (على سبيل المثال، كتمويه للمجانين). لا يحتوي دم بعض الأسماك حتى على الهيموجلوبين، وهو البروتين المحمر الذي يعطي الدم لونه، وهي موجودة بالفعل بدون سائل الدم الموجود في معظم الفقاريات - وهذه هي الطريقة التي تحقق بها درجة من الشفافية. لكن حتى هذه الحيوانات تفشل في جعل جهازها العصبي المركزي شفافًا، على الرغم من الضغوط التطورية القوية. في الأسماك أو الجمبري الشفاف جزئيًا، يكون الجهاز العصبي مغلقًا جزئيًا على الأقل. قد يكون التطور قادرًا على الاستغناء حتى عن خلايا الدم الحمراء، ولكن يبدو أنه لا يوجد شيء يمنع الضوء من التحرك بحرية عبر دماغ حي كبير.
ترجع العتامة للضوء إلى حقيقة أن الضوء منتشر في الأنسجة العصبية. تنعكس الفوتونات من الأسطح الملامسة بين الدهون والماء (بسبب الاختلافات في السرعة التي ينتقل بها الضوء في هاتين المادتين) وفي اتجاهات تبدو عشوائية (بسبب التعقيد الهيكلي للأسلاك العصبية). ولا يمكن للتطور القضاء على هذه الظاهرة بسهولة. لا تعمل الحواجز الدهنية كأغشية للخلايا أو الهياكل الداخلية في الدماغ فحسب، بل تلعب أيضًا دورًا رئيسيًا كمواد عازلة كهربائيًا، مما يمنع تسرب الأيونات التي تنقل الإشارات الكهربائية على طول المحاور المتعرجة. ومن المفارقات أن علماء الأحياء بحاجة إلى الحفاظ على سلامة الدماغ لفهمه، ولكنه أيضًا العضو الأكثر صعوبة في جعله شفافًا.
في عام 2009، قبلت التحدي المتمثل في جعل الدماغ الناضج كاملًا شفافًا مع السماح بوضع علامات تفصيلية على الجزيئات المختلفة داخله. في ذلك الوقت، كانت مئات المختبرات حول العالم قد بدأت بالفعل في استخدام التكنولوجيا التي طورناها أنا وزميلي في الفترة من 2004 إلى 2009، والتي تسمح لك بتنشيط أو إسكات دوائر عصبية معينة في الدماغ باستخدام الضوء. الطريقة، الآلة علم البصريات الوراثييجمع بين أشعة الليزر والألياف الضوئية والجينات المأخوذة من البكتيريا والطحالب التي تشفر بروتينات حساسة للضوء تسمى أوبسينز. تتيح هذه الطريقة التحكم بدقة في النشاط العصبي في خلايا معينة في دماغ الحيوانات أثناء الجري أو القفز أو السباحة أو التواصل أو القيام بحركات معقدة أخرى. في صيف عام 2009، بعد خمس سنوات من العرض التجريبي الأول لاستخدام الأوبسينات البكتيرية، والذي حدث في يوليو 2004، تم حل معظم التحديات التي تواجه علم البصريات الوراثي، وأصبح من الممكن تطبيق الطريقة بسهولة وعلى نطاق واسع. على الرغم من اكتشاف الآلاف من الأفكار الجديدة حول الآليات العصبية الكامنة وراء السلوك باستخدام هذه الطريقة، فإن علم البصريات الوراثي وحده لا يمكنه توفير نوع آخر من المعلومات الضرورية: صورة عالية الدقة تتيح فهم التوصيلات الممتدة على مستوى الدماغ للخلايا المفردة التي يتم تنشيطها بواسطة الضوء. .
يسعى كل مجال من مجالات العلوم إلى الربط بين نظرة عامة على النظام ومكوناته الفردية، على الرغم من إهمال هذا الهدف في كثير من الأحيان (لأسباب مبررة). إن فصل مكونات نظام معقد لدراستها بشكل منفصل كان دائمًا أمرًا ضروريًا للعلم، لأن إزالة مكون من السياقات التي تؤثر عليه يسمح لنا بتحديد أي من خصائصه ضرورية له ومستقلة عن المكونات الأخرى. لكن بالنسبة لبنية مثل الدماغ التي تتمتع بترابطات غنية، فإن تحليل النظام إلى عناصره، تمامًا مثل تفكيك الخيوط في النول، لا يمثل دائمًا أفضل استراتيجية لفهم النظام برمته.
لأغراض التصوير ووضع العلامات على المكونات، كانت الطبيعة المبهمة لأدمغة الثدييات الناضجة تتطلب دائمًا تشريح الدماغ، عادةً من خلال أقسام، بحيث أصبح في الواقع الهيكل ثلاثي الأبعاد مئات أو آلاف المقاطع ثنائية الأبعاد. تستهلك هذه العملية قدرًا هائلاً من الوقت والمال، خاصة عندما يُطلب من العديد من الأدمغة إنتاج نتيجة ذات دلالة إحصائية (كما هو الحال غالبًا عند دراسة سلوك الثدييات). علاوة على ذلك، يتم فقدان المعلومات الحيوية إلى الأبد. نظرًا لأنه بمساعدة علم البصريات الوراثي، أصبح من الممكن بالفعل استخدام جديد للدماغ بأكمله، فقد بدأت في عام 2009 أتساءل ما الذي يمكن بناؤه في الدماغ لمساعدتنا في حل مشكلة تشتت الضوء.
تم دفن جوهر الفكرة قبل 15 عامًا. في منتصف التسعينيات، أثارت فكرة محاولة بناء دوائر شبيهة بالدماغ في المختبر البدء بالخلايا المفردة. إحدى الطرق للقيام بذلك قد تكون من خلال زرع الخلايا الجذعية العصبية على سقالات بوليمرية، وهناك على هذه السقالات سيكون من الممكن بوسائل كيميائية حيوية حث الخلايا على أن تصبح خلايا عصبية. خلال هذه المحاولات، بحثت في الأدبيات العلمية والهندسية المتعلقة بالهلاميات المائية التي بدت ناجحة بشكل خاص كسقالات، كونها مناسبة للأنسجة البيولوجية وشفافة أيضًا.
في السنوات التي تلت ذلك، انتهى بي الأمر بإجراء تجارب أولية بسيطة حيث زرعت الخلايا على سقالات بوليمرية وحولتها إلى خلايا عصبية، لكنني لم أصل أبدًا إلى المرحلة التي خلقت فيها بنية كاملة تشبه الدماغ من خلايا مفردة - وهو أمر صعب للغاية مهمة. ومع ذلك، حرصت على حمل الملف المغبر، الذي كان مكتوبًا عليه "الهلاميات المائية" ويحتوي على صفحات مدبسة بإحكام، معي أثناء انتقالي من مختبر إلى آخر على مدار الخمسة عشر عامًا التالية، ومن مرحلة إلى أخرى في مسيرتي المهنية (التلقي). حصلت على الدكتوراه في علم الأعصاب في عام 15، وأكملت إقامتي في الطب النفسي وما بعد الدكتوراه، وأطلقت مختبري الهندسي في جامعة ستانفورد في عام 1998). لكن أساسيات الخطة كانت في ذهني بالفعل، وترسخت الفكرة وتطورت في نهاية المطاف، بمساعدة بعض الأشخاص الموهوبين بشكل لا يصدق في المختبر، إلى استراتيجية عمل لبناء دماغ شفاف ويمكن الوصول إليه.
يصف الرسم الذي كتبته في فبراير 2010، بينما كنت جالسًا على مكتبي بعد فترة طويلة من التفكير في تصوير الدماغ بأكمله، الفكرة الأساسية [انظر الصورة]. كانت الفكرة بالفعل مبنية على المبدأ القديم المتمثل في بناء دماغ من خلايا مفردة، ولكن الابتكار كان يتمثل في تطبيقه في الاتجاه المعاكس: فبدلاً من البدء من هلام مائي وبناء دماغ داخله، خطر لي أن أبدأ من مادة هلامية. الدماغ بأكمله وبناء هيدروجيل بداخله. سيكون الهيدروجيل بمثابة هيكل داعم يحافظ على الموقع المكاني لمكونات الدماغ التي تهمنا، مثل البروتينات والأحماض النووية، ولكنه سيسمح بإزالة أي شيء آخر يمنعنا من رؤية أعماق الدماغ. في الوقت نفسه، سيمنع الهيدروجيل الدماغ من الانهيار إلى كتلة عديمة الشكل أثناء إذابة أو هضم المكونات الأقل إثارة للاهتمام.
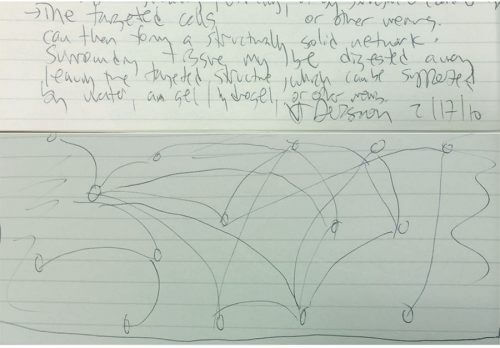
إن التجارب الأولى، التي ربطت مجالات علمية منفصلة وأعطت شكلاً مؤقتًا لما كان في السابق مجرد فكرة، لا يمكن تقييمها على النحو الأمثل على مر السنين إلا عندما يكون لدينا منظور كافٍ لفحصها. اثنان من الباحثين الشجعان والمبدعين الذين كانوا في المختبر في ذلك الوقت - فيفيانا جاردينيرو ومدير المختبر شارو راماكريشنان - كانوا أول من وافق على تولي هذا المشروع الصعب. كانت المخاطرة كبيرة جدًا لدرجة أنني قررت عدم إشراك المجموعة بأكملها. اعتقدت أن هذين الباحثين ذوي الخبرة (الذين حققوا بالفعل نجاحًا كبيرًا في مشاريع أخرى) سيكونان قادرين على التعامل مع المخاطر وخيبة الأمل في حالة الفشل.
في بداية عام 2010، بدأ جاردينارو وراماكريشنان في دراسة كيفية حماية الخلايا العصبية من المواد التي يمكن أن تدمر التفاصيل الهيكلية للأنسجة وأغشية الخلايا. من الناحية النظرية، فإن ملء الخلايا العصبية ببعض المواد البوليمرية المقاومة يمكن أن يوفر الحماية: يجب أن تظل الخلايا العصبية سليمة في دعم الهيدروجيل. جرب الاثنان عدة استراتيجيات، بما في ذلك إدخال جينات ترمز لبعض الإنزيمات التي تسمح للخلايا العصبية بإنتاج بوليمرات مقاومة مثل الكيتين أو السليلوز. وتبين أن أفضل طريقة، والتي نشأت من فكرة جاردينارو الإبداعية، هي إنتاج بوليمر بيولوجي آخر داخل الخلايا، كيراتين. وأظهرت أنه في الخلايا العصبية في الثقافة، يمكن للكيراتين أن يحمي بنية الخلية والقشرة في الدماغ بأكمله (عندما يتم تثبيت الخلايا العصبية بالكيراتين والهيدروجيل الذي يضيف دعمًا خارجيًا)، سيكون من الممكن غسل الدهون. مع المنظفات، والكشف عن هياكل الدماغ المطلوبة، والتي كانت مخبأة داخل هيدروجيل شفاف.
في ذلك الوقت، كان بناء هيدروجيل في الدماغ بأكمله مجرد فكرة. قررت تسريع المشروع بمساعدة مهندس كيميائي. على الرغم من أنه لم يكن أحد خارج المختبر على علم بالمشروع، فقد بحثت في بريدي الإلكتروني بحثًا عن طلبات من مرشحي ما بعد الدكتوراه الذين قد يكون لديهم خلفية مناسبة في الهلاميات المائية. وفي البحث اسم كوانغون تشينغ، وهو مهندس كيميائي بارع للغاية ثم عمل في معهد جورجيا للتكنولوجيا. سمع تشينغ عن عملنا في مجال علم البصريات الوراثي والخلايا الجذعية، وطلب الانضمام إلى المختبر.
في أوائل مارس 2010، بعد أسابيع قليلة من رسم الرسم التوضيحي الأصلي لفكرة الهيدروجيل، أجريت أول مكالمة هاتفية قصيرة مع تشينج بينما كنت في اجتماع في ولاية يوتا. ثم فعلت شيئًا لم أفعله من قبل (أو منذ ذلك الحين) لأنني كنت مقتنعًا جدًا بالاتجاه البحثي الجديد. لقد دعوت تشينغ للانضمام إلى المختبر دون زيارة المختبر أو حتى إجراء مقابلة وجهًا لوجه. أوقات غريبة بالنسبة لمختبر البيولوجيا العصبية: يظهر مهندس كيميائي فجأة.
عند وصوله، غاص تشنغ على الفور في المشروع السري. بحلول نهاية عام 2010، كان أعضاء المجموعة الثلاثة قد صنعوا مكعبات شفافة من دماغ الفأر في مختبري، حيث كان من الممكن أن نرى بوضوح، داخل الهيدروجيل، خلايا الدماغ المحفوظة بمساعدة الكيراتين، حتى على عمق مئات. من الميكرونات داخل الأنسجة، أعمق بكثير مما كان من الممكن الوصول إليه بالطرق الحالية [انظر الرسوم التوضيحية]. اعتمد أول هيدروجيل وظيفي أنتجها تشنغ على مادة الأكريلاميد، وغالبا ما تستخدم في المختبرات لفصل الأحماض النووية أو البروتينات. تم تصميم هذه الأنسجة الهلامية الهجينة حتى نتمكن من حقن علامات الفلورسنت وغيرها مباشرة لرؤية البروتينات والهياكل المحفوظة مثل المحاور. بعد عدد كبير من دورات وضع العلامات، اكتشفنا أننا لا نحتاج إلى الكيراتين على الإطلاق للحفاظ على مكونات الخلية في مكانها: فالهيدروجيل وحده كان كافيًا. على الرغم من العمل الرائد في الأساليب الأخرى التي قاموا بهاهانز أولريش دوت וأتسوشي مياواكي (طرق 3ديسكو و حجم على التوالي)، لم يتم تحقيق مثل هذه الشفافية وإمكانية الوصول في الدماغ الناضج للثدييات حتى الآن.
تسمح طرق الأنسجة المائية بالوصول إلى أعماق الدماغ، وتوفر نظرة ثاقبة لبيولوجيا الدماغ وأمراضه.
هذا الإصدار من أنسجة الهيدروجيل المعتمدة على مادة الأكريلاميد (يوجد حاليًا العديد من الإصدارات الأخرى المنشورة) كان يسمى CLARITY، وهو نوع من الاختصار لـ الاسم الكامل. منذ أن نشرنا هذه الطريقة في عام 2013، حتى هذه النسخة الفردية من الطريقة تم اعتمادها لمجموعة متنوعة من العلوم الأساسية وكذلك التطبيقات السريرية (على سبيل المثال، في فحص ما بعد الوفاة لأدمغة الأشخاص المصابين بالتوحد أو مرض الزهايمر)، وكذلك في الحبل الشوكي ودماغ الفئران (على سبيل المثال، لاكتشاف مسارات الخلايا العصبية التي تتحكم في سلوك الخوف والقلق التي لم تكن معروفة من قبل). لقد نشرت المختبرات في جميع أنحاء العالم بالفعل العديد من المقالات حول الدراسات التي استخدمت فيها هذه الطريقة لفهم البنية الأساسية للجهاز العصبي، غالبًا بالاشتراك مع علم البصريات الوراثي، وللتوصل إلى أفكار جديدة لفهم المسارات العصبية الطبيعية والمضطربة.
تمامًا كما طور العلماء خلال السنوات الخمس الأولى من استخدام طريقة علم البصريات الوراثي باستخدام الأوبسينات البكتيرية، مجموعة متنوعة من الابتكارات التي تتيح تطبيقات واسعة النطاق للطريقة، كذلك تقدمت طريقة بناء هيدروجيل داخل الدماغ بشكل كبير في السنوات الأولى بعد تطويرها. . على سبيل المثال، تضمنت النسخة الأولى من طريقة الهيدروجيل خطوة يقوم فيها المجال الكهربائي بتسريع عملية إزالة جزيئات المنظفات المشحونة المرتبطة بالدهون. تتطلب هذه الخطوة مهارة، وفي بعض الأحيان، إذا كان التوتر مرتفعًا جدًا، تتلف الأنسجة. تم حل المشكلة راجو تومر, بريان سفي וلي يي، الذين كانوا جميعًا في مختبري في ذلك الوقت، والذين نشروا في أوائل عام 2014 نسخة أبسط من هذه الخطوة في ورقتين بحثيتين (واحدة بالتعاون مع زملاء من السويد). ومنذ ذلك الحين أصبحت هذه الطريقة تُعرف باسم الوضوح السلبي، لأنها لا تتضمن المجالات الكهربائية. كما وصف تومر والمجموعة طريقة خاصة لتصوير الدماغ بالهيدروجيل تستخدم شكلاً سريعًا وعالي الدقة من الفحص المجهري يسمى المجهر السطحي الضوئي، والذي تم تكييفه لمواجهة التحدي المتمثل في تصوير كميات كبيرة من الهلام بسرعة عن طريق مسح الأسطح بدلاً من البقع الضوئية.
في ذلك الوقت، كان كل من جاردينيرو وتشينغ يرأسان بالفعل مختبرات ناجحة خاصة بهما (في معهد كاليفورنيا للتكنولوجيا ومعهد ماساتشوستس للتكنولوجيا، على التوالي)، وأنتج كل منهما ابتكارات مهمة. وسرعان ما جاءت تطورات أخرى من العديد من الباحثين الآخرين أيضًا. قام جاردينيرو بشكل مستقل بتطوير ونشر استراتيجية CLARITY للكائن الحي بالكامل والتي تحمل اسم PARS. قام جاردينيرو وتشينج بشكل منفصل بنشر تركيبات هيدروجيل جديدة تسمى PACT وSWITCH على التوالي، والآن قامت المختبرات حول العالم بوصف مجموعة واسعة من تركيبات أنسجة الهيدروجيل. ولكن حتى الآن لم نبدأ إلا في خدش سطح المجال التجريبي لاستكشاف الهلاميات المائية المحتملة. في عام 2013، قمت أنا وتشينغ بنشر قائمة طويلة جدًا من تركيبات الهيدروجيل المحتملة، مأكريلات ועד elgitnates وأبعد من ذلك. في مختبراتي ومختبرات زملائي، نبحث حاليًا عن طرق لجعل البوليمرات أكثر نشاطًا، على سبيل المثال إدخال عناصر كيميائية من شأنها أن تسبب توصيلًا كهربائيًا قابلاً للتعديل أو تفاعلًا كيميائيًا، وهي خصائص ستفتح إمكانيات جديدة لنا.
هناك تحدٍ آخر يركز على خصائص اتحادات أنسجة الهلام المائي، والتي، كما وصفناها في مقالاتنا لعامي 2013 و2014، تتسبب في تمدد الأنسجة داخل الهلام المائي بشكل كبير. لا تشكل هذه الظاهرة صعوبة في جميع الحالات ولا تتعارض مع التصوير عالي الدقة، لا مع طريقة CLARITY الأصلية ولا مع الطرق اللاحقة (PACT/ePACT في عام 2014، ثم ExM/proExM وMAP في عامي 2015 و2016) التي طورتها مجموعات أخرى تسبب أيضًا تورم الأنسجة. ولكن لكي نتمكن من مقارنة الأدمغة الشفافة التي أنشأناها والأطالس الأكاديمية للدماغ، من الضروري الحفاظ على الأنسجة الأصلية بدقة. لذلك، قمنا بتطوير خطوة نهائية محتملة لتقليص الأنسجة إلى حجمها الأصلي.
بمساعدة منها وعضو آخر في الفريق، ويل ألين، طورت مختبرًا ونشرت برنامجًا سريعًا وتلقائيًا لتصور وتحليل البيانات يمكن تنزيله واستخدامه مجانًا. مجموعة زميلي، مارك تاسيا لافين، الذي كان آنذاك في جامعة روكفلر والآن رئيس جامعة ستانفورد، فعل ذلك من أجل طريقةiDISCO التي طورتها. تم نشر هاتين المقالتين التكميليتين وفي نفس العدد من مجلة الخلية في يونيو 2016. مجموعتي وفيها إميلي سيلفستريك, بريا راجاستوباثي וماثيو رايت، تمكنت أيضًا من تمكين الاستخدام الموثوق به لنوع مهم بشكل خاص من العلامات المتزامنة لعدد كبير من جزيئات الحمض النووي الريبي (RNA) في الدماغ بأكمله من خلال استخدام نوع مختلف من الهيدروجيل، كما ذكرنا في مقال سابق الذي أصبح مشهورا في الخلية في مارس 20166.
"بعد إنشاء دماغ شفاف، يمكن لمجموعتنا أن تنظر إلى منطقة تسمى القشرة الجبهية وترى كيف يتم توصيل مجموعات الخلايا التي تتوسط التجارب الإيجابية أو السلبية بشكل مختلف."
أصبحت القدرة على تسمية عدة أنواع من الجزيئات، بما في ذلك الأحماض النووية مثل الحمض النووي الريبي (RNA)، ميزة فريدة لنهج الهيدروجيل وتفتح إمكانيات واسعة لدراسة التعبير الجيني. وبعد حل كل هذه التحديات، والكثير منها فقط هذا العام، نضجت الطريقة ووصلت إلى مرحلة تطبيقها في العديد من المختبرات حول العالم.
ربط النهايات
إنه لأمر مدهش أن ننظر إلى الوراء ونقارن الفيديو المتواضع من عام 2010 والتنفيذ الكامل الوظائف، بعد ست سنوات فقط. كان الهدف المهم في تقدم رؤية الهيدروجيل هو ربط الطريقتين: علم البصريات الوراثي للدماغ بأكمله والحصول على المعلومات الهيكلية للدماغ بأكمله. وقد تحقق هذا الهدف ونشر في عدة مقالات منها في مقال يونيو 2016 في الخلية. ركز البحث الموصوف في هذه المقالة على قشرة الفص الجبهي، وهي المنطقة المسؤولة عن تنظيم العمليات المعرفية والعواطف المعقدة. ويأمل العلماء أن فهم كيفية تحكم هذه البنية في مجموعة واسعة من السلوكيات يمكن أن يوفر نظرة ثاقبة للحالات النفسية مثل التوحد والفصام.
أعضاء مجموعتي، يه وآلان وكيم طومسون، بالتعاون مع زملاء من مختبرات أخرى، بما في ذلك مختبرات ليكون منخفض וجنيفر ماكناباستخدم وزملاؤه في جامعة ستانفورد علم البصريات الوراثي لأول مرة لتحديد مجموعة من الخلايا في قشرة الفص الجبهي التي تنشط أثناء التجارب المجزية، مثل الطعام اللذيذ بشكل خاص أو حتى الكوكايين (وتتحكم أيضًا في الاستجابة السلوكية المناسبة). اكتشفنا بعد ذلك مجموعة تكميلية من الخلايا في قشرة الفص الجبهي التي تنشط أثناء التجارب السلبية (غير السارة). وأخيرًا، باستخدام أحدث أساليب الهيدروجيل لدينا، تمكنا من إظهار أن هاتين الخليتين مرتبطتان بشكل مختلف في جميع أنحاء الدماغ. ترسل الخلايا المرتبطة بالأشياء الإيجابية امتدادات بشكل رئيسي إلى منطقة عميقة في الدماغ تسمى النواة المتكئة [انظر الشكل]، بينما الخلايا المرتبطة بالأشياء السلبية متصلة بمنطقة أخرى عميقة تسمى الوريد جانبي. وبهذه الطريقة، تسمح مناهج الهيدروجيل وعلم الوراثة الضوئية للعلماء بدراسة الأنسجة البيولوجية في حالتها الطبيعية بطرق تسلسلية لم تكن ممكنة من قبل، مما يعزز فهم البيولوجيا الأساسية والصحة والمرض.
وظهر التقدير الكامل للأنظمة المعقدة في نفس الوقت الذي ظهرت فيه القدرة على تبادل المعلومات على نطاق محلي وعلى نطاق واسع، سواء كان ذلك الدماغ بأكمله أو الأنسجة المعقدة الأخرى. في علم الأعصاب، أصبح من الممكن الآن جمع كميات هائلة من المعلومات، بما في ذلك التفاصيل الغنية والمتنوعة التي تضيء بنية الدماغ بأكمله ومكوناته الجزيئية ونشاط الخلايا. ونتيجة لذلك، نبدأ في تكوين رؤية واسعة ومفصلة للدماغ.
ومن الصعب والنادر التوصل إلى وجهة نظر واسعة كهذه تتضمن أيضاً حلاً محلياً، ولكن من المهم الاستجابة لهذا التحدي. غالبًا ما تنشأ خصائص الأنظمة المعقدة من تفاعلات محلية، مثل الخيوط المتشابكة للنسيج، ومثل العملية العلمية نفسها. فقط بمساعدة منظور شامل يمكننا أن نفهم الدور الذي يلعبه كل خيط في القماش.
