البحث المنشور في PNAS - مجلة الأكاديمية الوطنية للعلوم في الولايات المتحدة - ترأسه البروفيسور رعوت شيلجي وزميلا البحث نيف سابات وفالونيا ليفي آدم وطالبة الدكتوراه أمل يونس من كلية الطب في رابابورت.

يقدم باحثو التخنيون نتائج جديدة تتعلق بالضرر التدريجي لنظام التحكم في البروتين خلال فترة الشيخوخة. الدراسة نشرت فيPNAS - مجلة الأكاديمية الوطنية للعلوم في الولايات المتحدة - بقيادة البروفيسور رعوت شيلجي والزملاء الباحثين نيف سابات وفالونيا ليفي آدم وطالبة الدكتوراه أمل يونس من كلية الطب في رابابورت.
ركز البحث على نظام تحكم أساسي يحمي الخلية من تراكم البروتينات المضطربة؛ عند تلف هذا النظام، تتراكم ترسبات من هذه البروتينات في الخلية، وهذا التراكم له تأثير سام، خاصة عندما يحدث في الدماغ.
تعتبر البروتينات شركاء فاعلين في جميع الأحداث البيولوجية داخل الخلية وخارجها، وتعتمد وظيفتها على نجاحها في الانطواء إلى بنية محددة ثلاثية الأبعاد تتيح لها التفاعلات المناسبة مع المكونات الأخرى في الخلية.
في كثير من الحالات، تكون البروتينات غير مطوية بشكل خاطئ، الأمر الذي لا يمنعها من أداء دورها فحسب، بل يجعلها أيضًا "لزجة" وتتراكم في الخلية لتشكل رواسب سامة. قد يؤدي هذا الترسب إلى إتلاف الخلايا بشكل عام وخلايا الدماغ بشكل خاص في العملية التي تدخل في تطورها الأمراض التنكسية العصبية بما في ذلك مرض الزهايمر، ومرض باركنسون، والتصلب الجانبي الضموري، ومرض هنتنغتون.
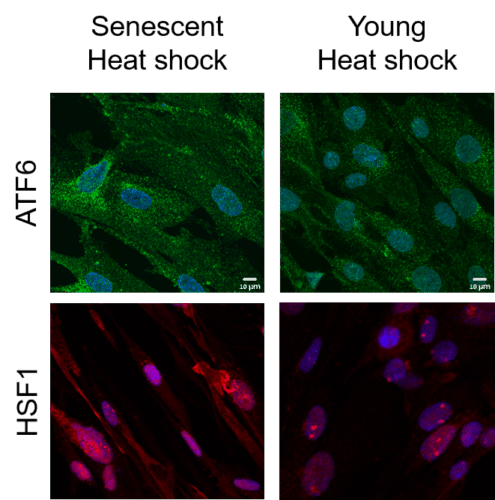
وبما أن تكوين البروتينات المضطربة هو حدث شائع، فقد تم تطوير آلية تحكم خلوية أثناء التطور تقوم بفحص جودة البروتين من لحظة تكوينه في الريبوسوم حتى وفاته. هذه الآلية، التي تسمى الثبات البروتيني، تحدد موقع البروتينات المضطربة وتعالجها بإحدى الطرق الثلاث: إعادة طيها بالطريقة المرغوبة؛ عزلها وتحييدها بما لا يؤثر على نشاط الخلية؛ أو أنها تسبب البروتيزوم، سلة المهملات الخلوية. تعمل هذه الآلية على التأكد من معالجة البروتينات المختلة، والتي تتشكل أيضًا في الشخص السليم، وعدم تراكمها في نفس الترسبات السامة التي تؤدي إلى تكوين أمراض التنكس العصبي في الدماغ. ومع ذلك، فإن عملية الشيخوخة تنطوي على إضعاف آلية الثبات البروتيني. هذا الضعف، الذي ظهر سابقًا في الديدان (الديدان الخيطية)، يظهر الآن لأول مرة في الخلايا البشرية الهرمة. ويتم ذلك من خلال توصيف النسخ ومعالجة الحمض النووي الريبي (RNA) وتخليق البروتين باستخدام أدوات على مستوى الجينوم.
في المقال المعني، يعرض باحثو التخنيون الظاهرة المذكورة أعلاه في سياق الإجهاد الحراري. لقد أظهروا أنه على عكس الخلايا الشابة والصحية، فإن الاستجابة لصدمة الحرارة في الخلايا القديمة غير كافية، ويرجع ذلك إلى تدهور آلية تثبيت البروتينات. وعلى النقيض من الخلايا الشابة، فإن الخلايا القديمة تشعر بالإجهاد ولكنها تفشل في تنشيط الاستجابة النسخية التكيفية اللازمة للتغلب على الإجهاد بشكل كامل. كما وجد الباحثون أن نشاط البروتيزوم، "سلة القمامة الخلوية"، تدهور في الخلايا القديمة ولم تعد إلى نفسها حتى بعد إعطائها الوقت الكافي للتعافي من الصدمة.
حصل البروفيسور ريعوت شيلجي على درجة البكالوريوس في علم الأحياء وعلوم الكمبيوتر في جامعة تل أبيب ودرجة الماجستير والدرجة الثالثة في أبحاث التعبير الجيني في معهد وايزمان. وفي أكتوبر 2014، بعد حصولها على درجة ما بعد الدكتوراه في معهد ماساتشوستس للتكنولوجيا، انضمت إلى هيئة التدريس في كلية الطب في رابابورت. وهي اليوم ترأس مختبرًا يجمع بين البيولوجيا الحاسوبية والبيولوجيا الجزيئية، وهي عضو في معهد رابابورت ومركز الأمير لدراسة أمراض التنكس العصبي.
للمقال فيPNAS انقر هنا

תגובה אחת
الشرح تحت الصور حيرك .