يقوم علماء المعهد بتحديث نسخة من أحد الرسوم البيانية الأكثر كلاسيكية في كتب الكيمياء الحيوية - دائرة كريبس
في الحقل المحروث، من الصعب بشكل مضاعف تحديد ثلم جديد. إن دائرة كريبس، أو دائرة حمض الستريك كما نسميها في فصول علم الأحياء في المدرسة الثانوية، هي بلا شك مثال على الأراضي المحروثة جيدًا: في وقت مبكر من عام 1953، مُنحت جائزة نوبل إلى هانز كريبس، عالم الكيمياء الحيوية الألماني اليهودي الذي اكتشف ومنذ ذلك الحين تمت إضافة العديد من الأسهم إلى الرسم البياني الأيقوني الذي يصور لحظة حاسمة في تطور الحياة على الأرض: الانتقال إلى إنتاج الطاقة المعتمدة على الأكسجين. لذلك، عندما قامت الدكتورة ليا هاينمان يروشالمي من مختبر البروفيسور. إيلي سيلتزر في معهد وايزمان للعلوم اكتشف ونظرًا لوجود مجال لتحديث المخطط، فقد تفاجأت بقوة الاكتشاف: "تزين دائرة كريبس كل كتاب مدرسي للكيمياء الحيوية، كما أن القدرة على إضافة سهم جديد إلى مثل هذا المخطط الكلاسيكي أمر مثير للغاية."
ولكن للوصول إلى جوهر الاكتشاف الجديد، يجب على المرء أولاً العودة إلى الوراء. سنوات عديدة مضت. أنتجت المخلوقات الأولى على وجه الأرض الطاقة من خلال عملية تحلل السكر المعروفة باسم تحلل السكر. هذا المسار الأيضي القديم لا يعتمد على الأكسجين على الإطلاق، وهو ما يميز الكائنات الحية حتى يومنا هذا - من البكتيريا إلى البشر. ومع ذلك، طوال التطور، ومع تحسين الحياة على الأرض، تطور أيضًا المسار الأيضي لدورة كريبس، مما يسمح بإنتاج كمية أكبر من الطاقة وبالتالي دعم تطور ووجود حياة بيولوجية معقدة. ومع ذلك، حتى بعد دخول دورة كريبس في اللعبة التطورية، يظل تحلل السكر دورًا بيولوجيًا حاسمًا: فالقدرة على التبديل بين المسارات الأيضية عند الضرورة تسمح للخلايا بالتعامل مع الظروف البيئية المختلفة دون الخروج عن التوازن والتوازن. علاوة على ذلك، تحتاج بعض أنسجة الجسم أو العمليات التنموية إلى ظروف منخفضة الأكسجين لتعمل بشكل سليم، وبالتالي تعتمد في المقام الأول على تحلل السكر.
في مختبر البروفيسور سيلتزر في قسم الوراثة الجزيئية، لا تتم دراسة المسارات الأيضية بشكل روتيني، بل يتم دراسة تطور العظام والجهاز الهيكلي. ولذلك، فإن اهتمامهم الأولي بتكسير السكريات نشأ في سياق الخلايا الغضروفية - وهي أحد أنسجة الجسم التي تتطور في ظل ظروف نقص الأكسجين وتعتمد على إنتاج الطاقة من خلال تحلل السكر. وسعى فريق الباحثين بقيادة الدكتور ليطال بن توفيم، إلى فهم سبب "تخلي" الأنسجة الغضروفية عن إمداد الأكسجين والفوائد الحيوية الكامنة فيه - وكيف تخدمه ظروف انخفاض الأكسجين.
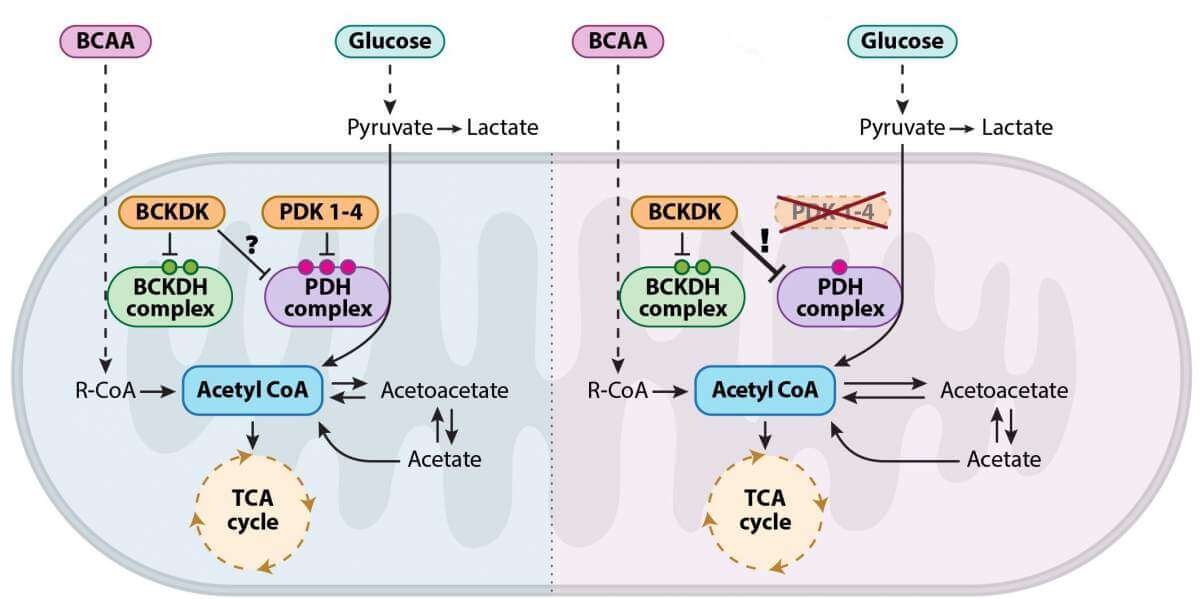
لفحص هذه الأسئلة، حاول الباحثون التدخل في عمليات التنفس الخلوي في أجنة الفئران، لإجبار خلاياها الغضروفية على إنتاج الطاقة من خلال دورة كريبس - ومعرفة ما سيحدث. ولتحقيق هذه الغاية، قاموا بتطوير نموذج وراثي لأجنة الفئران التي لا تستطيع التعبير عن بروتينات PDK - وهي عائلة من الإنزيمات المسؤولة عن تنظيم الانتقال بين المسارات الأيضية وانهيار السكر. ولم يتوقع أحد النتائج التي تم الحصول عليها: على الرغم من الغياب التام للأنزيمات التي تتحكم في عمليات التنفس الخلوي، تطورت الأجنة بشكل طبيعي تمامًا. وعندما تحقق الباحثون مما حدث بالفعل، رأوا أنه ليس من المستغرب أن تتطور الأجنة بشكل صحيح، فقد تم الحفاظ على التحكم في الانتقال بين المسارات حتى في غياب الإنزيمات التي كانت تعتبر حيوية ولا يمكن تعويضها حتى الآن.
على ما يبدو، فيما يتعلق بأبحاث الأنسجة الغضروفية، فقد وصلت الأبحاث إلى طريق مسدود. ومع ذلك، لم تستطع الدكتورة ليا هاينمان يروشالمي، التي كانت آنذاك طالبة أبحاث في مختبر البروفيسور سيلتزر، قبول النتائج المفاجئة وأصرت على الوصول إلى جذورها الأيضية. سمح هذا التحديد لفريق البحث باكتشاف آلية غير معروفة في منطقة مرسومة جيدًا: الباحثون مكشوف لأنه في دورة كريبس هناك خطة احتياطية غير معروفة تدخل حيز التنفيذ في غياب إنزيمات التحكم من عائلة PDK: أظهر الباحثون أن أحذية الإنزيمات المفقودة يتم استبدالها بإنزيم يسمى BCKDK، والذي ينشأ من آخر و مسار استقلابي منفصل على ما يبدو - أحد مسارات تحطيم البروتينات، أو بشكل أكثر تحديدًا، مسار تحطيم الأحماض الأمينية ذات السلسلة المتفرعة.
وبعيدًا عن العلوم الأساسية الرائدة، قد يكون لهذه النتائج تأثير على فهم وعلاج العديد من الأمراض التي يوجد فيها فشل أيضي. في السنوات العشرين الماضية، أظهرت العديد من الدراسات أن إنزيمات PDK لها دور في الإصابة بالسرطان، والأمراض الأيضية، مثل مرض السكري، والأمراض التنكسية العصبية، مثل مرض هنتنغتون. أدت هذه النتائج إلى تطوير العديد من الأدوية المختلفة المصممة لتثبيط نشاط هذه الإنزيمات، لكن استخدام هذه الأدوية محدود بسبب انخفاض كفاءتها وعدم وجود نموذج وراثي يسمح بإجراء فحص فسيولوجي شامل لعواقبها. ومن الممكن أن تقدم النتائج الجديدة تفسيرا لانخفاض فعالية الأدوية الموجودة وتفتح الباب أمام تطوير علاجات جديدة لهذه الأمراض.
المزيد عن الموضوع على موقع العلوم:
