إن اكتشاف قفل حلزوني غامض قد يلقي الضوء على تطور أمراض الدماغ التنكسية
البروتينات هي العمود الفقري للخلية التي تنفذ الغالبية العظمى من المهام الضرورية للحفاظ على صحتنا وكاملنا. ومع ذلك، يمكن للبروتينات التالفة أن تشكل تجمعات ضارة في الدماغ تشارك في مرض الزهايمر ومرض باركنسون وأمراض الدماغ التنكسية الأخرى. حتى وقت قريب، كان الاعتقاد السائد هو أنه بمجرد أن تتشكل هذه التجمعات، المعروفة باسم رواسب الأميلويد، فلن يكون هناك عودة إلى الوراء. ولكن اتضح أن التعاون بين عائلتين من البروتينات المصاحبة ("chaferons") يجعل من الممكن تحطيم الأميلويد والحفاظ على خلايا الجسم في حالة طبيعية.
وفي مقالتين منشورتين مؤخراً، أكد مختبر د رينا روزنزويج من قسم البيولوجيا الهيكلية، بالتعاون مع باحثين من جامعة هايدلبرغ ومركز أبحاث السرطان الألماني (DKFZ)، الآلية التي تقوم بها عائلتين البروتين بتكسير رواسب الأميلويد. يتناسب هذا الإجراء جيدًا مع المهمة العامة للشامبونات في الخلية: وهي الحفاظ على سلامة البروتينات طوال حياتها الوظيفية.
في المقال الأول، اكتشفت الدكتورة آن فانتينك من مجموعة البروفيسور براند بوكاو في جامعة هايدلبرغ أنه من أجل تحطيم رواسب الأميلويد، يجب أن تتجمع العديد من spheromons Hsp70 معًا في نفس النقطة، وتلتصق بالبروتينات الفردية داخل مجموعة الأميلويد وتسحب بها حتى يتم تحريرها من التشابك. في المقال الثانياكتشف الدكتور أوفرا فاوست والدكتور ميتال أبيب أبراهام من مجموعة الدكتور روزنزويج آلية تحكم فريدة تسمح للعائلة الثانية من المرافقين، Hsp40، بإنتاج نفس مجموعة Hsp70 الضرورية لتحطيم الأميلويد.
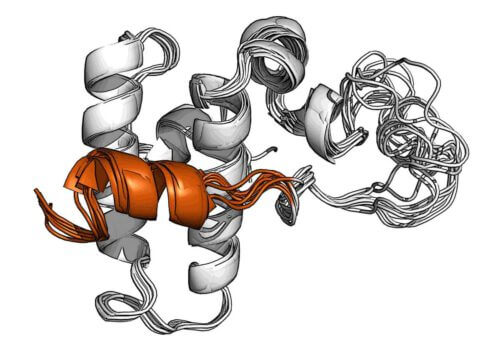
فك رموز بنية البروتين DnaJB1
ومن خلال تجارب الرنين المغناطيسي النووي المتقدمة في معهد كلور للتصوير والتحليل الطيفي بالرنين المغناطيسي عالي الكثافة، نجحت مجموعة الدكتور روزنزويج بالتعاون مع الدكتور نير لندن من قسم الكيمياء العضوية في فك بنية بروتين معين من البروتين. عائلة Hsp40 المعروفة باسم DnaJB1. أظهر فك تشفير البنية أن DnaJB1 يحتوي على حلزون فريد يمنع مؤقتًا موقع الارتباط لجزيء Hsp70. هذا الحلزون هو جزء من آلية تحكم من خطوتين لم يتم التعرف عليها حتى الآن، وهذا هو الذي يسمح لهذا الشكل السداسي، ولو فقط، بتجنيد جزيئات من عائلة Hsp70 بالطريقة اللازمة لتكسير الأميلويدات.
من أجل البدء في عملية التحلل، يجب أولاً تنشيط Hsp70 بواسطة DnaJB1، المرتبط بالفعل بالأميلويد، ولكن تم حظر موقع الارتباط بواسطة القفل الحلزوني. وهكذا، يرتبط Hsp70 أولاً بالهيبارين في موقع آخر، من خلال منطقته غير المنظمة، وهو نوع من "الذيل" الجزيئي. يؤدي هذا الإجراء إلى تحرير القفل الحلزوني ويسمح لـ Hsp70 بالارتباط بـ DnaJB1 في موقع الربط الأساسي، وبالتالي يصبح نشطًا ويبدأ مهمة تحطيم الأميلويد. بعد مرور بعض الوقت، يُغلق القفل الحلزوني، ويتم تحرير Hsp70 ويتم تحرير DnaJB1، الذي لا يزال مرتبطًا بالأميلويد، لالتقاط بروتينات Hsp70 الجديدة وتنشيطها في نفس المنطقة. يؤدي هذا الإجراء المتكرر في النهاية إلى إنتاج الكتلة الحرجة من بروتينات Hsp70 اللازمة لتكسير رواسب الأميلويد.
هذا الفهم الجديد للآليات الجزيئية التي تعمل على تحطيم الأميلويد يثير سؤالًا حول ما إذا كان تطور الأمراض التنكسية العصبية مصحوبًا باضطراب في هذه الآلية - وهو السؤال الذي يمكن أن تمهد إجابته طريقة جديدة لمكافحة أمراض مثل مرض الزهايمر ومرض باركنسون. علاوة على ذلك، فإن نتائج البحث قد تجعل من الممكن فهم العمليات الحيوية الأخرى في الخلية، حيث يعتقد العلماء أن الأقفال الحلزونية المماثلة تستخدم في كريات أخرى من عائلة Hsp40.
