هل البروتينات أكثر "انكشافًا" على وجه التحديد عند طيها؟
حياة البروتين ديناميكية - فهي تتميز بالتذبذبات الداخلية والتبادل المستمر لذرات الهيدروجين السائبة مع جزيئات الماء في بيئتها. وكان التفسير السائد دائمًا هو أن هذه التبادلات تحدث بشكل متكرر أكثر عندما لا يكون البروتين مطويًا، لأن الطي يمنع الماء من الوصول إلى مناطق مختلفة من البروتين. يبدو هذا بديهيًا، ولذلك تم استخدام معدل تبادل الهيدروجين كمقياس لدرجة طي البروتين، وهو جانب مهم من بنية البروتين ويؤثر بشكل كبير على وظيفته. بم لقد أظهر علماء معهد وايزمان للعلوم، باستخدام نهج جديد يعتمد على الرنين المغناطيسي النووي (NMR) جنبًا إلى جنب مع فرط الاستقطاب النووي، أنه في بعض الأحيان يكون من المفيد وضع ما هو واضح على المحك.
ومن أجل إجراء فحص تجريبي لتبادل ذرات الهيدروجين بين البروتينات وبيئتها المائية، قام البروفيسور د. لوسيو فريدمان من قسم الفيزياء الكيميائية والبيولوجية إلى مختبر د رينا روزنزويج من قسم البيولوجيا الإنشائية. يعد طي البروتين أحد الموضوعات البحثية الرئيسية في مختبر الدكتور روزنزويج، المتخصص في دراسة البروتينات المساعدة التي تساعد، من بين أمور أخرى، البروتينات الأخرى على الطي. وقد استخدم العلماء "الدش البارد“الذي طوره البروفيسور فريدمان وزملاؤه لتعزيز حساسية فحص الجزيئات البيولوجية باستخدام الرنين المغناطيسي النووي، حيث تتيح هذه الطريقة دراسة التفاعلات بين الماء والبروتين بمستوى غير مسبوق من التفصيل.
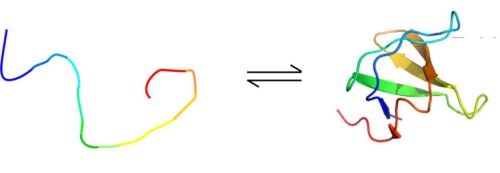
استخدم الدكتور أور سكيلي - الذي كان في ذلك الوقت طالبًا بحثيًا في مختبر البروفيسور فريدمان ولاحقًا باحث ما بعد الدكتوراه في مختبر الدكتور روزنزويج - مع ميكالو نوكوفيتز والدكتور جريجوري أولسن، هذه الطريقة في التجارب على أربعة بروتينات، وتتميز كل واحدة منها بنمط طي مختلف. كان البروتين الأول مطويًا جيدًا، بينما كان البروتين الثاني مطويًا بالكامل. ويتحول البروتينان الآخران بشكل مستمر بين الحالة المطوية وغير المطوية، حيث يتحكم العلماء في معدل التحول باستخدام درجة الحرارة في العينة. في أحد هذه البروتينات الديناميكية، حدثت التحولات ببطء نسبي، حوالي مرة واحدة في الثانية، بينما في البروتين الآخر، الرابع من حيث العدد، حدثت التحولات بمعدل 20 إلى 30 مرة في الثانية.
في البروتينات الثلاثة الأولى، كانت النتائج كما هو متوقع: في الرنين المغناطيسي النووي، تم التقاط إشارات أكثر تضخيمًا في البروتينات (أو المناطق) المكشوفة مقارنةً بالبروتينات (أو المناطق) المطوية. وهكذا، على سبيل المثال، في البروتين الذي تحدث فيه التحولات بين الطي والفتح بمعدل بطيء، زادت الإشارات بمقدار عشرة أضعاف في الحالة غير المطوية مقارنة بالحالة المطوية. لكن في البروتين الرابع، حيث حدثت التحولات بسرعة، كانت المفاجأة للعلماء: خلافًا لكل التوقعات، زادت الإشارة أكثر بكثير - ثلاث مرات أو أكثر - في الأجزاء المطوية من البروتين مقارنة بالأجزاء غير المطوية.
ويقول البروفيسور فريدمان: "لقد كررنا التجارب مراراً وتكراراً لعدة أشهر للتأكد من أننا لم نكن مخطئين"، لكن النتائج ظلت دون تغيير. وقد اقترح العلماء عدة تفسيرات نظرية للنتائج المدهشة، وهم يخططون لمزيد من التجارب لتحديد أي من التفسيرات هو الصحيح. ومع ذلك، يبدو أنه حتى الآن يجب تحديث المعلومات الشائعة: فمن المستحيل الافتراض تلقائيًا أن طي البروتين يحد من إمكانية وصوله إلى المياه المحيطة به.
