يكشف علماء المعهد كيف يؤدي السرطان إلى الهزال المميت ويشيرون إلى طريق العلاج

في حياتنا اليومية كثيرًا ما نميل إلى ارتكاب الأخطاء ونعتقد أن الحل نفسه سيخرجنا من مواقف مختلفة. ويتجلى هذا الفشل أيضًا في الجسم: فعندما تتضرر الخلايا في جسمنا، يسارع جهاز المناعة إلى إرسال خلايا الدم البيضاء إلى مكان الإصابة ويتطور الالتهاب. وهذا بالفعل هو الحل الصحيح لعلاج حالات مثل الإصابة، ولكن عندما يتطور الالتهاب الجهازي استجابةً لنمو سرطاني، فقد يكون ضارًا. وفي دراسة جديدة نشرت مؤخراويكشف علماء معهد وايزمان للعلوم أن الاستجابة الالتهابية تسمح للسرطان بتغيير العمليات الأيضية في جسم المريض، بل وقد تؤدي إلى حالة الهزال المميت. ويظهر العلماء أيضًا أنه من الممكن التنبؤ بفقدان الوزن في المراحل المبكرة من المرض، بل واقتراح علاج محتمل.
لكي تنمو الأورام السرطانية دون سيطرة، تحتاج إلى إمدادات مستمرة من العناصر الغذائية، بما في ذلك السكر والأحماض الأمينية والأحماض الدهنية والنيوكليوتيدات. تستخدم الخلايا السرطانية النيوكليوتيدات – اللبنات الأساسية للحمض النووي – لتكرار شفرتها الجينية والتكاثر. وقد وجدت الدراسات السابقة أن السرطان يحصل على المواد التي يحتاجها من خلال إعادة برمجة العمليات الأيضية في الورم وبيئته الدقيقة. ولذلك، فإن علاج مرضى السرطان اليوم يجمع بين الأدوية التي تمنع عمليات التمثيل الغذائي في البيئة المباشرة للسرطان.
ومع ذلك، في السنوات الأخيرة، بدأ الفهم يتشكل بأن السرطان لا يؤثر فقط على العمليات الأيضية في بيئته المباشرة، بل وأيضاً على بيئته الكلية - أي جسم المريض بالكامل. هذا التأثير له عواقب مدمرة مثل مقاومة الأدوية، وتشكيل النقائل، وكذلك الزحار - وهي حالة يفقد فيها المريض المحتضر وزن الجسم بسرعة ولا يستجيب للأطعمة ذات السعرات الحرارية العالية. لاحترامه دوراً مركزياً في عملية التمثيل الغذائي للجسم وإخراج السموم من الدم، فهو يستشعر ويستجيب لأي تغيير في مستويات المواد في الدم ويحاول موازنتها. ويحدث الهزال المميت عندما يخرج هذا التمثيل الغذائي عن التوازن، والسؤال هو ما إذا كان السرطان خارج الكبد يتمكن من إحداث تغييرات داخل الكبد، وكيف ومتى - وماذا يستفيد من هذا؟
وكانت هذه القضية محور الدراسة الجديدة التي أجراها عمر جولدمان من المجموعة البحثية للبروفيسور. اييليت ايرز في قسم البيولوجيا الجزيئية للخلية في المعهد. ولاختباره، استخدم جولدمان نماذج من سرطان الثدي وسرطان البنكرياس في الفئران. قام أولاً بمتابعة التغيرات في العمليات الأيضية في أجسام الفئران المصابة بالسرطان، مع التركيز على مادة البول التي تتكون من النيتروجين الزائد الذي يصل إلى الكبد على شكل أمونيا، ويتم إخراجها من الجسم عن طريق البول.
""لا يوجد حاليًا علاج للهزال المميت الذي يعد مرحلة نهائية من السرطان. ومع ذلك، فمن الواضح تمامًا أنه من أجل التغلب على المرض، لا يكفي تدمير السرطان - بل من الضروري أيضًا تقوية جسم المريض، وهو أمر مطلوب لمحاربته".
يعد النيتروجين الزائد مصدرًا قيمًا للسرطان النامي، حيث يمكن استخدامه لتكوين الأحماض الأمينية وبالتالي البروتينات والنيوكليوتيدات. في دراسة سابقة من عام 2018 اكتشف علماء من مختبر البروفيسور إيريز، مع زملائهم، أنه في حالات السرطان لدى الأطفال، بدلاً من تحلل الأحماض الأمينية الزائدة في الكبد والتخلص منها في البول، تتمكن الأورام الخبيثة من استخدامها لتلبية احتياجاتها. ونتيجة لذلك، ينمو الورم، وتكون كمية البول المنتجة في الكبد والمفرزة في البول قليلة.
وفي الدراسة الجديدة، نظر العلماء أولاً في كيفية ومتى يؤثر السرطان على الكبد وما الذي يستفيده من تثبيط الدورة البولية. "بعد أيام قليلة من بدء تطور السرطان، اكتشفنا انخفاضًا متفاقمًا تدريجيًا في نشاط "دورة التسلل" ومستويات الإنزيمات التي تحفزها"، يصف جولدمان النتائج. "ونتيجة لذلك، تراكمت كمية كبيرة من الأحماض الأمينية في بلازما الدم لدى الفئران، والتي في حالة صحية طبيعية كانت ستتحلل في الدورة البولية، وبدأ الورم السرطاني في استخدامها لإنتاج النيوكليوتيدات. بمعنى آخر، غيّر السرطان عملية التمثيل الغذائي في الجسم ليتمكن من تغذية نفسه. إضافة إلى أن تراكم الأمونيا الذي كان من المفترض إزالته في البول، أضر بقدرة خلايا الجهاز المناعي على مقاومة السرطان".
حصان طروادة السرطان
ومن أجل الكشف عن آلية العمل التي يعيد السرطان من خلالها برمجة العمليات الأيضية في الكبد، قام فريق العلماء أولاً بالتحقق مما إذا كان تكوين الخلايا في الكبد يتغير. واكتشفوا أنه في الأيام الأولى من تطور السرطان، وفي نفس الوقت الذي تظهر فيه التغيرات في عملية التمثيل الغذائي، تتسلل خلايا الجهاز المناعي إلى الكبد. وحدد العلماء أنها تتكون أساسًا من نوعين من خلايا الدم البيضاء: الخلايا الوحيدة، وهي الخلايا الأم للخلايا البلعمية، والعدلات، التي يتمثل دورها في القضاء على الأنسجة والبكتيريا التالفة. أدرك العلماء أنه مع تقدم المرض، تسللت الخلايا الوحيدة والعدلات الأكثر نضجًا ونشاطًا إلى الكبد. ولكن كيف يؤدي تسلل خلايا الدم البيضاء وتطور الاستجابة الالتهابية إلى تغيرات في استقلاب الكبد؟
من أجل الإجابة على هذا السؤال، قام العلماء بتسلسل جزيئات الحمض النووي الريبوزي (RNA) في خلايا الكبد أثناء تطور السرطان في الفئران. وكشف التسلسل أنه بعد اختراق خلايا الدم البيضاء للكبد، يحدث تفاعل متسلسل، وفي نهايته تتوقف الخلايا عن إنتاج بروتين HNF4-alpha، الذي يعتبر المتحكم الرئيسي في عمليات التمثيل الغذائي. هناك عملية أخرى تتأثر برد الفعل الالتهابي وانخفاض كمية البروتين الزائر وهي إنتاج الألبومين - وهو البروتين الأكثر شيوعًا في الدم والذي يمنع تسرب السوائل من الأوعية الدموية وتطور الوذمة.
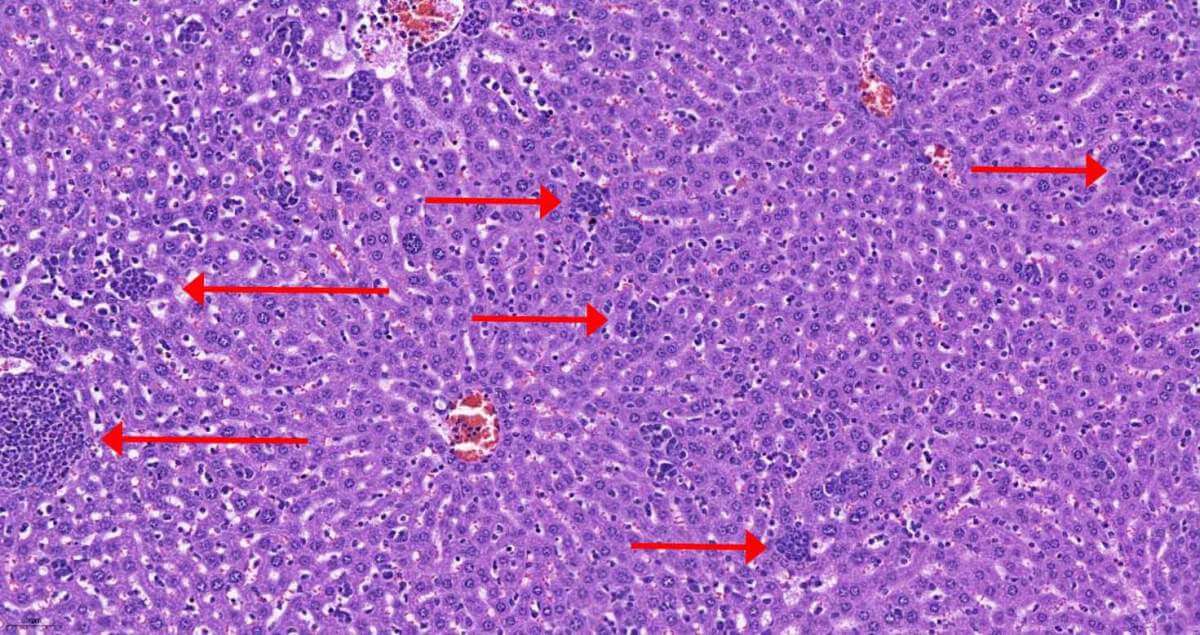
وتسبب توقف إنتاج بروتين التحكم وما صاحبه من انخفاض في إنتاج الألبومين في فقدان الفئران للوزن وربما يكون تفسيرا لظاهرة الهزال القاتل التي تجعل من الصعب على مرضى السرطان مقاومة المرض مع تدهور حالتهم. لكن نتائج البحث تبعث الأمل أيضًا: فقد استخدم العلماء طريقة العلاج الجيني من أجل إعادة خلايا الكبد لدى الفئران المصابة بالسرطان وإنتاج بروتين التحكم، وبالتالي وقف تطور السرطان. بعد العلاج، فقدت الفئران وزنًا أقل وأنسجة دهنية أقل وعانت من وذمة أقل. بالإضافة إلى ذلك، كانت الأورام السرطانية نفسها أصغر لدى هذه الفئران وكانت معدلات بقائها على قيد الحياة أعلى.
ونظرًا لأن التغيرات في التمثيل الغذائي حدثت في وقت مبكر جدًا من تطور المرض، فقد افترض العلماء أن مؤشرات الكبد المختلفة قد تتنبأ بالمرضى الذين سيصابون بالهزال المميت. وطوّر الفريق مؤشرًا رقميًا لوظائف الكبد بناءً على نتائج اختبار الدم الروتيني للألبومين ومكونات الدم الأخرى. وعندما أجروا النموذج على قواعد بيانات كلاليت للخدمات الصحية، ومركز "شيفا" الطبي (تل هشومير) ومركز "سوراسكي" الطبي في تل أبيب (إيخيلوف)، اكتشفوا وجود علاقة بين مؤشرات الكبد قرب وقت الإصابة بالسرطان التشخيص وفي المراحل المبكرة من المرض وبين فقدان الوزن وبقاء المريض على قيد الحياة.
"في الوقت الحالي لا يوجد علاج للهزال المميت الذي يعد مرحلة نهائية من السرطان. "ومع ذلك، فمن الواضح تمامًا أنه من أجل التغلب على المرض، لا يكفي تدمير السرطان - بل من الضروري أيضًا تقوية جسم المريض، وهو أمر ضروري لمحاربته"، يقول البروفيسور إيريز. "إن المؤشر الذي طورناه يجعل من الممكن التنبؤ بفقدان الوزن ومحاولة علاجه في مرحلة مبكرة. أعتقد أن الفهم المتزايد لكيفية تغيير السرطان لعملية التمثيل الغذائي لجسم المريض، بالفعل في بداية المرض، وكذلك العلاجات الجينية التي يمكن أن تمنع هذه التغييرات، قد يمهد الطريق في المستقبل القريب لأدوية جديدة من شأنها أن تساعد في علاج السرطان. يتم دمجها في الخطط العلاجية لمرضى السرطان الموجودين بالفعل في المراحل المبكرة من المرض."
كما شارك في الدراسة الدكتور ليتل أدلر، والدكتورة إيما حجاج، والدكتورة نعمة درزي، وسيفان جالاي، وهيلا تيشلر، وجوردان أرياب من قسم بيولوجيا الخلايا الجزيئية في المعهد؛ والدكتور توماسو كروزا من قسم علم الأعصاب في المعهد؛ دور لافي والبروفيسور نيتا إيرز من جامعة تل أبيب؛ والدكتورة ليات عليجور، والدكتور روني أورين، والدكتور يوري كوزنيتسوف من قسم الموارد البيطرية في المعهد؛ إيال دافيد والبروفيسور عيدو عميت من قسم المناعة الجهازية في المعهد؛ والدكتور رامي اسحق والأستاذ عاموس تاني من قسم علوم الحاسوب والرياضيات التطبيقية في المعهد؛ هاني ستوسيل ود. تاليا جولان من المركز الطبي "شيفا" تل هشومير؛ والدكتور عوديد سينجر والدكتور سيرجي ماليتسكي من قسم البنى التحتية لأبحاث علوم الحياة في المعهد؛ الدكتورة رينانا باراك، الدكتورة تمار روبينك والبروفيسور إيدو وولف من المركز الطبي تل أبيب "سوراسكي"؛ البروفيسور روني زاجر من قسم المناعة والتجديد البيولوجي في المعهد؛ البروفيسور آن سعادة من مركز هداسا الطبي والجامعة العبرية في القدس؛ والبروفيسور جو سانغ لي من جامعة سينجكيونكوان في كوريا الجنوبية؛ والبروفيسور شاي بن شاهار من صندوق كلاليت الصحي وجامعة تل أبيب.
